儿童肺炎支原体肺炎的临床特征分析
冯碧红 戴科娜 杨好好 宓科哲 施红波
肺炎支原体(mycoplasmapneumoniae,MP)是导致儿童社区获得性呼吸道感染的重要病原体;在住院儿童社区获得性肺炎中,占 10%~40%[1-2]。近年来,MP肺炎发病率明显上升,临床表现日益复杂。MP感染会损害呼吸系统,同时对肺外多种器官组织造成损伤,包括皮肤黏膜、血液系统、心血管系统、消化系统、肌肉骨骼系统和神经系统等[3],严重时可威胁患儿生命。因此,了解儿童MP肺炎的临床特征,及时给予正确治疗很重要。本研究回顾性总结了228例MP肺炎患儿的临床特征,以提高临床医生对本病的认识。
1 对象和方法
1.1 对象 选取2018年1月至12月本院儿科病区确诊的228例MP肺炎患儿为研究对象,男99例,女129例;年龄 8个月~12岁,平均(4.98±2.86)岁,其中<5岁组121例,≥5岁组107例。纳入标准:(1)符合《儿童MP肺炎诊治专家共识(2015版)》[4]的诊断标准,即临床上有肺炎表现和(或)影像学改变,结合MP病原学检查(急性期血清特异性MP-IgM抗体阳性,或鼻咽部分泌物经PCR检测MP-DNA阳性)可诊断;(2)既往体健,无基础疾病。排除标准:(1)既往有基础疾病,如免疫缺陷、慢性肺部疾病、结缔组织疾病等;(2)经病原学检查证实混合其他病原体感染;(3)入院前予激素、丙种球蛋白治疗者。本研究经医院医学伦理委员会审批通过。
1.2 方法
1.2.1 收集资料 收集患儿入院时临床资料、实验室检查结果、肺部影像学表现、治疗情况及转归等。
1.2.2 诊断标准 难治性MP肺炎(RMPP)符合《儿童MP肺炎诊治专家共识(2015版)》[4]的诊断标准,即经大环内酯类抗菌药物正规治疗7d及以上,临床症状加重,仍持续发热、肺部影像学表现加重者。
1.3 治疗方法 所有患儿予阿奇霉素治疗,静脉滴注(10mg/kg,1次/d,5~7d为 1个疗程)或口服(10mg/kg,1次/d,3~5d为1个疗程)。阿奇霉素治疗1~2个疗程时,加雾化、呼吸道护理、降温补液等处理,对于心肌损害者予营养心肌治疗。
1.4 统计学处理 应用SPSS 20.0统计软件。计量资料用表示,组间比较采用两独立样本t检验;计数资料用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄段患儿临床表现比较 所有患儿临床表现主要有咳嗽228例、发热146例、喘息47例、肺部啰音169例。其中<5岁组患儿出现发热69例(57.02%),明显低于≥5岁组的77例(71.96%),差异有统计学意义(P<0.05);<5岁组患儿出现喘息、肺部啰音分别为38例(31.40%)、112例(92.56%),明显高于≥5岁组的9例(8.41%)、57例(53.27%),差异均有统计学意义(均P<0.05)。所有患儿无神经系统、肾脏、关节、皮肤等其他肺外临床表现。
2.2 不同年龄段患儿实验室及胸部影像学检查结果比较 所有患儿实验室检查结果显示,WBC异常24例,C反应蛋白(CRP)轻度增高124例,降钙素原(PCT)轻度增高59例,肌酸激酶同工酶(CK-MB)增高132例,ALT增高16例;胸部X线片结果显示,除6例外,其他患儿均有改变,主要表现为肺纹理增多、斑片状阴影、大片状阴影、胸腔积液等,<5岁组以肺部斑片状影多见(77例,63.64%),≥5岁组以肺部大片状阴影多见(42例,39.25%)。<5岁组患儿WBC异常的比例低于≥5岁组,CK-MB增高的比例高于≥5岁组,差异均有统计学意义(均P<0.05);而两组患儿ALP增高、PCT增高、ALT增高、胸腔积液的比例比较,差异均无统计学意义(均P>0.05),见表 1。

表1 不同年龄段患儿实验室及胸部影像学检查结果比较
2.3 治疗及转归 除17例经上述治疗1周仍持续高热且胸部X线片提示有进展,考虑RMPP外,其余患儿均临床治愈。对RMPP患儿继续应用激素、丙种球蛋白治疗,有4例患儿病情无缓解,故转上级医院继续治疗,无危重病例出现。
2.4 RMPP与普通MP肺炎(GMPP)患儿实验室检查结果比较 RMMP患儿中性粒细胞百分比(N)、CRP、PCT水平均高于GMPP患儿,差异均有统计学意义(均P<0.05);两组患儿WBC比较,差异无统计学意义(P>0.05),见表 2。
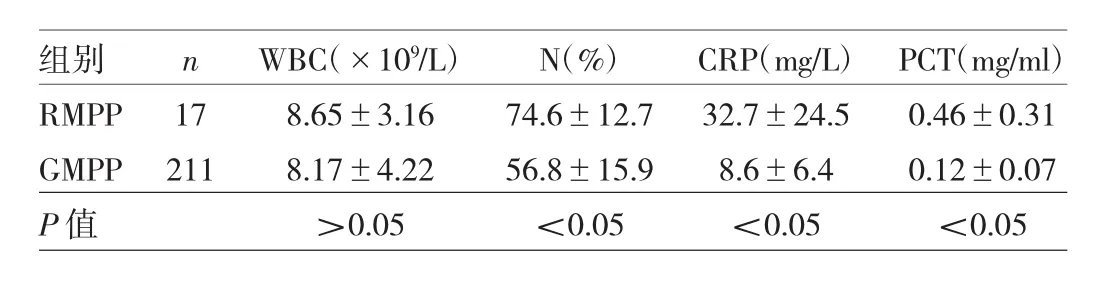
表2 RMPP与GMPP患儿实验室检查结果比较
3 讨论
MP是目前发现的最小原核微生物,其结构简单,介于病毒与细菌之间,主要通过呼吸道传播。儿童MP感染是全球性疾病,发病率逐年增加,不同组织器官均可受累,其中以呼吸道感染最为常见。不同年龄儿童均可发生MP肺炎,以5~15岁儿童多见。近年来,5岁以下的MP肺炎报道也越来越多[4]。因此,本研究以5岁为界分组,比较小年龄组与大年龄组MP肺炎患儿的临床特征。儿童MP肺炎的发病机制复杂,不仅与患儿年龄、性别、精神因素、营养等有关,也与遗传因素、环境条件等有关[5]。亦有研究表明,儿童MP肺炎的发生可能与以下因素有关:(1)MP侵入呼吸道,黏附于呼吸道上皮细胞表面,抵抗黏膜纤毛的清除与吞噬细胞的吞噬;(2)MP黏附于宿主细胞后,其合成的过氧化氢可引起呼吸道上皮细胞的氧化应激反应,对呼吸道上皮造成损伤;(3)MP感染引发机体免疫反应,包括固有免疫及适应性免疫的多个环节,造成多系统损害[6]。
儿童MP肺炎起病缓急不一,病情轻重不一,可出现发热、咳嗽、喘息等肺部表现,也可出现多系统损害表现。本研究所有患儿以发热、呼吸道症状为主要表现,无其他系统受累的表现,其中17例患儿考虑RMPP,无危重病例出现。<5岁组患儿局部症状(喘息及肺部啰音)发生率高于≥5岁组,但全身症状(发热)发生率低于≥5岁组。目前研究认为,MP对宿主的直接损害及机体的免疫应答紊乱是MP致病的主要2个因素[5]。笔者推测5岁以下患儿免疫系统尚未发育完全,未能对MP感染作出全身免疫应答,MP可对呼吸道黏膜造成直接损害,主要表现为局部呼吸道症状;而5岁以上患儿机体免疫系统相对完善,能对MP感染作出免疫应答,易导致免疫紊乱,因此发热等全身症状较为明显。MP感染可造成多种肺外表现,如肌力改变、头痛、意识不清、抽搐等神经系统表现,恶心、呕吐、肝功能损伤等消化系统症状以及关节肌肉疼痛、各类皮疹等,极少数可引起嗜血细胞综合征,危及患儿生命[3]。一项Meta分析评价临床症状识别MP肺炎的价值,结果发现临床症状对识别MP肺炎的意义不大,任何症状的存在或缺失都不能作为肯定或否定MP肺炎的依据[7]。
儿童 MP 肺炎感染指标(WBC、CRP、PCT)大多不高,部分患儿可轻度增高;若继发细菌感染,感染指标增高明显。MP肺炎的影像学改变多种多样,较临床症状明显,是MP肺炎的特征之一[8]。其影像学表现主要是间质性病变、斑片状浸润影、大片状实变影、胸腔积液等。本组患儿的影像学改变符合上述表现,其中胸腔积液发生率达11.84%,高于国内相关报道[9]。同时,笔者发现<5岁组患儿以肺部斑片影多见,≥5岁组患儿以肺部大片浸润影多见;考虑与年长儿童免疫力强、局限感染范围能力较强有关。儿童MP肺炎主要采用大环内酯类抗生素治疗,常用药物有阿奇霉素、红霉素、克拉霉素等。目前全球MP耐药率呈上升趋势,我国MP耐药率逐年上升,明显超过欧美及亚洲其他国家[10-11]。MP耐药机制未完全明确,可能与以下3个方面有关[12-13]:(1)靶位改变:基因突变或甲基化,使支原体的表面抗原发生变异,逃避宿主免疫系统的攻击;(2)主动外排:MP膜成分的改变,出现一种能将药物排出体外、使胞内药物浓度降低的膜蛋白;(3)药物灭活:某些MP可产生大环内酯类抗生素钝化酶,破坏大环内酯类抗生素,使其失活。近年来儿童RMPP发生率明显上升,而MP耐药率升高是造成RMPP的原因之一[14]。有研究认为,N、CRP、PCT、LDH、IL-6、IL-10 是 RMPP 的重要预测指标[15]。本研究比较了RMPP与GMPP患儿的感染指标,发现RMPP患儿N、CRP、PCT均明显高于GMPP患儿,可能与强烈免疫反应、继发混合感染有关。根据国内专家共识,RMPP治疗需予激素[甲泼尼龙1~2mg/(kg·d),3~5d] 、丙种球蛋白[1g/(kg·d),1~2d][4]。本组17例RMPP患儿采用上述治疗后,仍有4例患儿持续发热,故转上级医院继续治疗,予纤维支气管镜支气管肺泡灌洗后好转。
综上所述,儿童MP肺炎临床表现不一,以发热、呼吸道症状为主,可累及肺外多个系统。发生MP肺炎时,部分患儿WBC、CRP、PCT等感染指标可轻度增高,影像学表现较临床症状明显,<5岁组以肺部斑片状影多见,≥5岁组以肺部大片状阴影多见;对于RMPP患儿,激素、丙种球蛋白及纤维支气管镜是较好的治疗手段。

