不同亲疏水性质纳米氧化铝存在下铜对斜生栅藻毒性效应的研究
李晓敏,穆 倩,周苏阳,范文宏,2
1.北京航空航天大学, 空间与环境学院, 北京 102206 2.北京航空航天大学, 医工交叉北京市高精尖创新中心, 北京 100191
随着纳米材料在生活和生产领域越来越多地被制造和使用,不可避免会进入到水环境中,近年来人工纳米材料在水环境中的行为及其对水生生物的影响引起了人们的广泛关注。研究表明,较高浓度的纳米材料会对水生生物产生毒性。如纳米二氧化钛(TiO2)会对斑马鱼肠道和肝脏细胞产生氧化胁迫损伤,其96 h LC50(Lethal Concentration 50,半数致死浓度)为124.5 mg/L[1]。纳米氧化铝(Al2O3)对秀丽线虫的24 h LC50为82 mg/L[2]。纳米氧化石墨烯会导致纹藤壶(AmphibalanusAmphitrite)游动速度减缓和抑制摄食,其48 h LC50为560 mg/L[3]。实际水环境中纳米材料的浓度较低[4],对于水生生物的毒性并不高。然而,纳米材料进入水环境后,会与水中已存在的组分发生作用,如吸附、团聚、沉降、络合等,从而对水环境中原有污染物,如重金属的毒性产生影响[5-7]。因此纳米材料对于水中原有污染物毒性的影响成为纳米材料毒性效应研究的重点。
纳米Al2O3由于其耐高温、耐腐蚀、高吸附、高硬度等特性在微电子、化工、宇航工业等科技领域具有十分广阔的应用前景[8-11],预计年用量可达10万t以上[12]。研究表明,纳米Al2O3本身对水生生物的毒性较低[1, 2, 13],但是进入水环境后对环境中原有污染物的毒性,如对重金属镉(Cd)表现出明显影响。例如,纳米Al2O3能够显著增强金属Cd在铜锈环棱螺体内的生物积累和氧化损伤[14],可以有效减缓铜(Cu)对斜生栅藻(Scenedesmusobliquus)细胞的毒性[15],对于铬(IV)对斜生栅藻的毒性没有显著影响[16]。
纳米材料对重金属毒性的影响受到材料表面修饰、表面电荷、尺寸、亲疏水性质的影响[17]。例如亲水型的纳米颗粒相比较于疏水型的纳米颗粒,更容易进入细胞体内[18]。如纳米TiO2的亲疏水性质会影响大型溞对其生物利用度,亲水型纳米TiO2的生物积累高于疏水型的纳米TiO2,这可能是由于亲水型的纳米TiO2更容易进入大型溞肠道内,而疏水型的纳米TiO2更容易被大型溞排出体外,最终导致亲水型的纳米TiO2生物积累较高[19]。也有研究发现,纳米TiO2老化后对大型溞的急性毒性与纳米颗粒的亲疏水性质有关[20]。但纳米Al2O3的亲疏水性质对重金属毒性的影响,却少有人报道。
本文选取斜生栅藻作为受试生物,研究亲疏水改性后的γ型纳米Al2O3存在下铜离子(Cu2+)对斜生栅藻生长状态、积累量、抗氧化酶活力的影响,通过不同亲疏水性质的纳米Al2O3-Cu的复合暴露实验和纳米Al2O3单独暴露实验进行比较分析,探讨不同亲疏水性质的纳米Al2O3存在下Cu对斜生栅藻的毒性,为纳米材料的使用和管理提供理论基础,为水生生物监测提供新的思路和方法。
1 材料与方法
1.1 纳米Al2O3的来源与性质
纳米Al2O3为宣城晶瑞新材料有限公司提供的气相法制备的亲水型纳米Al2O3(H1),液相法制备亲水性质的纳米Al2O3(H2)和硅烷偶联剂KH550处理后疏水性质的纳米Al2O3(L0),其具体成分性质见表1。

表1 3种纳米Al2O3的性质Table 1 Properties of three nano-Al2O3
1.2 受试微藻及培养条件
斜生栅藻购于中国科学院武汉水生生物研究所淡水藻种库,在实验室进行驯化、培养。驯化条件如下:采用BG11培养基(BG-11 Medium for Blue Green Algae,蓝绿培养基)[21],置于恒温气候箱中培养,温度(23±1) ℃,光照强度131.4 μmol/(m2·s),光暗周期12 h:12 h,静置培养,每天定时人工摇动3次。
1.3 实验介质
本研究中,斜生栅藻的保种和扩大培养采用BG11培养基,其他实验(如吸附实验和毒性实验)采用修改后的BG11培养基,具体见表2。参照YANG等[22]对WC培养基的修改,本研究去除原培养基中的乙二胺四乙酸二钠(EDTA-Na2)(1 mg/L),避免其参与竞争络合金属离子而影响之后实验;此外去除培养基中所有的痕量金属,防止出现沉淀如锰离子(Mn2+)和排除培养基中原有Cu2+的干扰。

表2 修改后的BG11培养基Table 2 Modified BG11 medium mg/L
1.4 实验介质中3种纳米Al2O3的理化性质
将3种纳米Al2O3分别加入到修改后的BG11培养基中,超声10 min,配制成浓度均为1 000 mg/L 的母液备用。正式实验前,超声振荡30 min,使悬浮液分散均匀,用修改后的BG11培养基稀释得到浓度均为1 mg/L的 H1、H2、L0。
为了探究不同亲疏水性质的纳米Al2O3的稳定性,取适量新配制的H1、H2、L0静置,分别在0、24、48、96 h用纳米粒度ZETA电位分析仪(Zetasizer Nano ZS,英国)分析颗粒水力学尺寸和Zeta电位。
为探究H1、H2、L0的粒径和形态,用聚醋酸甲基乙烯脂负载的铜网作为载体,用毛细管取适量溶液滴在铜网中间,放置于超净台内,自然风干后采用JEM-2100F型透射电镜进行拍摄观察。
1.5 纳米氧化铝与铜离子的吸附实验
Cu2+浓度为0.5 mg/L,H1、H2、L0浓度为1 mg/L,每组均设2个平行,在150转/min、25 ℃下振荡6 h。在10、20、30、40、50、60、180、360 min取样2 mL,于12 000转/min转速下离心10 min,取上清液用感应耦合等离子体质谱仪(ICP-MS)(VG PQ2 TURBO,英国)测定Cu2+浓度。
1.6 暴露实验
取适量处于对数生长期的藻细胞以4 500转/min离心15 min,用无菌修改后的BG11培养基清洗3次,按1.0×106cells/mL藻密度接种。设置4个阴性对照组、1个阳性对照组、3个实验组,各组试剂组成情况见表3。其中不加纳米材料和Cu2+的1组为阴性对照组a(Control),只加入纳米材料不加入Cu2+的3组为阴性对照组b(H1、H2、L0),不加入纳米材料只加入Cu2+的为阳性对照组(Cu),剩余3组为实验组(H1′、H2′、L0′),每组设3个重复,混合体系稳定时间设置为3 h,暴露时间4 d。

表3 实验介质中对照组和实验组试剂添加情况Table 3 Reagents addition and the contents of nano-Al2O3 in control groups and treatments mg/L
注:“*”阴性对照组a;“#”阴性对照组b;“**”阳性对照组;“##”实验组。
每隔24 h取适量藻液,利用754型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司)测定藻液在650 nm处的吸光度,得到斜生栅藻的生长情况。
每隔24 h取适量藻液,以4 500转/min转速离心15 min收集藻细胞,加入磷酸缓冲液(0.05 mol/L,pH7.8),利用超声波细胞破碎仪(宁波生物科技有限公司)冰浴破碎细胞,于12 000转/min转速下离心10 min,取上清粗酶液,用SOD(超氧化物歧化酶)、GSH(谷胱甘肽)、MDA(丙二醛)试剂盒(南京建成生物工程研究所)参照测试盒说明书测定SOD活力和GSH、MDA的含量。
1.7 不稳态铜及细胞内铜积累量与铝的富集量的测定
不稳态铜的测定:每隔24 h取适量藻液,以4 500转/min转速离心15 min,取上清液以12 000转/min转速离心10 min,取上清液10 mL用伏安极谱仪(797VA computrace system)测不稳态铜。测试条件和参数设置:悬汞电极作为工作电极;电解质为氯化钾(0.03 mol/L);实验温度为(23±1) ℃;扫描速率为15 mV/s;脉冲振幅为50 mV。测试前通高纯氮气(N2)除氧15 min。
暴露96 h后,取适量藻液,以4 500转/min离心15 min,用10 mM的EDTA-Na2洗脱3次,加入1 mL浓硝酸消解,定容后用ICP-MS测定样品中Cu2+、Al3+(铝离子)浓度。接种后15 min以相同方法测定此时不能被EDTA-Na2洗脱的吸附的Cu2+。用96 h时的Cu2+含量扣除这部分吸附的Cu2+,得到真正吸收进入细胞的铜的含量[22]。
1.8 统计学分析
利用软件SPSS Statistics 20中的LSD方法进行单因素方差显著性分析(one-way ANOVA),实验数据使用软件Origin 8.0 进行绘图。
2 结果与讨论
2.1 纳米Al2O3在溶液中的存在状态
动态光散射(DLS,Dynamic Light Scattering)的表征结果如图1(a)所示:3种纳米Al2O3的平均水力学直径随着时间而迅速增大,但不同材料的增大幅度相差较为明显。96 h后,H1增大到约为112 nm,H2增大到约为246 nm,L0增大到约为701 nm,并且均远远大于实验所用的纳米Al2O3的原始粒径(均为20 nm)。实验结果表明,不同性质的纳米Al2O3在实验介质中的团聚程度明显不同。L0团聚最为严重,H2次之,H1最小。
Zeta电位与纳米材料的分散性和稳定性密切相关。有研究表明,当Zeta电位的绝对值大于30 mV时,溶液具有良好的稳定性和分散性[23]。从图1(b)中可以看出,3种纳米Al2O3的Zeta电位随时间略有增加,但整体上并没有明显差别,基本处于-18 mV左右。96 h时,H1、H2、L0的Zeta电位分别为-18.93、-18.63、-18.74 mV,绝对值均小于30 mV,再次证明3种性质的纳米Al2O3在实验介质中稳定性较差,易于聚沉。3种性质的纳米Al2O3的团聚程度还可以从透射电镜(TEM)图片(图2)中得到证实,其中L0团聚体粒径最大,部分超过了400 nm(图2c)。

图1 不同性质纳米Al2O3颗粒在水中的平均水力学直径及Zeta电位Fig.1 Properties of nano-Al2O3 in the exposure solution mean hydrodynamic diameter and zeta potential

图2 不同性质的纳米Al2O3的TEM图片Fig.2 Transmission electron microscope images of three nano-Al2O3
图3显示了纳米Al2O3在实验介质中与Cu2+的吸附作用。可见,纳米Al2O3的存在均可使实验介质中Cu2+的含量迅速降低,并在较短时间内(180 min)达到动态平衡,但不同性质的纳米Al2O3之间并无显著差异(p>0.05,one-way ANOVA)。180 min时,H1、H2、L0溶液中Cu2+的浓度分别降低为165.36、165.64、158.08 μg/L,同初始浓度相比较可以看到H1与H2对Cu2+的吸附作用相近,L0相对更强。
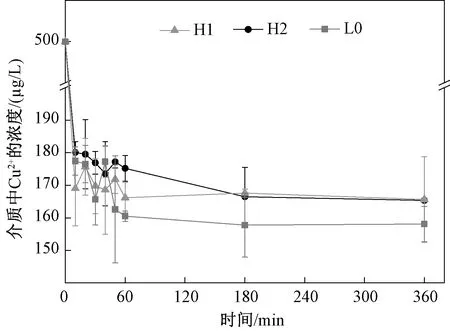
图3 不同性质的纳米Al2O3对实验介质中Cu2+的吸附作用Fig.3 Copper concentration after Cu2+ adsorption onto three nano-Al2O3 in the modified BG11 medium
2.2 纳米Al2O3存在下Cu2+对斜生栅藻生长的影响
由图4可知,不同亲疏水性质的纳米Al2O3分别处理96 h后,实验组与阳性对照组的生物量存在明显差异(p<0.05,one-way ANOVA),但是不同实验组之间并未表现出显著差别(p>0.05,one-way ANOVA);含有纳米Al2O3的阴性对照组b和不含纳米Al2O3的阴性对照组a的生物量未表现出明显差异(p>0.05,one-way ANOVA)。
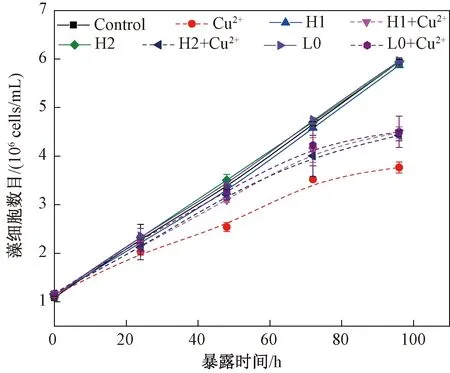
图4 不同体系中斜生栅藻的生长情况Fig.4 Growth of Scenedesmus obliquus exposed to copper and copper/nano-Al2O3 systems
与阴性对照组a相比,阳性对照组中斜生栅藻的生长受到明显抑制,在96 h生长抑制率达到36.7%,这说明Cu2+在低浓度暴露下(0.5 mg/L)对斜生栅藻的生长产生明显的抑制作用;而阴性对照组b中藻细胞的生长情况与之相近,这说明低浓度的纳米Al2O3(1 mg/L)对斜生栅藻的生长没有明显的毒性。与阳性对照组相比,加入3种不同的纳米Al2O3的实验组中藻细胞的生长抑制均得到缓解,实验组中的藻细胞生长抑制率比阳性对照组的生长抑制率降低了约32.4%,这说明3种性质的纳米Al2O3均可有效降低Cu2+的毒性,缓解Cu2+对藻细胞生长的抑制作用。培养4 d后,含有H1、H2、L0的实验组的生长抑制率并无明显差别,分别为24.6%、25.6%、24.2%。
2.3 金属的生物可利用性
阳极溶出伏安法(ASV)是痕量元素形态分析的有效技术手段,能够准确测定金属不稳态组分的含量[24]。图5显示了不同亲疏水性质的纳米Al2O3存在下藻液内不稳态铜的浓度。由图5可知,实验组与阳性对照组中不稳态铜的浓度变化趋势相近,但浓度之间存在显著差别(p<0.05,one-way ANOVA),而不同实验组之间并未表现出明显差别(p>0.05,one-way ANOVA)。0 h 时,阳性对照组、含有 H1的实验组、含有 H2的实验组、含有 L0的实验组中的不稳态铜的浓度分别为122.5、42.0、40.5、42.1 μg/L;处理24 h后,不稳态铜的浓度快速降低,降低幅度分别为39.2%、13.1%、11.1%、14.3%;而在之后的72 h中,不稳态铜的浓度降低幅度明显减缓,96 h 时分别降至66.5、35.0、32.5、31.5 μg/L,这说明纳米Al2O3可以有效降低藻液中不稳态铜的浓度。

图5 不同性质的纳米Al2O3存在下藻液中不稳态铜的浓度Fig.5 Concentration of labile copper exposed to copper and copper/nano-Al2O3 systems
图6(a)显示了铜在斜生栅藻中的积累情况。可以看出,暴露96 h后,在对照组与各实验组中均有铜的积累。阴性对照组b与阴性对照组a中铜的积累无显著差异(p>0.05,one-way ANOVA),铜积累量在21.67~25.68 ng/mg(藻干重)。阳性暴露组中铜的积累最大,为513.35 ng/mg(藻干重),加入H1、H2、L0后Cu积累分别降低了76.56%、76.15%、76.69%,降低显著(p<0.05,one-way ANOVA),但不同纳米Al2O3体系之间并未表现出明显差异(p>0.05,one-way ANOVA),铜积累量分别为120.36、122.45、119.65 ng/mg(藻干重)。这说明纳米Al2O3的加入可以明显降低铜在藻细胞中的积累量,亲水性质的H1、H2和疏水性质的L0对降低铜的积累量的作用差别不明显。
斜生栅藻对纳米Al2O3的富集,包括细胞表面粘附和内吞的颗粒2部分。图6(b)显示了铝在斜生栅藻上的富集情况。可以看出,暴露96 h后,在对照组与各实验组中都有铝的富集。阴性对照组a和阳性对照组中铝的含量较低且无明显差异(p>0.05,one-way ANOVA),阴性对照组b和实验组之间铝的富集较高且无明显差异(p>0.05,one-way ANOVA),并且不同实验组之间也无显著差别(p>0.05,one-way ANOVA)。藻细胞富集的纳米Al2O3主要可能是吸附于细胞表面的部分,并且藻细胞对纳米材料的吸附是比较显著的。其他研究者的实验结果也表明,纳米颗粒与藻细胞表面存在相互作用[25]。有研究发现月牙藻(Pseudokirchneriellasubcapitata)细胞表面能携带超过自身重量2.3倍的纳米颗粒[26]。
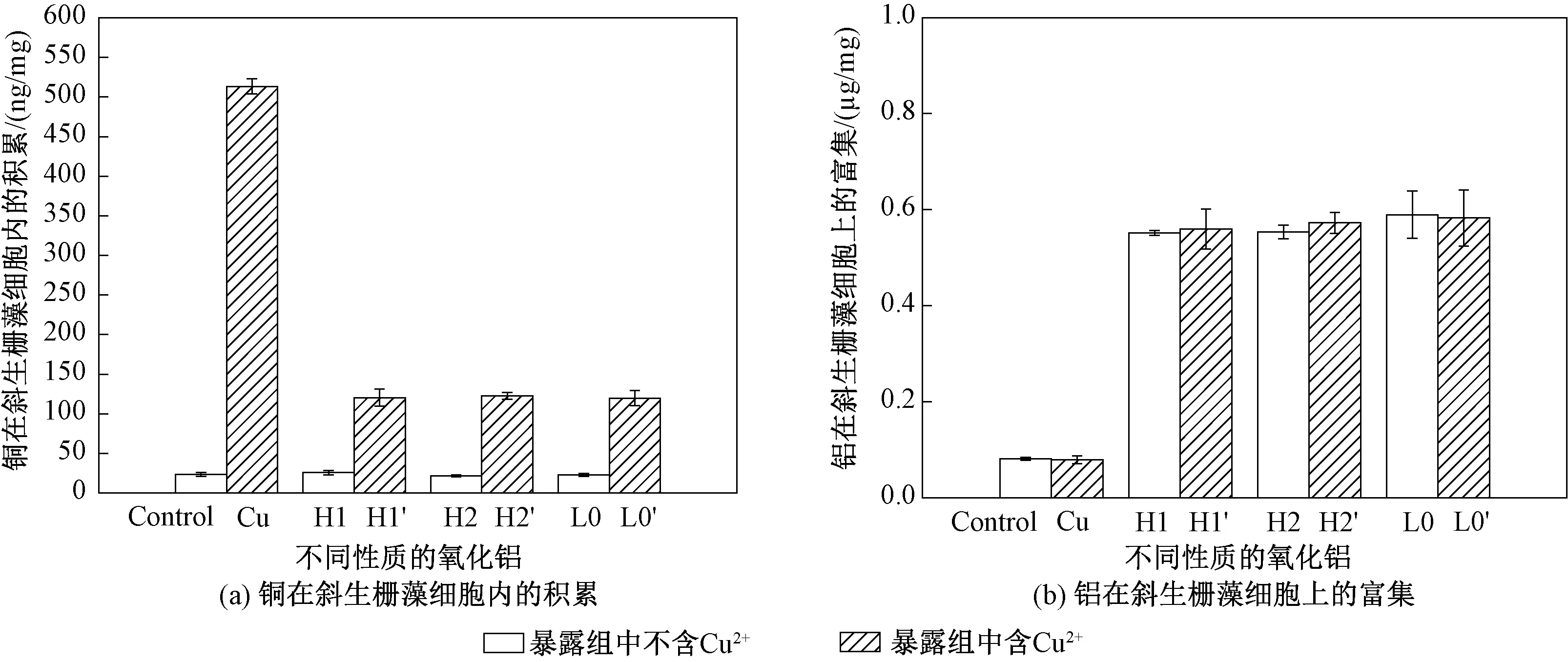
图6 斜生栅藻细胞中铜和铝的积累量Fig.6 Cu and Al accumulation in algae cells
2.4 纳米Al2O3对斜生栅藻细胞内SOD活性和GSH、MDA含量的影响
测试了暴露于修改后的BG11培养基、3种纳米Al2O3、Cu2+和Cu2+-纳米Al2O3体系下斜生栅藻细胞中SOD活性随时间的变化,见图7。由图7(a)可以看出,4组处理组中藻体的SOD活性均随着暴露时间的增加逐渐增加,H1、H2、L0与对照组间不存在显著差别(p>0.05,one-way ANOVA)。
从图7(b) 可以看出,4组处理组中藻体的SOD活性先增加后减小,阳性暴露组的SOD活性在48 h后快速下降,与实验组存在明显差别(p<0.05,one-way ANOVA),这说明Cu2+处理后的藻细胞的SOD活性被显著抑制,48 h时SOD活性达到最大值29.75 U/mgprot,之后逐渐降低,96 h降至最低值19.95 U/mgprot。而含有纳米Al2O3的Cu2+暴露体系的藻细胞SOD活性在48 h后相比阳性暴露组下降明显减缓,而不同实验组之间SOD活性的变化趋势基本一致(p>0.05,one-way ANOVA)。
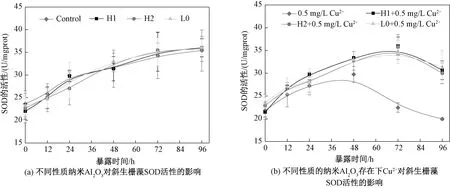
图7 不同暴露条件下斜生栅藻的SOD活性Fig.7 SOD activities in Scenedesmus oliquus exposed to copper and copper/nano-Al2O3 systems
从图8(a)可以看到,经3种纳米Al2O3处理的斜生栅藻内GSH含量与对照组没有明显差别(p>0.05,one-way ANOVA)。当藻细胞单独暴露于纳米Al2O3时,其GSH含量随着时间没有明显改变(p>0.05,one-way ANOVA)。从图8(b)可以看出,当藻细胞暴露于Cu2+时,GSH含量随着时间逐渐增加,且GSH含量明显高于含有纳米Al2O3的Cu2+暴露组(p<0.05,one-way ANOVA),但是不同纳米Al2O3的Cu2+暴露组之间GSH含量并没有显著差别(p>0.05,one-way ANOVA)。96 h时,Cu2+、Cu2+-H1、Cu2+-H2、Cu2+-L0处理组中GSH含量分别为4.06、2.51、2.53、2.42 mg/gprot。
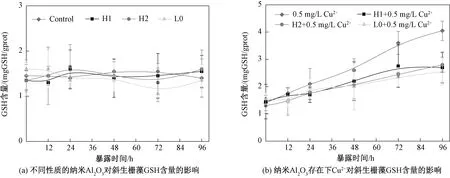
图8 不同暴露条件下斜生栅藻的GSH含量Fig.8 GSH concentrations in Scenedesmus oliquus exposed to copper and copper/nano-Al2O3 systems
MDA不仅是自由基损伤脂质的生物标记,也是细胞膜损伤的指示[27]。从图9(a)可以看出,当藻细胞单独暴露于3种纳米Al2O3时,其MDA含量随着时间没有明显改变(p>0.05,one-way ANOVA),且与对照组不存在显著差别(p>0.05,one-way ANOVA)。
从图9(b)可以看出,含有纳米Al2O3的Cu2+暴露组与Cu2+单独暴露组MDA的含量不存在明显的差别(p>0.05,one-way ANOVA),并且3种纳米Al2O3之间没有显著差别(p>0.05,one-way ANOVA),藻细胞的MDA含量均随着时间缓慢增加。96 h时,Cu2+、Cu2+-H1、Cu2+-H2、Cu2+-L0处理组中MDA含量分别为23.2、22.0、22.5、22.3 nmol/mgprot。

图9 不同暴露条件下斜生栅藻的MDA含量Fig.9 MDA concentrations in Scenedesmus oliquus exposed to copper and copper/nano-Al2O3 systems
2.5 纳米Al2O3的亲疏水性质对水体中铜的生物毒性的影响
氧化应激是评价纳米材料水生毒性机理的重要内容。根据氧化应激分级假说,最低程度的氧化应激与抗氧化剂和具有解毒作用的酶有关;较高程度的氧化应激表明炎症和细胞毒性超过了这种保护响应的能力[28]。从SOD活性、GSH含量、MDA含量随时间的变化来看,1 mg/L不同亲疏水性质的纳米Al2O3单独存在不会对斜生栅藻产生明显的毒性效应,但是分别含有亲、疏水性质的纳米Al2O3的Cu2+暴露体系不同,其斜生栅藻抗氧化反应可以分为2个阶段:第一阶段(0—72 h),暴露开始后,Cu2+通过酶反应和非酶反应,产生O2-·、1O2、·OH、LO·、LOO·、LOOH,生物体内抗氧化体系被激活,SOD活性、GSH含量明显增加,开始清除自由基;第二阶段(72—96 h),由于进入细胞的污染物不能被及时清除,持续诱导自由基产生,超过了细胞氧化应激的限度,SOD活性被抑制,GSH、MDA含量持续增加。仅含有Cu2+的暴露体系中SOD活性在48 h就开始被抑制,而含有纳米材料的Cu2+暴露体系72 h后开始被抑制,可见纳米材料的加入缓解了Cu2+对藻细胞的毒性。
痕量金属对水生生物的生物有效性和毒性依赖于金属的物理化学形态,测定金属的形态比金属的总浓度更有助于探究金属对水生生物的影响[29-30]。ASV测得的不稳态铜包括Cu2+和易于解离的铜复合体,这些被认为是生物可利用的部分[24, 31]。ASV测得的不稳态铜的浓度与毒性之间的相关性有利于预测铜对水生生物的毒性。图10是不同性质的纳米Al2O3存在下以比生长率为基础的抑制率与降低的不稳态铜的浓度之间的相关性。可以看出,Cu2+单独暴露组、含有H1的Cu2+暴露组、含有H2的Cu2+暴露组、含有L0的Cu2+暴露组以比生长率为基础的抑制率与降低的不稳态铜的浓度之间,虽然正相关性并不明显(p>0.1),但依然呈现正相关趋势。这说明导致藻细胞毒性的主要原因是实验体系中的不稳态铜。正相关性不显著,可能是由于电化学方法测定金属形态还不能很好地揭示弱结合的金属复合物,而这部分很有可能是可生物利用的[32]。虽然如此,电化学方法测定的不稳态金属浓度仍是目前作为分析生物可利用的金属浓度的很好参考。也有藻类生物测试结果表明,铜毒性的显现是由于ASV测得的不稳态铜[33]。有研究表明,不稳态铜的最高浓度与铜的生物可利用的最高浓度出现在同一个调查地点[34]。还有研究表明,大约50%~90%的溶解态铜是不稳态铜,并且有被生物利用的可能[35],ASV测得的不稳态铜与生物可利用的铜具有一致性[35]。
本实验结果表明,纳米Al2O3的加入使得大量铜离子被吸附,进而大大降低了藻液中的不稳态铜的浓度,从而降低了Cu2+对藻细胞的毒性作用。在本实验所采用的低浓度下,3种纳米Al2O3虽然在亲疏水性和分散性之间存在明显差别,但是对Cu2+的吸附性能方面不存在显著差异,造成藻液中的不稳态铜的浓度也不存在明显差别。因此,含有H1的Cu2+暴露组、含有H2的Cu2+暴露组、含有L0的Cu2+暴露组的藻细胞毒性没有显著差别。

图10 不同性质的纳米Al2O3存在下以比生长率为基础的抑制率与降低的不稳态铜的浓度之间的相关性Fig.10 Correlation between inhibition of growth rate and decreased labile copper concentration
3 结论
纳米Al2O3的存在均可以降低水环境中Cu2+对斜生栅藻的毒性效应,但其亲疏水性质对Cu2+毒性效应的影响没有显著的不同。主要表现如下:在纳米Al2O3存在下, Cu2+的生物可利用性,Cu2+对藻细胞的生长抑制和所引起的藻细胞氧化损伤和藻液中的不稳态铜的浓度都明显降低。原因主要是纳米Al2O3吸附水中的Cu2+,间接降低了藻液中的不稳态铜的浓度,从而减轻了Cu2+对藻细胞的毒害。

