含铈硅酸钙修饰的PET人工韧带对移植物-骨愈合影响的实验研究
康展荣 傅声扬 俞斌 丁惠锋, 胡健 禹宝庆 黄建明
1 复旦大学附属浦东医院骨科(上海201399)
2 上海理工大学材料与工程学院(上海200093)
3 复旦大学上海医学院,上海市公共卫生临床中心,骨科(上海200032)
前交叉韧带(anterior cruciate ligament,ACL)损伤是最常见的膝关节韧带损伤,多发生于青少年、运动员和经常参加体育锻炼的人群。文献报道,每年ACL 断裂的发生率在30~78/10 万人[1]。由于ACL 血管化[2,3]和自愈能力差[4],断裂后如不及时治疗会继发半月板损伤,破坏关节软骨[5],引发创伤性骨关节炎。ACL 重建可以很好地恢复膝关节稳定性[6],是目前ACL断裂后的主要治疗方法。ACL 重建常用的材料有自体移植物、异体移植物和人工合成移植物。自体移植物存在手术时间长、供区损伤并发症、来源不足等缺陷,而异体移植物术后愈合时间较长,有传播疾病、引发免疫排斥的风险[7],异体移植物往往需要经辐射或化学灭菌,使其术后失败率也大大增加[8]。LARS(ligament advanced reconstruction system)韧带是目前临床上应用最多的人工移植物,其主要成分是聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)。近年来,短期、中期和长期临床研究[9-11]结果表明,PET 韧带的治疗效果与自体移植物相似,甚至优于自体移植物,而且具有材料容易获得、手术时间短、术后恢复快[3,12]等优势。然而,PET 材料的疏水性能是PET 韧带的一个主要缺陷[13],这使得PET 韧带的细胞相容性较差,不利于细胞在其表面黏附、增殖以及血管的再生,导致韧带与宿主骨之间的接合不紧密,增加手术失败的风险。大量的研究表明,对PET移植物的表面进行涂层修饰,可以改善PET的疏水性能,促进细胞在其表面的黏附、增殖和成骨分化[14,15],体内实验也证实涂层修饰可以促进移植物与宿主骨之间的愈合[16-18]。
近年来,硅酸钙(calcium silicate,CS)生物陶瓷在骨组织工程和再生修复领域引起了研究者的关注。CS具有较高的亲水性[19],CS释放的钙、硅离子能够诱导并促进其表面羟基磷灰石层的形成,因而具有良好的生物学活性[20,21]。研究表明,CS 在体外能够促进成骨相关细胞的增殖分化,体内能够与宿主骨直接接合,促进骨组织再生[22,23]。在CS中加入(掺入)金属元素和(或)金属氧化物之后,得到的复合硅酸钙生物陶瓷(doped calcium silicate bioceramics,DCSBCs)的生物学性能得到进一步提升。有研究表明在硅酸钙材料中加入钛、锆等活性离子,可以明显提高其生物活性和力学性能[24,25]。因此,DCSBCs 在骨再生修复领域有着巨大的开发潜力和应用前景。铈(cerium,Ce)是一种稀土元素,目前被广泛应用于催化、燃料电池和微电子等工业领域。研究发现,纳米氧化铈(CeO2)具有抗氧化、抗炎、抗细胞凋亡和促进血管再生的功能。氧化铈材料在骨、皮肤等领域的研究已有文献报道[26,27],3D打印制备的CeO2掺入的介孔硅酸钙生物支架也被证实具有良好的促进骨再生的能力[28]。本研究将含铈的硅酸钙(Ce-CS)涂覆于PET人工韧带表面,通过体外和体内实验来研究Ce-CS涂层对移植物-骨愈合的影响。
1 材料和方法
1.1 材料
1.1.1 材料来源
临床前交叉韧带重建术后的LARS韧带残端。
1.1.2 材料处理和分组
将临床ACL重建术后剩余的PET韧带纤维于75%的酒精中浸泡4 h 去渍,然后用去离子水清洗3 遍,在37℃烘箱中烘干后,将PET 韧带剪成与24 孔板或6 孔板孔径大小相同的圆形。
制备10 mol%的含铈硅酸钙(Ce-CaSiO3)溶胶。将8.67 g Ca(NO3)2·4H2O、8.5 g原硅酸四乙酯(TEOS)和1.77 g Ce(NO3)3·6H2O在38℃下溶于130 ml蒸馏水和20.5 ml HCL溶液中,水浴24小时。
将裁剪好的PET 片浸入制备的溶胶溶液中,在磁力搅拌下浸泡5、15、30分钟,浸渍处理的PET片为实验组,未经任何处理的PET 片为对照组。将所有PET 片在37℃烘箱中干燥备用。
1.1.3 主要试剂
Ca(NO3)2·4H2O、原硅酸四乙酯(TEOS)、Ce(NO3)3·6H2O、HCL 溶液(均由上海理工大学提供),α-MEM培养液(Hyclone 公司),胎牛血清(FBS,Gibco 公司),青-链霉素(Gibco 公司),0.25% Trypsin -EDTA 溶液(Gibco公司),CCK-8试剂盒(日本Dojindo公司),细胞裂解液(上海威奥生物公司),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(Beyotime 公司),Tri⁃tonX-100(Sigma 公司),SYBR GREEN PCR Master Mix(Life 公司),Trizol(Invitrogen 公司),QuantiTect Re⁃verse Transcription Kit(QIAGEN 公司),RNA 引物( 上海生工公司),茜素红染剂(Solarbio),氯化十六烷基吡啶(Amresco 公司),2.5%戊二醛(北京索莱宝公司),维生素C(北京索莱宝公司),地塞米松(北京索莱宝公司),β-甘油磷酸钠(北京索莱宝公司)。
1.2 实验动物
1.2.1 SD大鼠
4周龄、雄性SD大鼠2只(斯莱克公司)。
1.2.2 新西兰大白兔
雄性、体重2.7 ± 0.5 kg的新西兰大白兔12只。
1.3 方法
1.3.1 rBMSCs的提取和培养
将SD大鼠颈椎脱臼处死后,置于75%的乙醇中浸泡消毒5 min,剪去腹壁和后肢皮毛,取双侧股骨和胫骨,去除骨组织周围的肌肉和软组织,用预冷的PBS清洗3次;切除股骨、胫骨两端的干骺端,暴露骨髓腔,用PBS 冲洗骨髓腔,收集冲洗液,1000 rpm,离心8 分钟;配置细胞培养所需的完全培养基(α-MEM培养基中加入10% FBS 和1%青链霉素);用完全培养基重悬离心得到的细胞沉淀,接种到培养皿中,将培养皿放置于37℃、5%CO2的培养箱中培养,培养约7 天后细胞长至80%~90%,得到原代rBMSCs;rBMSCs 传代培养,取传至第4代的细胞进行实验。
1.3.2 表面涂层及其性能检测
将两组的PET 韧带喷金处理后,通过SEM 观察材料表面形态,EDS分析材料表面的元素组成;材料表面的水接触角实验,检测材料的亲水性能。根据本部分实验结果确定后续实验中材料处理的时间。
1.3.3 细胞增殖检测
在进行所有的细胞实验之前,两组PET 材料均经环氧乙烷灭菌,在完全培养液中浸泡2小时后使用。
按1×104/孔的密度将rBMSCs 接种到24 孔板中的材料表面,在接种培养后的第1、3、7 天用CCK-8 试剂盒检测细胞增殖活性。弃掉培养基,无血清的培养基清洗1遍,每孔加入40 μL CCK-8反应液和360 μL无血清培养液,37℃培养箱中孵育2 h。反应结束后每孔吸取200 μL 转移至96 孔板中,酶标仪检测450 nm 处的吸光度。
1.3.4 碱性磷酸酶(ALP)活性检测
按1×104/孔的密度将rBMSCs 接种到24 孔板中的材料表面,待细胞融合至80%时,将培养基更换为成骨诱导培养液(β-甘油磷酸钠10 mM/L,维生素C50 μmol/L,地塞米松10-8mol/L),诱导培养7天、14天后检测ALP 活性。弃掉培养基,PBS 清洗3 遍,每孔加入200 μL细胞裂解液,冰上裂解3 min,将裂解液转移至1.5 ml EP 管中离心,上清液即为所需细胞蛋白溶液,然后按照说明书在96孔板中加入样品和反应试剂,最后测定405 nm 处的吸光度。BCA 法测定蛋白液中的蛋白浓度,用以标准化ALP活性值。
1.3.5 成骨基因表达检测
按1×105/孔的密度将rBMSCs接种到6孔板中的材料表面,细胞诱导培养7天、14天后,Trizol 法提取各组细胞的总RNA。根据产品说明书要求,以20 μL 反应体系将RNA 反转录为cDNA。RT-PCR 为20 μL 反应体系:Master Mix 10 μl,Forward Primer 0.5 μL,Re⁃verse Primer 0.5 μL,cDNA 模板1 μL,ROX Refer⁃ence Dye 0.1 μL,ddH2O 7.9 μL。反应条件为:95℃2min 预变性,95℃ 15 s,59℃ 60 s,共40 个循环。RNA 引物序列:OCN,F 5'-AGGAGGGCA ATAAGG⁃TAGTGAA-3',R 5'-TACCATAGATGCGTTTGTAG⁃GC-3';COL-1,F 5'-GAGGCATAAAGGGTCATCGT⁃GG-3',R 5'-CATTAGGCGCAGGAAGGTCAGC-3';GAPDH,F 5'-TTGTTCCCTGCGACTTCAACA-3',R 5'-GTGGTCCAGGGTTTCTTACTCC-3'。
1.3.6 茜素红染色
24孔板中的细胞诱导培养21天后,弃掉培液,PBS清洗3 遍,4%多聚甲醛固定10 分钟,0.5%茜素红常温染色30 分钟,PBS 清洗至水清,显微镜下拍照。定量:每个样品加入500 μL 10%氯化十六烷吡啶反应1 小时,酶标仪572 nm处测量吸光度。
1.3.7 兔关节外移植物-骨愈合模型建立
PET 韧带剪成10 mm×5 mm 长方形,实验组材料进行Ce-CS修饰。兔子称重后,经耳缘静脉注射3%戊巴比妥钠(30 mg/kg)麻醉,常规消毒铺巾,在股骨内侧髁处作一长约3 cm 的纵行切口,逐层分离、切开至关节囊,暴露股骨内髁骨面,在内侧髁中部用直径2 mm克氏针钻一深度约10 mm 的孔,将韧带卷成圆柱状塞入骨缺损处,材料末端留约2 mm长度,然后逐层缝合、关闭切口。同一只兔子左、右侧对照,左侧为对照组,右侧为Ce-CS 处理组。术后肌肉注射青霉素50 万U/只,连续3天,正常饲养条件下喂养。
1.3.8 Micro-CT和三维重建分析
韧带植入8 周后,处死动物,取出双侧股骨,去除周围肌肉和软组织,进行Micro-CT扫描,对得到的数据进行三维重建,分析两组骨缺损处新骨再生情况。
1.3.9 组织学染色
取材后的股骨经4%多聚甲醛固定后,依次进行脱钙、脱水、石蜡包埋,然后切片,进行Masson、HE 染色。染色完成后的切片在显微镜下观察、拍照,分析韧带-骨界面的愈合情况。
1.3.10 统计学分析
使用SPSS22.0 和Graphpad 7 软件对数据进行分析,定量数据采用x ± s表示,采用t检验对组间差异进行比较。P<0.05提示差异有统计学意义。
2 结果
2.1 材料表面SEM、EDS检测及接触角实验
如图1 所示,PET 韧带浸泡5 min 后,表面出现少量材料附着(B1);15分钟后,材料表面出现片状附着物(C1);浸泡30 分钟后表面涂层达到饱和状态,韧带表面形成一层表面略粗糙的薄膜(D1),而对照组PET韧带表面光滑(A1)。EDS 结果显示,对照组表面仅有C、O两种元素,而处理过的韧带表面除了C、O,还出现了Ca、Si和Ce元素。经Ce-CS凝胶振荡浸泡处理30分钟后,涂层材料达到饱和状态,PET 表面形成均一、稳定的涂层,为有效减少涂层组内差异,遂将浸泡处理30分钟的PET材料作为实验组进行体内外实验。接触角实验结果显示:Ce-CS 修饰的材料表面亲水性能明显提升(图2)。
2.2 细胞增殖检测结果
如图3(A)所示,随着培养时间延长,各组细胞吸光值(OD)逐渐升高;在细胞培养1 天时,两组OD 值无明显差别;培养第3天和第7天时,Ce-CS组OD值明显高于对照组,差异有统计学意义(P<0.05)。
2.3 ALP活性检测
如图3(B)所示,在诱导培养7 天、14 天后,Ce-CS组ALP活性均高于对照组(P<0.05)。提示Ce-CS涂层能够促进rBMSCs细胞成骨分化。
2.4 成骨基因表达
如图4 所示,诱导培养7 天时,OCN 表达水平在两组间的表达有明显的统计学差异(P<0.05),COL-1表达无统计学差异;诱导培养14 天时,OCN、COL-1 在两组间的表达均有明显的差异(P<0.01,P<0.05)。
2.5 茜素红染色
如图5所示,Ce-CS组中矿化结节的数量明显多于对照组,与对照组相比,Ce-CS组中的矿化结节颗粒更大。定量分析结果显示两组之间的差异有统计学意义(P<0.05)。结果表明了Ce-CS可以有效的促进rBMSCs细胞外矿化结节的形成。

图1 材料表面SEM、EDS检测结果
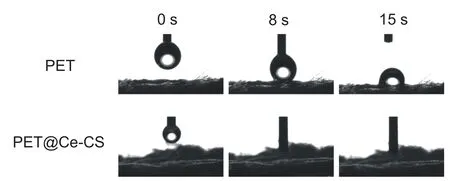
图2 接触角实验结果

图3 CCK-8检测细胞增殖活性结果(A)和ALP活性测定结果(B)
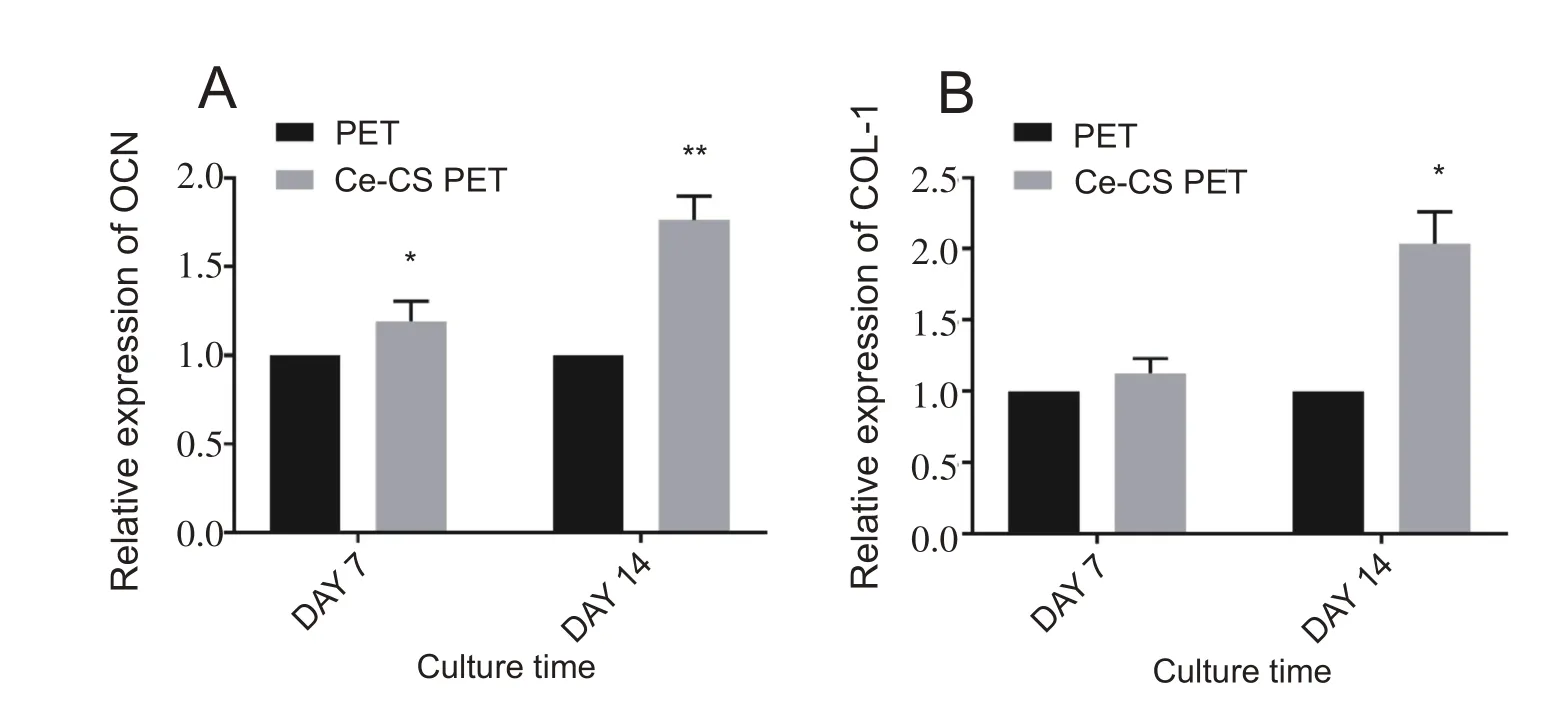
图4 诱导培养7、14天后,OCN、COL-1表达情况
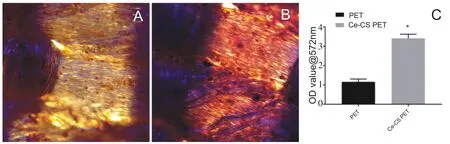
图5 诱导培养21天后茜素红染色(A、B)和茜素红染色定量分析结果(C)

图6 股骨Micro-CT扫描及三维重建图片

图7 BV/TV、BMD统计分析结果
2.6 Micro-CT和三维重建分析
CT 扫描图片(图6 A1-A4,B1-B4)显示,本实验成功建立了关节外移植物-骨愈合模型,实验形成的骨缺损均一、一致,可以对实验结果进行分析。三维重建结果(图7)表明,右侧骨缺损处新生骨体积高于左侧,骨矿密度(BMD)左侧为0.21 ± 0.02g/cm3,右侧为0.36± 0.04 g/cm3,两侧差异有统计学意义(P<0.05);相对骨体积(BV/TV)左侧为9.04% ± 3.77%,右侧为23.30% ± 4.05%,两侧差异有统计学意义(P<0.05)。
2.7 组织学染色结果
Masson、HE 染色图片可见,对照组韧带与骨界面之间有较多纤维组织形成,没有明显的新生骨生成;Ce-CS 组有不同程度的新生骨形成,移植物与骨接线模糊,无明显分界(图8)。

图8 HE染色结果(A、B)和Masson染色结果(C、D)
3 讨论
ACL 重建是目前治疗ACL 断裂损伤的金标准[10]。ACL 重建的目的是恢复膝关节的稳定性,使患者恢复正常的体育运动和活动,降低骨关节炎的发生率[8]。理想的移植物需要具备材料容易获得、与人体骨组织相容性好、生物力学稳定以及术后断裂并发症少等特点,同时能够满足部分病人个体化差异的需求[29]。与自体和同种异体移植物相比,PET 韧带能够提供术后即时的抗拉伸强度,恢复快,无疾病传播和免疫排斥的风险。LARS 韧带是我国运动医学领域目前应用最广泛的人工合成韧带,其生物力学性能良好,病人能够早期恢复体育运动,在临床中取得了令人满意的治疗效果[30]。然而,LARS 韧带主要成分是疏水性的PET 材料,与人体组织的生物相容性差,植入人体后容易诱发炎症反应,不利于细胞的黏附、增殖和成骨分化,影响移植物与宿主骨之间的愈合[31]。研究发现,在PET 韧带表面进行涂层修饰后,移植物的表面疏水性能和生物相容性得到明显改善[15,32],移植物在动物体内的骨整合性能明显增强[33]。
硅酸钙是一种具有良好生物活性的生物陶瓷材料。CS释放出来的钙离子和硅离子不仅在表面磷灰石层形成过程中发挥着重要作用[20],还可以直接影响成骨细胞代谢,促进骨整合[15]。此外,在CS中掺入金属元素可以进一步改善其生物活性。金属铈具有良好的抗氧化、抗炎和促进血管再生等生物活性。研究发现,金属铈可以通过减少诱生型一氧化氮合酶和细胞内超氧岐化酶的生成,清除自由基,从而发挥抗氧化作用。Chen 等[34]研究表明,即使在较高浓度水平(50 μg/ml)下,Ce也不会引起明显的炎症反应,这在组织工程领域具有重要意义[35]。Ce 可以促进血管内皮细胞的增殖,调节细胞内低氧诱导因子-1的表达水平,促进血管的再生[36],而损伤组织的修复和再生恰恰高度依赖新生血管的形成。纳米氧化铈制备的生物支架对人BMSCs没有细胞毒性,能够增强细胞的成骨分化和胶原蛋白的生成[37]。Li[38]等通过等离子喷涂技术制备了含氧化铈的(CeO2)的硅酸钙涂层,并研究了该涂层对BMSCs和RAW264.7 巨噬细胞系的影响。结果发现该涂层能够增强细胞的活性,促进BMSCs 细胞的黏附、增殖、ALP 的活性以及矿化结节的生成,这些作用随CeO2含量的增加而增强。
Zhang等[28]在硅酸钙材料中加入5 mol%、10 mol%的CeO2制备了含CeO2的介孔硅酸钙生物支架,结果表明加入CeO2后,材料的降解速率减慢,生物活性明显提升,10 mol%组支架的各项性能优于5 mol%组,但差异没有明显的统计学意义。前文也提及有文献报道含CeO2硅酸钙材料的生物活性随CeO2含量的增加而增强,因此,本研究制备了含10 mol%铈的硅酸钙(Ce-CS)修饰的PET人工韧带,并通过体外细胞实验和动物实验研究了该涂层的生物活性和生物相容性。结果表明,Ce-CS 能很好地粘附在PET韧带表面,并在PET韧带表面形成一层均匀的、表面略粗糙的薄膜,该方法相对简便、可控。Ce-CS 修饰后的PET 韧带亲水性能明显提升,更有利于细胞的黏附、增殖,SEM 结果也证实了这一点。我们通过CCK-8检测了Ce-CS对细胞增殖的影响,结果发现随着培养时间延长,各组细胞吸光值(OD)逐渐升高,在培养第3天和第7天时,Ce-CS组OD值均高于对照组(P<0.05),表明Ce-CS 可以促进细胞的增殖。ALP是细胞成骨分化的早期标志物。我们的研究结果表明,Ce-CS 能够明显促进骨髓间充质干细胞的ALP 活性(P<0.05)。成骨相关基因OCN、COL-1在Ce-CS 组表达均高于对照组。此外,本研究还通过茜素红染色分析了Ce-CS 对细胞外基质矿化的影响,结果发现与对照组相比,Ce-CS 组细胞外矿化结节的数量更多,矿化结节更大,定量分析表明两组之间的差异有统计学意义(P<0.05)。上述研究结果表明,Ce-CS可以促进细胞的黏附、增殖和成骨分化。但是,Ce-CS能否在体内促进移植物与骨之间的愈合,我们通过建立兔关节外移植物-骨愈合模型加以验证。Micro-CT结果显示,植入Ce-CS 修饰过韧带的一侧新骨形成量要多于对照侧,两侧的BMD、BV/TV差异均有统计学意义(P<0.05)。Masson 和HE 染色表明Ce-CS 组有不同程度的新生骨形成,移植物与骨界面之间的间隙变窄,对照组韧带与骨界面之间有较多纤维组织形成,没有明显的新生骨生成,这与Micro-CT结果一致。
4 结论
本研究证实含铈硅酸钙材料能够均匀地粘附在PET 韧带表面,方法简便、可控;修饰的PET 韧带能够促进成骨细胞的黏附、增殖和分化,体内实验验证了含铈硅酸钙具有促进移植物-骨愈合作用,为涂层修饰韧带在临床中的应用提供了理论基础。

