ET-1与UA在轻度认知障碍患者中的意义
罗雅婷 刘雪梅
1)信阳市中心医院检验科,河南 信阳 464000 2)信阳市职业技术学院附属医院检验科,河南 信阳 464000
临床上轻度认知障碍(MCI)属于认知障碍症候群之一,是一种介于正常衰老与痴呆间的认知功能受损状态[1-6]。MCI比正常老化过程严重,但还未能达到临床阿厄茨海默病(AD)的标准[7],只是与健康者相比,其进展为AD的几率更高[8-11]。及早发现、及早干预MCI可以阻滞或者延缓AD的发生[12-14]。本研究旨在通过对MCI患者体内血清尿酸(UA)与血管内皮素-1(ET-1)水平的检测,探析上述两指标在MCI患者中的临床价值。
1 资料与方法
1.1研究对象分析2013-01—2016-11信阳市中心医院及信阳市职业技术学院附属医院接受诊治的74例MCI患者的临床资料。其中男39例,女35例,年龄(63.6±9.2)岁。入选标准:(1)符合MCI的诊断标准:①认知衰退症状持续>3个月;②日常活动能力不存在显著缺损的情况;③存在明显的记忆力衰退以及其他相关的认知减退代主诉或主诉情况;④不符合AD的很可能诊断标准;⑤简易智能量表(MMSE)的评分为24~28分。(2)年龄40~79岁。(3)无脑卒中病史或抑郁表现者。(4)早期发病时无步态异常或癫痫症状者。排除标准:(1)存在明显视力或者听力障碍者;(2)存在严重躯体疾病,无法配合检查者;(3)脑卒中样起病者;(4)存在早期局灶性神经系统症状者;(5)头颅MRI或CT检查结果显示为海马区缺血或梗死灶或皮质者。根据MCI患者的临床症状分成A组(单纯记忆障碍,无其他认知障碍,32例)和B组(记忆障碍合并其他认知功能障碍,42例)2组。另外选取同期在我院接受健康体检的76例正常健康者作为本次研究的对照组。本研究经我院医学伦理委员会批准,患者知情同意此次研究并签署相关知情同意书。
1.2研究方法清晨空腹采集受试者3 mL肘静脉血,上全自动生化分析仪(德国罗氏P800)检测血清UA的表达水平。放射免疫法(RIA)检测血清ET-1(外送其他单位检测)。
调查所有受试者的受教育程度、吸烟史、年龄及饮酒嗜好等,并检查其血脂、血压及血糖。
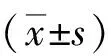
2 结果
2.1基线资料本研究共纳入150例研究对象,其中观察组74例,对照组76例。2组患者的基线资料差异无统计学意义(P>0.05)。见表1。
2.2血清UA及ET-1的表达水平比较表2、3提示,观察组血清UA水平明显低于对照组,ET-1水平明显高于对照组(P<0.01);A组患者血清UA明显高于B组(P<0.01),ET-1水平与B组相比差异无统计学意义(P>0.05)。
2.3MCI的危险因素分析表4提示,年龄、血压、血糖、UA、ET-1、TC、LDL-C是MCI患者的独立危险因子。
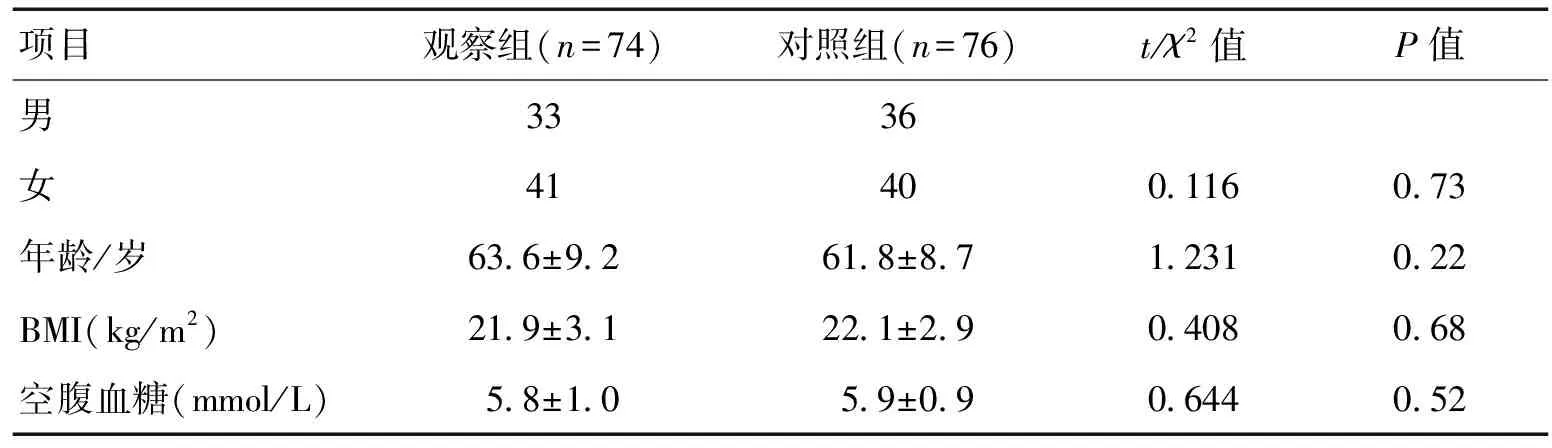
表1 2组基线资料比较
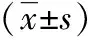
表2 2组血清UA及ET-1水平比较
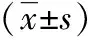
表3 A、B组血清UA及ET-1水平比较
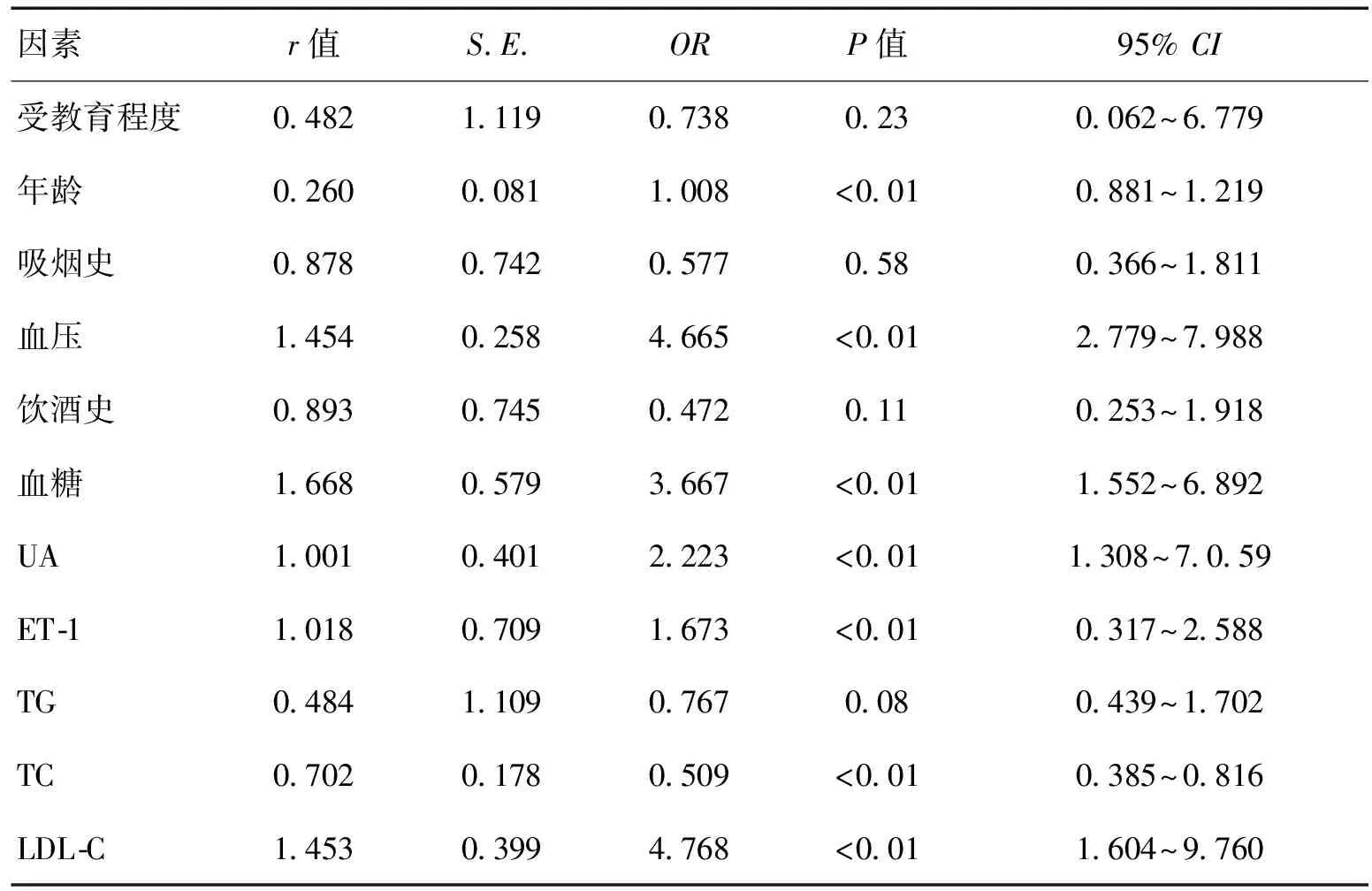
表4 MCI的多因素Logistic回归分析
注:TG:甘油三酯;LDL-C:低密度脂蛋白胆固醇;TC:总胆固醇
3 讨论
轻度认知障碍(MCI)患者的表现主要是某项认知障碍或(和)记忆障碍,其在极早期时会发生阿尔茨海默病(AD)的病理变化,此阶段也被证实为干预的最佳治疗时段[15,32-39]。
据报道,低尿酸(UA)可以引发MCI,考虑原因可能与UA是机体内特有的天然抗氧化剂,具有水溶性相关[16-18,40-43],正常健康者血浆内UA是血浆内主要的抗氧化作用成分,其可以抵制氧自由基导致的DNA受损与脂质过氧化,降低氧化应激表达水平,从而对海马神经元进行保护[19-20,44-48]。本研究发现,对照组患者的血清UA明显较MCI组高,且MCI与UA水平存在相关性,血清UA水平降低是MCI的独立危险因子。A组(单纯记忆障碍,无其他认知障碍)患者的血清UA水平明显高于B组(记忆障碍合并其它认知功能障碍)(P<0.01),说明患者的认知障碍病情严重程度与UA水平关系密切。据报道,记忆障碍合并其他认知功能障碍者进展成AD的危险性是单纯记忆障碍的4~6倍[21,49-52],说明低UA水平是患者认知功能衰退的危险因子,与本研究结果相吻合。有学者发现,MCI者需UA与大脑内增强的氧化应激反应对抗,氧化受损程度越重,其所消耗的UA量相应就会上升,导致血清UA水平进一步下降,而UA由于无法阻止氧自由基对氧化蛋白质与DNA的损伤,脂质过氧化及细胞能量不足致使脂褐素在脑内沉积,从而引发MCI[22,53-55]。大量研究显示,血清UA水平下降与AD、帕金森病(PD)等疾病关系密切[23-25,56]。
血管内皮素-1(ET-1)结合脑血管平滑肌ET受体将磷脂酶C激活,导致磷酸肌醇被大量降解,以使细胞内的游离Ca+水平上升的方式使血管平滑肌充分收缩,在脑血管张力中扮演了重要的调节角色,属于内源性重要的收缩因子[26,57-58]。ET-1在人体中枢神经系统内具有良好的病理生理效应[27,59-61]。ET-1水平上升不但会导致脑血管呈强烈持续性的收缩状,进而引发血管内皮受损,而且还会刺激成纤维细胞、血管内皮细胞及血管壁平滑肌增生,促进炎症反应,最终导致动脉粥样硬化(AS)。有学者发现,早期AD与AS的发病机制可能存在相同之处,即内皮受损与内皮功能受障,ET与AD相关[28,62-63]。ET-1还参与了细胞毒性发作的过程,促进兴奋性氨基酸大量释放,致使细胞内钙过量,导致神经元凋亡,从而引发MCI[29,64]。大量研究结果显示,在一定范围中以限制药物与饮食的方式可以显著降低ET-1、提高UA水平可以减缓MCI的发病进展[30-31,65-70]。
高ET-1、低UA水平均是MCI患者发病的独立危险因子,及时降低ET-1水平、提升UA水平可以有效减缓MCI的发生发展过程。ET-1与UA在MCI患者中具有重要的检测价值。

