外源一氧化氮对低温胁迫下茶树幼苗生理特性的影响
王英姿,李银花,陈金华,刘仲华,黄建安*
外源一氧化氮对低温胁迫下茶树幼苗生理特性的影响
王英姿1,2,李银花1,2,陈金华1,2,刘仲华1,2,黄建安1,2*
1. 湖南农业大学教育部茶学重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
为探究外源一氧化氮(Nitric oxide,NO)供体硝普钠(Sodium nitroprusside,SNP)对低温胁迫下茶树幼苗的缓解作用,采用人工气候室模拟低温胁迫试验,研究了叶面喷施不同浓度SNP对低温胁迫下两年生碧香早茶苗叶片膜脂过氧化程度、渗透调节物质含量及抗氧化酶活性的影响。结果表明,适宜SNP浓度可降低低温胁迫下茶树叶片相对电导率,抑制丙二醛含量的升高,促进脯氨酸、可溶性蛋白和可溶性糖的大量积累,提高超氧化物歧化酶、过氧化氢酶活性,从而缓解低温胁迫对茶树叶片的伤害。试验结果表明,喷施浓度为200 μmol·L-1的SNP效果最佳。
茶树;低温胁迫;外源NO;硝普钠;生理特性
茶树[(L.)O. Kuntze]是一种喜温畏寒的多年生常绿木本植物。低温是茶树栽培过程中常遇的非生物胁迫之一,已成为限制茶产业健康发展的重要因素[1]。在生产中,早春茶园易遭受低温冷害或气温回暖后的“倒春寒”危害,使茶树生理代谢出现絮乱,严重时导致茶叶产量和品质下降。大量研究表明,茶树抗寒性与体内丙二醛(MDA)、可溶性糖、可溶性蛋白含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性等密切相关[2-3]。抗寒性较强的茶树体内可溶性糖含量较高,可溶性蛋白含量积累增多[4-5],SOD、CAT活性维持较高水平,SOD同工酶总活性及谱带数量明显增强[5-7]。因此,研究茶树对低温胁迫的响应机理,探索茶树抵抗低温和冷害具有重要意义。
一氧化氮(Nitric oxide,NO)作为生物体内重要的信号分子,对植物抗逆防御起重要的信号调节作用[8],目前关于NO参与植物逆境胁迫的应答反应已成为研究热点。Tian等[9]研究发现,外源NO能诱导干旱胁迫下小麦叶片气孔关闭而减少水分的损失,提高叶片中SOD、CAT活性,降低MDA和H2O2含量。Zheng等[10]研究报道了外源NO能促进高盐胁迫下小麦种子萌发,增强小麦叶片中SOD、CAT活性和脯氨酸含量,降低细胞膜通透性,抵抗对叶片中线粒体氧化的伤害。Liu等[11]研究表明,外源NO可以提高低温胁迫下黄瓜幼苗体内的保护酶活性,从而增强植株对低温胁迫的适应性。陈银萍等[12]研究表明,低温胁迫下不同浓度硝普钠(SNP)能显著提高玉米种子的发芽率,抑制叶片MDA含量的升高,降低叶片质膜相对透性,增加相对含水量、脯氨酸含量和叶绿素含量。外源NO针对禾本科、豆科、蔬菜和林木等植物在水分、盐度、温度等非生物胁迫的研究较多,但关于逆境胁迫下NO介导的茶树生理反应研究较少,尤其是NO对于低温胁迫下茶树生理特性的影响尚未深入研究。因此,本研究通过对碧香早茶苗叶面喷施外源NO供体SNP,探讨不同浓度SNP对低温胁迫下茶树主要生理指标的影响,以期筛选出提高茶苗抗低温能力的适宜SNP浓度,为进一步深入研究外源NO提高茶树幼苗抵抗低温冷害等非生物胁迫能力提供理论参考。
1 材料与方法
1.1 试验材料
供试材料为湖南省茶叶研究所高桥基地提供的两年生碧香早茶树盆栽苗。选择长势基本一致的茶苗移栽于盆口直径为30 cm的聚乙烯盆中,每盆种植3株,培养土为70%茶园土混以30%有机肥料,定期浇水。试验在湖南农业大学茶学教育部重点实验室进行,温室内温度控制在20~25℃,相对湿度60%~75%,缓苗3个月。
试验所用NO供体SNP [Na2Fe(CN)5]纯度为98.5%,购自上海生工生物有限公司。先将其配制成100 mmol·L-1母液,4℃保存,用时按所需浓度稀释。
1.2 试验方法
1.2.1试验设计
选取大小和长势一致,生长健壮且无病虫、伤残叶的盆栽茶苗,移至人工智能气候箱培养,箱内温度控制在(25±1)℃,相对湿度保持在(60±5)%,光照周期为12 h·d-1,培养3 d。3 d后对幼苗进行叶面喷施处理,每次定量喷施250 mL,均匀喷施至叶片正反面水珠欲滴为止,1 d喷1次,连续喷施3 d。试验共设4个处理:(1)–2℃低温胁迫+清水处理(CK);(2)–2℃低温胁迫+200 μmol·L-1SNP(C1);(3)–2℃低温胁迫+500 μmol·L-1SNP(C2);(4)–2℃低温胁迫+1 000 μmol·L-1SNP(C3)。每处理重复3次,每个重复15株苗。
1.2.2低温处理
将已喷施的茶苗移至–2℃的人工气候培养箱进行低温处理,光照周期设为12 h·d-1,相对湿度(60±5)%。分别于低温胁迫的第0、6、24、48 h和72 h时进行取样,取第1片成熟叶片测定电导率,取一芽二叶测定各项生理指标,立即装入封口袋内,迅速放入液氮中速冻,保存至–70℃冰箱备用。
1.3 测定项目与方法
采用电导法测定相对电导率[13];采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[14];采用蒽酮比色法测定可溶性糖含量[15];采用硫代巴比妥酸法测定丙二醛含量[15];采用茚三酮显色法测定脯氨酸含量[15-16];采用氮蓝四唑(NBT)显色法测定SOD活性[17];采用H2O2紫外吸收法测定CAT活性[16]。
1.4 数据处理
采用Microsoft Excel 2010软件进行数据处理,SPSS 17.0统计分析软件进行方差分析和差异显著性分析,多重比较采用Duncan法。
2 结果与分析
2.1 对低温胁迫下茶树叶片相对电导率的影响
如图1所示,随着低温胁迫时间延长,茶树叶片相对电导率整体上升,不同处理间波动较大,均在72 h时达到峰值。低温胁迫过程中,茶树叶片相对电导率以200 μmol·L-1SNP(C1)最低,6、24、48、72 h时较清水处理(CK)分别显著降低36.07%、43.80%、13.37%和27.94%(<0.05)。500 μmol·L-1SNP(C2)在48 h前均显著高于CK;72 h时低于CK,较CK显著降低7.16%(<0.05)。1 000 μmol·L-1SNP(C3)在24~72 h时间段均高于CK,较CK显著增加2.34%~5.18%(<0.05),这表明高浓度SNP对降低茶树幼苗低温胁迫下叶片电导率无明显的促进作用。
2.2 对低温胁迫下茶树叶片MDA含量的影响
由图2-A可以看出,低温促使茶树叶片产生MDA,并随低温胁迫时间延长而逐渐升高,72 h时叶片MDA含量达到峰值。低温胁迫下,外源NO可明显降低叶片中MDA含量,并随着胁迫时间的延长不同SNP浓度对降低叶片MDA含量的效果也存在一定差异。C1处理的茶树叶片MDA含量在48 h和72 h时较CK分别显著降低了15.16%和39.81%(<0.05),C2和C3处理在6~72 h时分别显著降低了14.24%~26.31%和11.86%~27.76%(<0.05)。说明低浓度SNP处理对抑制低温胁迫下茶树叶片MDA含量升高的效果更好。
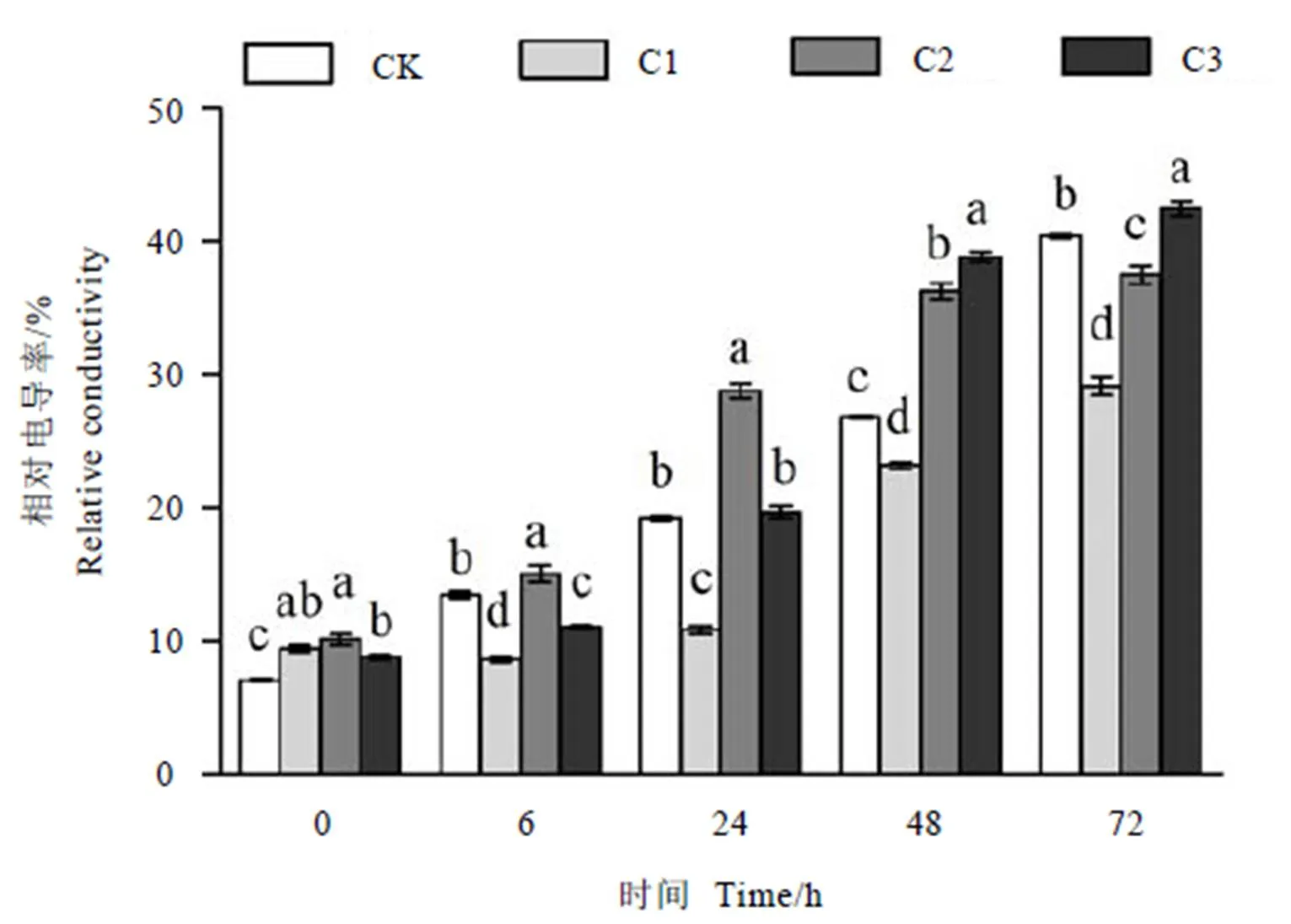
注:CK为常温对照,C1:–2℃低温处理+200 μmol·L-1 SNP,C2:–2℃低温处理+500 μmol·L-1 SNP,C3:–2℃低温处理+1 000 μmol·L-1 SNP。图中不同字母表示同一品种不同浓度处理间在P<0.05水平上显著性差异。下同

图2 外源NO对低温胁迫下茶树叶片丙二醛和脯氨酸含量的影响
2.3 对低温胁迫下茶树叶片脯氨酸含量的影响
由图2-B可知,随着低温胁迫时间延长,茶树叶片脯氨酸含量呈上升趋势。低温胁迫下喷施不同浓度SNP的叶片脯氨酸含量均高于CK,并在72 h时达到峰值,其中C1处理最高,显著高于C2和C3处理。与CK处理相比,C1处理的脯氨酸含量在低温胁迫6、24、48、72 h时分别显著增加24.54%、28.05%、43.67%和66.67%(<0.05),C2处理在低温胁迫24~72 h时分别显著增加9.84%~49.68%(<0.05),C3处理在低温胁迫48 h和72 h时分别显著增加9.02%和35.74%(<0.05),说明低浓度SNP对增加低温胁迫下茶树叶片脯氨酸含量的效果显著。
2.4 对低温胁迫下茶树叶片可溶性蛋白含量的影响
如图3-A所示,茶树叶片在低温胁迫过程中可溶性蛋白含量均呈上升趋势,喷施SNP处理的可溶性蛋白含量均显著高于CK(<0.05),72 h时均达到最高值,其中C1处理最高,显著高于C2和C3处理。较CK处理,C1处理的可溶性蛋白含量在低温胁迫6、24、48 h和72 h时分别显著增加51.73%、51.72%、42.62%和32.94%(<0.05),C2和C3处理在低温胁迫6~72 h时分别显著增加9.92%~40.68%和28.93%~44.03%(<0.05),C2和C3处理对增加低温胁迫下茶树叶片可溶性蛋白含量的累积效果较C1处理差。
2.5 对低温胁迫下茶树叶片可溶性糖含量的影响
图3-B可以看出,低温胁迫使茶树叶片的可溶性糖含量不同程度的增加,72 h时达到最高值,不同浓度SNP处理的茶树叶片可溶性糖含量的变化趋势与可溶性蛋白基本一致。C1处理在低温处理各时段均最高,显著高于其他处理,低温胁迫6、24、48 h和72 h时C1处理较CK分别显著增加18.91%、12.57%、28.03%和33.20%(<0.05);C2和C3处理在低温胁迫6~72 h时较CK分别显著增加3.06%~19.89%和2.73%~18.11%(<0.05)。
2.6 对低温胁迫下茶树叶片CAT活性的影响
由图4-A可知,低温胁迫下茶树叶片CAT活性呈先上升再下降的趋势,SNP处理的叶片CAT活性波动较大,CK在0~6 h间CAT活性有所下降,24 h时显著增加,之后下降。C1处理在0~6 h时CAT活性变化较小,6~24 h活性显著增强,之后有所下降,整个低温胁迫过程中CAT活性以C1处理最高,在6、24、48、72 h时较CK处理分别显著增加53.06%、100.00%、49.66%和59.43%(<0.05);C2处理的CAT活性仅高于CK,低温胁迫过程中与CK处理差异不显著;C3处理的CAT活性在6~72 h时较CK显著增加了43.09%~64.88%(<0.05),但较C1处理效果差。
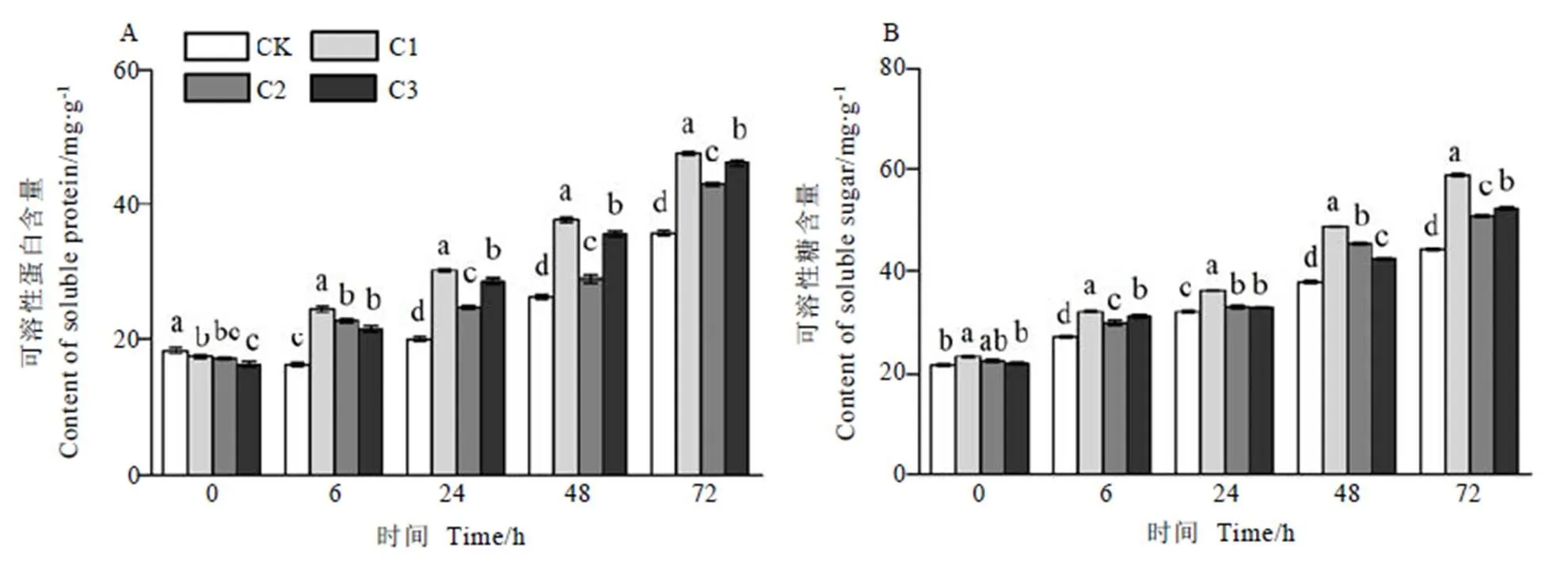
图3 外源NO对低温胁迫下茶树叶片可溶性蛋白和可溶性糖含量的影响
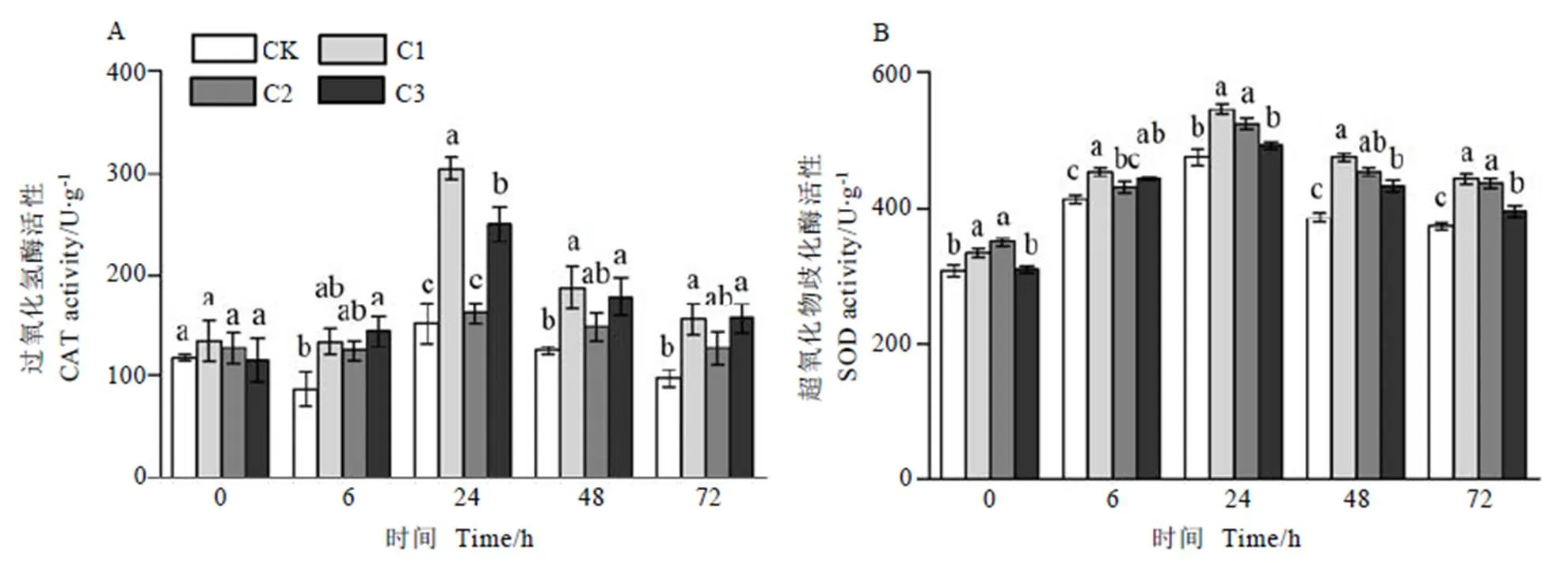
图4 外源NO对低温胁迫下茶树叶片过氧化氢酶和超氧化物歧化酶活性的影响
2.7 对低温胁迫下茶树叶片SOD活性的影响
图4-B所示,低温胁迫过程中,茶树叶片SOD活性总体呈先上升后下降的趋势,24 h时SOD活性达到峰值。喷施不同浓度SNP能不同程度提高茶树叶片的SOD活性,且显著高于CK(<0.05)。低温胁迫过程中SOD活性以C1处理最高,在6、24、48 h和72 h时C1处理较CK在分别显著增加9.79%、14.81%、23.29%和19.43%(<0.05);C2和C3处理间差异较小,C2处理在低温胁迫24~72 h时和C3处理在低温胁迫48~72 h时较CK分别显著增加10.37%~17.81%和6.64%~12.33%(<0.05)。
3 讨论
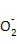
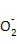
NO是参与植物生理过程中的信号传导分子,它在植物生长和发育中起着至关重要的作用,其信号系统可以诱导和激活植物抗氧化系统。研究表明,SNP可以明显提高多种作物中CAT、POD、SOD等酶的活性,并提高作物在遭受低温逆境后的成活率[26-27],这与本试验结果一致。由此推测可能是NO与含铁的CAT等相关酶类具有很强的亲和性,能够调节含血红素铁的酶类活性,并抑制含非血红素铁的顺乌头酸酶等靶酶的活性[28]。SOD活性的提高可能是在低温胁迫下NO作为信号分子来诱导SOD编码基因的表达[29]。适当浓度的SNP处理能够提高SOD和CAT等抗氧化酶的活性,有效清除低温胁迫引起的植物体内积累的活性氧,提高低温耐受性的能力,减轻低温胁迫对植物的伤害。
4 结论
低温胁迫下茶树叶片的相对电导率和MDA含量明显升高,脯氨酸、可溶性蛋白和可溶性糖含量显著增加,SOD和CAT的活性升高。外源NO处理显著降低了低温胁迫下茶树幼苗叶片的相对电导率,抑制了MDA含量升高,进一步促进了脯氨酸、可溶性蛋白和可溶性糖的积累,显著提高了抗氧化酶(SOD、CAT)的活性,从而增强了茶树幼苗抵抗低温胁迫的能力。综上所述,低温胁迫下,外源NO供体SNP浓度为200 μmol·L-1处理碧香早茶树品种缓解效果最好,而较高SNP浓度对其缓解作用较差。
[1] 周琳, 陈暄, 王玉花, 等. 超敏蛋白对低温胁迫下茶树生理特性的影响[J]. 园艺学报, 2014, 41(4): 746-754.
[2] 林郑和, 钟秋生, 陈常颂. 茶树抗性育种研究进展[J]. 福建茶叶, 2015, 37(4): 2-4.
[3] 杨再强, 韩冬, 王学林, 等. 寒潮过程中4个茶树品种光合特性和保护酶活性变化及品种间差异[J]. 生态学报, 2016, 36(3): 629-641.
[4] 粟本文. 茶树抗寒性研究概况[J]. 茶叶科学简报, 1991(4): 27-29.
[5] 罗军武, 唐和平, 黄意欢, 等. 茶树不同抗寒性品种间保护酶类活性的差异[J]. 湖南农业大学学报(自然科学版), 2001, 27(2): 94-96.
[6] 王新超, 杨亚军. 茶树抗性育种研究现状[J]. 茶叶科学, 2003, 23(2): 94-98.
[7] 黄建安. 茶树保护性酶类与抗寒性的关系[J]. 茶叶科学, 1990, 10(1): 35-40.
[8] Wendehenne D, Courtois C, Besson A, et al.NO-based signaling in plants [M]//Lamattina L, Polacco J C. Nitric oxide in plant growth, development and stress physiology. Berlin: Springer, 2007: 35-51.
[9] Tian X, Lei Y. Nitric oxide treatment alleviates drought stress in wheat seedlings [J]. Biol Plant, 2006, 50(4): 775-778.
[10] Zheng C, Jiang D, Liu F, et al. Exogenous nitric oxide improves seed germination in wheat against mitochondrial oxidative damage induced by high salinity [J]. Environ Exp Bot, 2009, 67(1): 222-227.
[11] Liu X, Wang L, Liu L, et al.Alleviating effect of exogenous nitric oxide in cucumber seedling against chilling stress [J]. African Journal Biotechnology, 2011, 10(21): 4380-4386.
[12] 陈银萍, 王晓梅, 杨宗娟, 等. NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响[J]. 农业环境科学学报, 2012, 31(6): 270-277.
[13] 黄意欢. 茶学实验技术[M]. 北京: 中国农业出版杜, 1995.
[14] 郑炳松. 现代植物生理生化研究技术[M]. 北京: 气象出版社, 2006.
[15] 孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008.
[16] 李合生. 植物生理生化实验原理及技术[M]. 北京: 高等教育出版社, 2000.
[17] 朱政. 茶树抗寒性生理指标的筛选及抗寒性鉴定方法的建立[D]. 合肥: 安徽农业大学, 2011.
[18] 徐洪雷. 一氧化氮对黄瓜盐胁迫及低温胁迫缓解作用的研究[D]. 哈尔滨: 东北农业大学, 2006.
[19] 马向丽, 魏小红, 龙瑞军, 等. 外源一氧化氮提高一年生黑麦草抗冷性机制[J]. 生态学报, 2005, 25(6): 1270-1274.
[20] 樊怀福,杜长霞,朱祝军. 外源NO对低温胁迫下黄瓜幼苗生长、叶片膜脂过氧化和光合作用的影响[J]. 浙江农业学报. 2011, 23(3): 538-542.
[21] 肖强, 郑海雷. 一氧化氮与植物胁迫响应[J]. 植物生理学通讯, 2004, 40(3): 379-384.
[22] 张钢. 国外木本植物抗寒性测定方法综述[J]. 世界林业研究, 2005(5): 14-20.
[23] Zhao M G, Chen L, Zhang L L, et al. Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance in Arabidopsis [J]. Plant Physiology, 2009, 151(2): 755-767.
[24] 吴旭红, 吕成敏, 冯晶昊. 外源一氧化氮(NO)对低温胁迫下南瓜幼苗氧化损伤的保护效应[J]. 草业学报, 2016, 25(12): 161-169.
[25] 郭经纬, 商桑, 穆大伟, 等. 外源NO对低温胁迫下豇豆幼苗生长和生理特性的影响[J]. 热带作为学报, 2015, 36(12): 2179-2183.
[26] 李新. 一氧化氮对枳低温应答和多胺合成的影响[D]. 武汉: 华中农业大学, 2012.
[27] 刘兴旺. 一氧化氮提高黄瓜低温耐受性的分子机制[D]. 北京: 中国农业大学, 2013.
[28] 王宪叶, 沈文滩, 徐朗莱. 外源一氧化氮对渗透胁迫下小麦幼苗叶片膜脂过氧化的缓解作用[J]. 植物生理与分子生物学学报, 2004, 30(2): 195-200.
[29] Beligni M V, Fath A, Bethke P C, et al. Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone layer [J]. Plant Physiology, 2002, 129: 1642-1645.
Effects of Exogenous Nitric Oxide on Physiological Characteristics of Tea Plants Under Cold Stress
WANG Yingzi1,2, LI Yinhua1,2, CHEN Jinhua1,2, LIU Zhonghua1,2, HUANG Jian'an1,2*
1. Key Laboratory of Tea Science of Ministry of Education, Hunan Agricultural University, Changsha 410128, China; 2. National Research Center of Engineering & Technology for Utilization of Functional Ingredients from Botanicals, Hunan Agricultural University, Changsha 410128, China
In order to investigate the alleviation effect of exogenous nitric oxide (NO) donor sodium nitroprusside (SNP) on tea rooted cuttings under cold stress, artificial climate chamber was used to simulate cold stress on tea rooted cuttings. The effects of SNP on membrane lipid peroxidation, osmotic adjustment substance and antioxidant activity of biennial ‘Bixiangzao’ rooted cuttings under cold stress were studied by foliar spray of SNP. The results show that suitable SNP concentration treatment could reduce the relative conductivity of tea leaves, inhibit the elevated malondialdehyde content, promote the accumulation of proline, soluble protein and sugar, and increase the superoxide dismutase, catalase activities, thereby alleviate the damage of cold stress on tea leaves. In addition, the optimal concentration of SNP was 200 μmol·L-1.
tea plant, low temperature stress, exogenous nitric oxide, sodium nitroprusside, physiological characteristics
S571.1;S339.4
A
1000-369X(2019)03-335-07
2018-09-29
2018-12-02
湖南省教育厅科学研究项目(17C0767)、校科学基金项目(16QN09)
王英姿,女,实验师,主要从事茶树品质形成及调控方面的研究,83075688@qq.com。*通信作者:jian7513@sina.com

