茶树钙依赖性蛋白激酶基因CsCDPK17 的鉴定及表达分析
雷蕾,王璐,姚丽娜,郝心愿,曾建明,丁长庆,王新超,杨亚军
茶树钙依赖性蛋白激酶基因的鉴定及表达分析
雷蕾,王璐,姚丽娜,郝心愿,曾建明,丁长庆*,王新超*,杨亚军
中国农业科学院茶叶研究所/国家茶树改良中心/农业农村部茶树生物学与资源利用重点实验室,浙江 杭州 310008
钙依赖型蛋白激酶(Calcium-dependent protein kinases,CDPKs或CPKs)是植物细胞中重要的钙离子信号受体,普遍参与了植物生长发育和胁迫响应等调控过程。本研究从茶树龙井43中克隆到1条基因,经测序验证该序列包含1 611 bp的完整ORF,编码536个氨基酸。结合序列比对和进化分析发现该蛋白N-末端具有豆蔻酰化位点,具备钙依赖性蛋白激酶的保守结构域,并且与拟南芥AtCDPK17的同源关系最近,因此命名为CsCDPK17(Genbank登录号为:MK238482)。蛋白质理化特性分析发现其蛋白分子量为59.9 kD,理论等电点pI为5.43,属无跨膜结构域的亲水性蛋白。使用水稻原生质体和烟草叶片两种瞬时表达的方法均证明CsCDPK17是细胞质膜和细胞核双定位蛋白。对克隆到的上游2 000 bp的启动子区分析发现了多个与基因转录、光、激素(ABA、SA、MeJA等)相关的顺式作用元件。表达分析显示,在成熟叶和种子中表达水平较高,而在根中的表达水平最低;在龙井43、大面白等4个品种冷驯化过程中,该基因的表达随着冷驯化过程显著上调,随着脱驯化过程下调;同时还发现能够不同程度地响应低温(最高5.1倍)、干旱(最高2.3倍)、渗透(最高2.4倍)胁迫。本研究的结果表明在茶树的生长发育和低温、干旱、渗透等非生物胁迫响应的过程中均发挥一定的调控作用。
茶树;基因;亚细胞定位;非生物胁迫;表达分析
钙离子是植物细胞中最重要的第二信使之一,几乎所有的真核生物细胞中都存在钙离子信号通路。高等植物中,钙离子信号通路普遍参与了细胞的生长发育、胁迫响应等调控过程[1]。植物细胞膜系统在感受到外界环境刺激后,首先引起细胞内Ca2+浓度的瞬时变化,随后钙信号受体感知这种变化并将信号传递至下游的调控网路,进而引起植物细胞内的一系列生理、生化变化,完成对各种环境信号的响应[2]。植物细胞中的钙离子信号受体主要有钙调素(Calmodulins,CaM)及钙调素相关蛋白(Calmodulins-related proteins,CML)、类似钙调磷酸酶B亚基蛋白(Calcineurin B-like proteins,CBL)和钙依赖性蛋白激酶(Calcium-dependent protein kinases,CDPK,又称CPK)三大类[2-3]。与CaM及CML、CBL不同,CDPK在植物细胞中同时发挥着钙离子信号受体和传递体的双重功能[4]。钙依赖性蛋白激酶是一类Ser/Thr型蛋白激酶,通常都是由N-端的可变功能域(N-terminal domain)、蛋白激酶功能域(Protein kinase domain)、自抑制功能域(Autoinhibitory domain)和C端的类钙调素功能域(Calmodulin like domain)4个核心功能域构成[1]。其中,C端的类钙调素功能域是由成对的螺旋-环-螺旋状的EF-hand手型结构组成,Ca2+与EF-手型结构的结合能够引起CDPK空间结构的改变,从而导致自抑制功能域的抑制作用解除,促使CDPK的蛋白激酶活性恢复,磷酸化下游调控因子,将信号传递至下游调控网络,从而完成对生长发育、环境刺激等信号的响应[5]。
植物细胞中钙依赖性蛋白激酶通常是由包含多个成员的基因家族编码,例如:在拟南芥、水稻、玉米和毛果杨的基因组中分别鉴定出34、31、25个和20个CDPK基因[6-9]。茶树中,张成才[10]发现了5条在茶树花粉中特异表达的CDPK基因,并命名为;Wang等[11]发现可能参与了茶树对高温胁迫的响应。已有研究表明,在各物种响应胁迫的过程中既存在发挥正向调控作用的CDPK基因,也存在起负调控作用的CDPK家族成员。例如:小麦中等基因均受到白粉病诱导表达[12];水稻中过表达可以显著提高转基因植株的低温抗性[13];玉米中过表达能够导致其种子萌发对ABA更加敏感,同时也能增加转基因拟南芥对干旱的抗性[14];而拟南芥突变体表现出比野生型更强的渗透胁迫抗性[15]。
茶树[(L.) O. Kuntze]起源于热带和亚热带地区,是一种喜温怕寒的多年生常绿木本植物,在其总生育周期和年生育周期内都会受到低温、干旱、高温等各种环境因素的影响[16]。近年来,夏季高温和早春倒春寒灾害对我国茶产业的影响愈发严重,茶树抗逆育种也成为了当下育种界关注的热点问题之一。因此,加强对茶树重要功能基因的挖掘及功能研究,促进茶树丰富种质资源和基因资源的利用是推动茶树抗逆育种的重要手段之一[17]。在前期工作的基础上,我们从茶树中克隆出1条编码钙依赖性蛋白激酶的基因,并深入分析了该基因启动子区顺式作用元件构成,编码蛋白的理化特性、结构特征和亚细胞定位,检测了其对多种非生物胁迫的响应情况,以期丰富茶树CDPK家族的基因信息,也为茶树非生物胁迫响应过程中信号传导机制研究提供基础。
1 材料与方法
1.1 材料
以5年生盆栽(花盆直径约45 cm,高度约40 cm)的国家级无性系良种龙井43为材料,取其根、茎、成熟叶、顶芽、花和果实用于组织特异性表达试验,其中花和果实采于2018年10月下旬盛花期间;逆境处理条件如下:盆栽于人工气候室中适应培养7 d(光周期为14 h光照、10 h黑暗,温度为白天25℃、夜间22℃),然后开始进行低温、干旱等非生物胁迫处理。低温处理时保持光周期不变,调整温度为白天4℃、夜间2℃,以低温处理前为对照,定义为0 h,低温处理后1、3、6、12、24、48、72 h分别取第1至2片叶为样品;干旱处理和渗透胁迫处理分别采用聚乙二醇(PEG 6000)和甘露醇模拟,处理时向每一盆栽苗浇灌5%(∶)PEG 6000或者150 mmol·L-1甘露醇1 000 mL,以处理前为对照定义为0 d,处理后的0.5、2、4、6、8 d分别取第1至2片叶为样品。以田间自然生长的龙井43、大面白、浙农12和浙农113为材料,在2017—2018年分别于2017年10月14日和12月16日及2018年的1月17日和3月27日取成熟叶用于检测目标基因在不同茶树品种冷驯化过程中的表达分析。所有处理均设置3组生物学重复,取样后立即放入液氮,然后保存于–80℃冰箱备用。
1.2 DNA、RNA的提取及cDNA的合成
分别选用高效植物基因组DNA提取试剂盒(TIANGEN,中国)和RNA prep Pure多糖多酚植物总RNA提取试剂盒(TIANGEN,中国)进行DNA和RNA抽提,具体的操作过程参照试剂盒说明书进行。抽提好的DNA、RNA分别使用Nano Drop ND2000微量核酸蛋白测定仪(Thermo,美国)进行浓度测定和1%变性琼脂糖凝胶电泳检测其质量。经检测合格的DNA保存于–20℃冰箱,用于启动子克隆;RNA保存于–80℃冰箱,用于cDNA合成。取1 µg RNA使用Prime Script RT Reagent(Takara,日本)反转录试剂盒,参照试剂盒说明书完成cDNA合成,保存于–20℃冰箱,用于基因克隆和表达分析等后续试验。
1.3 基因CDS全长及启动子克隆
使用龙井43的cDNA为模板,以在转录组中通过同源比对得到的候选序列为参考,设计引物使用RT-PCR进行基因全长克隆验证。基因克隆选用KOD-Plus-Neo(Toyobo,日本)高保真Taq酶,PCR反应体系为50 µL,包括以下组分:以10倍稀释的上述cDNA 1.0 µL为模板、10×KOD buffer 5.0 µL、上下游引物各1.5 µL、dNTP 5.0 µL、KOD-Plus-Neo 1.0 µL、MgSO44.0 µL,其余用ddH2O补足。PCR反应程序为:首先经94℃预变性3 min;然后98℃变性10 s,56℃退火30 s,68℃延伸90 s,38个循环;68℃延伸7 min,于4℃保存。反应结束后的RCR产物进行1%琼脂糖凝胶电泳检测,对目标条带切胶回收,连接到Blunt-zero(TransGen,中国)克隆载体,转化DH5大肠杆菌,涂板后37℃培养12~14 h,挑取单克隆进行测序验证。基于已经发表的舒茶早基因组序列信息[18],通过比对获得目标基因转录起始位点(ATG)前约2 000 bp的启动子区序列,设计引物,以龙井43的DNA为模板进行RT-PCR扩增,PCR产物经1.0%琼脂糖凝胶电泳检测,切胶回收、连接入克隆载体、涂板挑取单克隆测定启动子区序列。引物合成和测序由上海华津生物有限公司完成,本研究中涉及的引物及序列见表1。

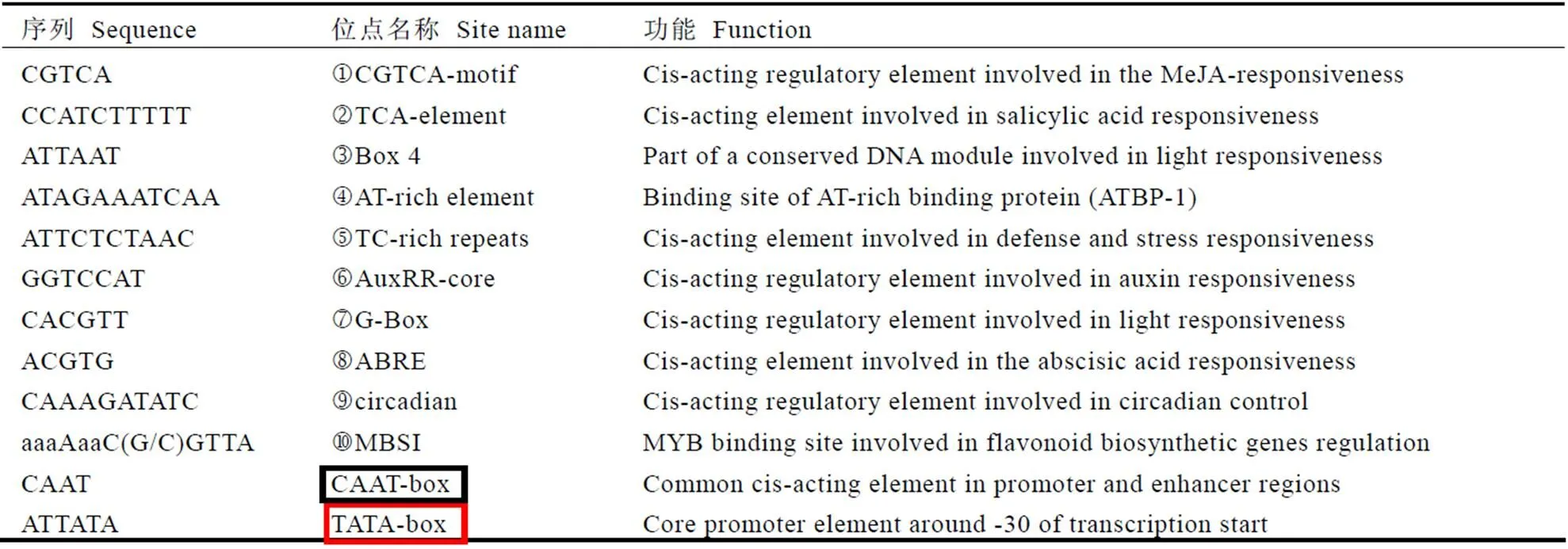
表1 试验中用到的引物及其序列
1.4 生物信息学分析
利用DNASTAR 5.01软件包中的Editseq对目标序列进行ORF预测;在NCBI(https://www.ncbi.nlm.nih.gov)数据库中对其进行同源性比对分析,并根据文献中已经报道的CDPK基因序列的GeneBank编号,下载氨基酸序列,使用ClustalX 2.0软件进行多序列比对;采用MEGA 6.0软件中的邻接法(Neighbor-Joining tree)构建系统发育进化树(使用Bootstrap检验,值为1 000),完成对目标蛋白的进化分析。使用ProtParam(https://web.expasy.org/protparam)预测蛋白分子量、等电点、氨基酸组分等特征;使用ProtScale(https://web.expasy.org/protscale)程序分析该蛋白的疏水和亲水性;SignalP(http://www.cbs.dtu.dk/services/SignalP)分析程序预测该蛋白的信号肽;NetPhos 3.1 Server(www.cbs.dtu.dk/services/NetPhos)分析程序预测蛋白磷酸化位点;使用Myristoylator(https://web.expasy.org/myristoylator)预测N端的豆蔻酰化位点;使用TMHMM sever 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0)进行跨膜结构预测;使用SOPMA进行二级结构预测;使用PSORT(https://www.psort.org)进行CsCDPK17蛋白的亚细胞定位预测;SMART(http://smart.embl-heidelberg.de)完成CsCDPK17蛋白的功能与分析;Swiss-Model(https://swissmodel.expasy.org)完成三级结构预测,并用Pymol 2.0.7软件作图。使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)完成对启动子所含顺式作用元件的分析。
1.5 CsCDPK17编码蛋白的亚细胞定位
1.5.1 载体构建
首先,使用带酶切位点的CsCDPK17-GFP- F/CsCDPK17-GFP-R引物,扩增CsCDPK17编码序列,切胶回收后备用。然后使用I和I内切酶分别对CsCDPK17编码序列胶回收产物和35s-eGFP载体质粒进行双酶切,经1%琼脂糖凝胶电泳后,切胶回收酶切产物。最后将酶切后CsCDPK17编码序列与载体质粒的回收产物使用T4 DNA ligase进行连接,完成CsCDPK17-eGFP载体构建,将构建好的载体转入DH5,涂板挑选单克隆,经菌液PCR验证阳性克隆后送上海华津生物有限公司测序验证。
1.5.2 CsCDPK17-eGFP的烟草叶片瞬时表达
将测序验证正确的CsDPK17-eGFP质粒转化农杆菌(GV3101),28℃培养36~48 h后,挑取单克隆进行菌液PCR验证,将阳性克隆的菌液以1∶1的比例加入50%的甘油于–80℃保存。使用水稻原生质体瞬时表达法和烟草叶片瞬时表达的方法进行目标基因的亚细胞定位研究。烟草浸染液制备方式为:首先,取–80℃保存的菌液(GV3101)10 µL于1 mL的LB液体培养基中,28℃,200 r·min-1活化培养3 h;然后,将活化好的菌液按1%比例加入到25 mL(含50 ng·mL-1卡那霉素和50 ng·mL-1利福平)的LB液体培养基中继续培养至OD600约1.0(约需要24~36 h);最后,将培养好的菌液4 000 r·min-1离心10 min,弃去上清,用侵染液(含10 mmol·L-1MES、10 mmol·L-1MgCl2,使用1 mol氢氧化钾调pH至5.7)重悬至OD600=0.8,28℃静置3 h后注射烟草。注射后48 h左右使用激光共聚焦显微镜观察和拍照。
1.6 CsCDPK17的表达分析
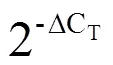
2 结果与分析
2.1 CsCDPK17的克隆
使用CsCDPK17-F和CsCDPK17-R引物以龙井43的cDNA为模板成功扩增出1条1 600 bp左右的条带(图1),经过分析发现,该序列包含一段全长为1 611 bp的完整开放阅读框,编码1条长度为536个氨基酸的蛋白质。TAIR数据库中的同源比对结果显示,该蛋白与拟南芥中的AtCPK17的同源性高达82.5%,其次为AtCPK34,因此,命名该基因为(GenBank登录号为MK238482)。
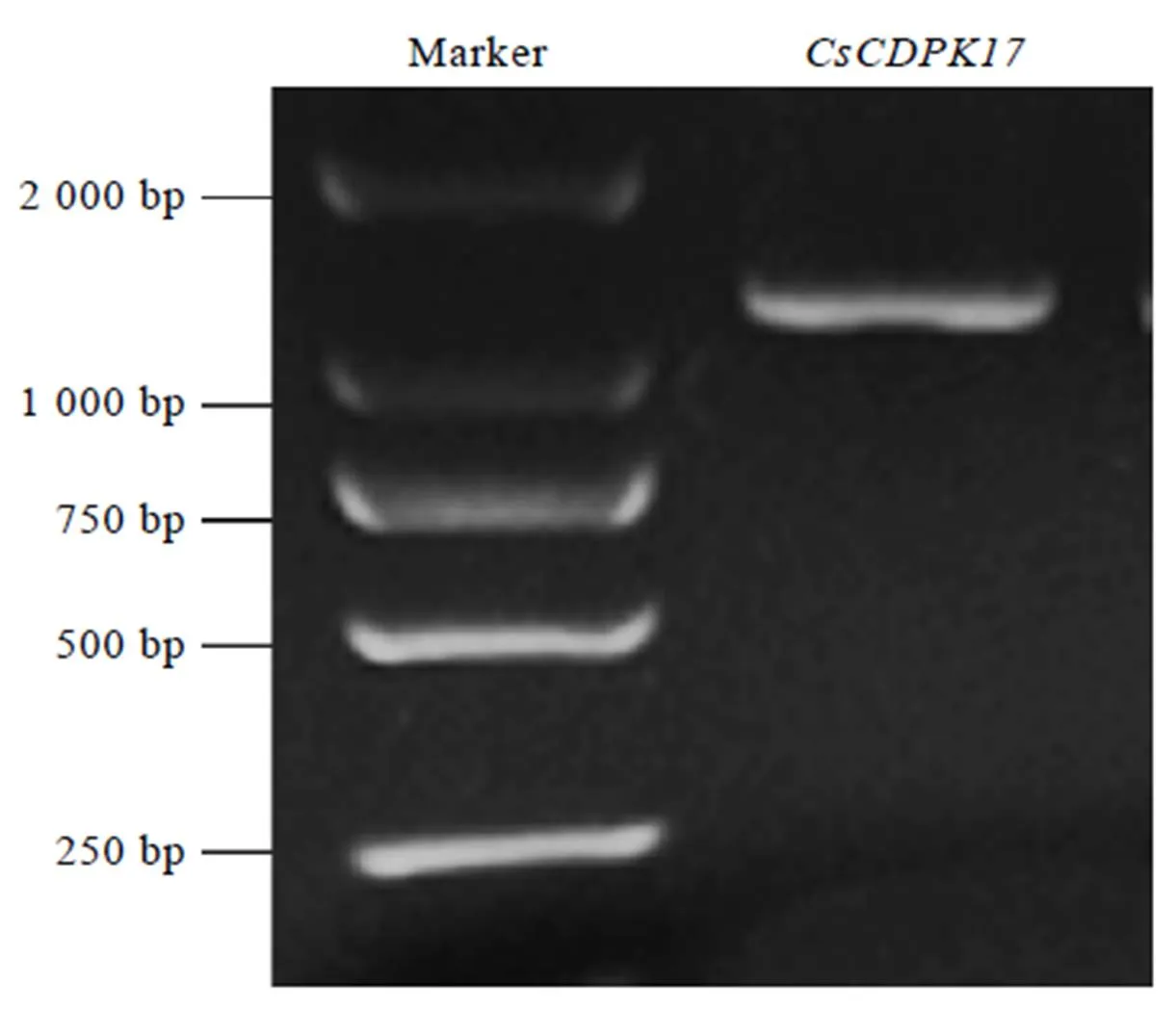
图1 茶树CDPK家族基因CsCDPK17电泳结果
2.2 进化和保守功能域分析
为了探究该基因与其他物种中已经发表的CDPK蛋白之间的亲缘关系,我们使用邻接法构建了系统发育进化树。结果显示,该进化树包含有4个亚家族聚类,CsCDPK17与CsCDPK2、CmCDPK2、AtCDPK17等蛋白聚类于第二亚家族(图2),说明这些蛋白之间具有较近的亲缘关系。为了进一步解析CsCDPK17的结构和推测其生物学功能,通过与水稻、拟南芥等模式植物中CDPK氨基酸序列比对发现,各物种间CDPK在N端序列的差异性较大,符合CDPK的N端是可变结构域的特性(图3)。N-末端豆蔻酰化位点分析显示CsCDPK17与AtCPK2、McCDPK2的同源性较高,说明他们可能具有相似的亚细胞定位。蛋白磷酸化预测该蛋白可能有41个磷酸化位点,其中包含20个丝氨酸(Ser)位点、15个苏氨酸(Thr)位点和6个络氨酸(Tyr)位点。蛋白质结构域分析显示,CsCDPK17蛋白在其氨基酸序列80~338位之间为丝氨酸/苏氨酸蛋白激酶催化结构域,在C端的385~413、421~449、457~485、492~520这4个位点存在有4个EF-hand手型结构(图3)。通过与已经报道的结构域较为明确的CDPK氨基酸序列[21]比对分析也证实了上述分析结果。综上,CsCDPK17在激酶结构域、自抑制功能域、ATP结合位点及C端的4个EF-hand手型结构均表现出较高的保守性,推测该蛋白可能具有类似的激酶活性。
2.3 蛋白质理化性质分析及结构预测
CsCDPK17蛋白大小为59.9 kD,理论等电点pI为5.43,化学分子式为C2632H4146N736O813S26。蛋白质稳定性分析发现CsCDPK17的脂肪指数为77.23,不稳定系数为38.60,根据Guruprasad法判断该蛋白为稳定蛋白质。蛋白质的亲、疏水性通常与功能密切相关,分析显示该蛋白极性最小负值为–3.011,最大正值为2.756,总平均亲水性(GRAVY)为–0.525,属于亲水性蛋白。另外,信号肽的分析显示CsCDPK17蛋白的S平均值(Mean S-score)为0.100(小于0.5),说明其可能为分泌蛋白;进一步的跨膜结构预测表明,该蛋白不存在跨膜区,不属于跨膜蛋白,亚细胞定位预测发现CsCDPK17可能定位于细胞质和细胞核。蛋白质空间结构分析表明:-螺旋占41.98%;延伸链占9.33%;-转角占8.58%;无规则卷曲占40.11%。图4是CsCDPK17的蛋白质空间结构预测模型。
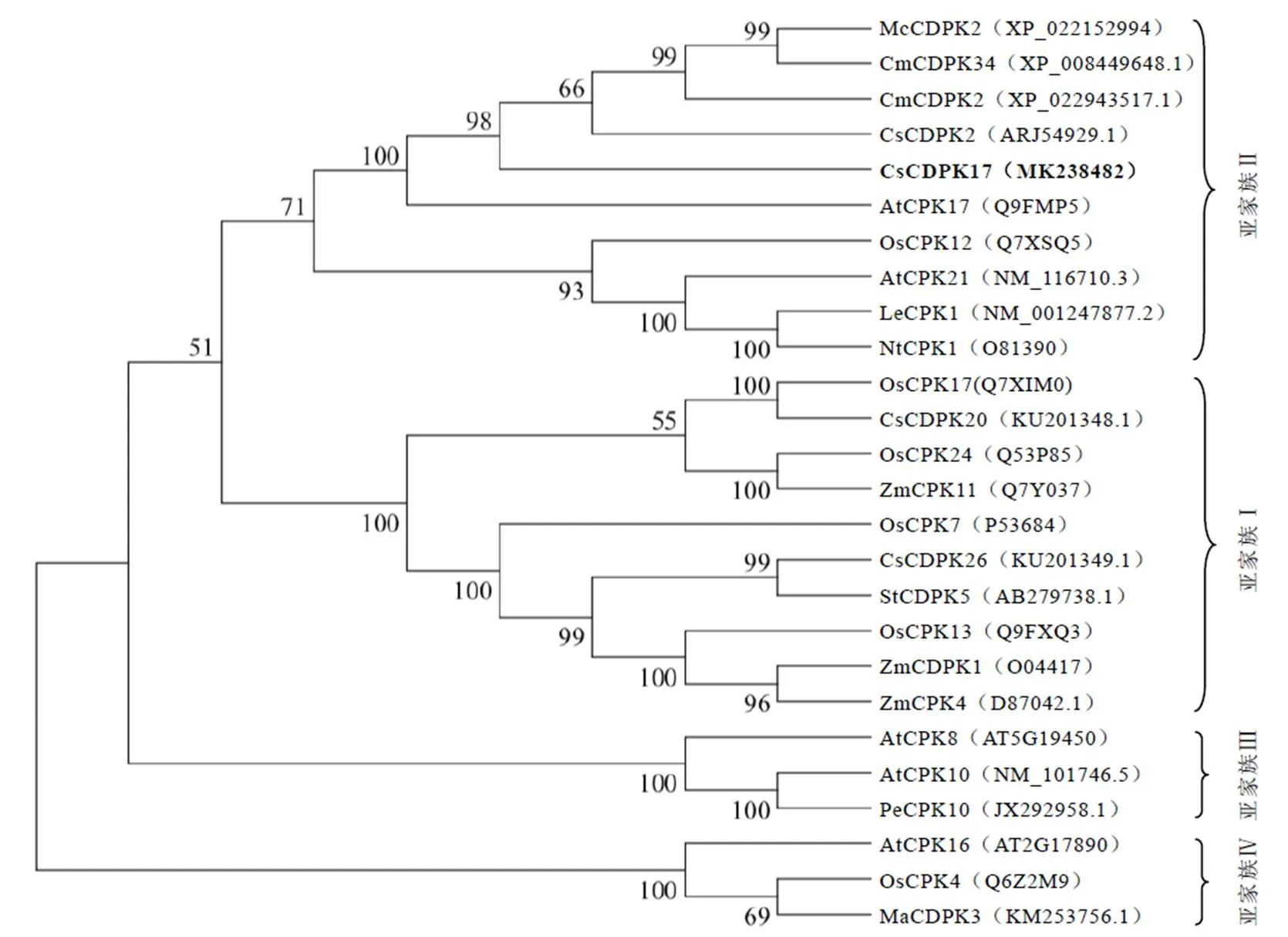
注:McCDPK2:苦瓜;CmCDPK34:甜瓜;CmCDPK2:甜瓜;CsCDPK2:茶树;CsCDPK17:茶树;AtCPK17:拟南芥;OsCPK12:水稻;AtCPK21:拟南芥;LeCPK1:番茄;NtCPK1:烟草;OsCPK17:水稻;CsCDPK20:茶树;OsCPK24:水稻;ZmCPK11:玉米;OsCPK7:水稻;CsCDPK26:茶树;StCDPK5:马铃薯;OsCPK13:水稻;ZmCDPK1:玉米;ZmCPK4:玉米;AtCPK8:拟南芥;AtCPK10:拟南芥;PeCPK10:胡杨;AtCPK16:拟南芥;OsCPK4:水稻;MaCDPK3:野芭蕉

注:两个蓝色箭头之间的氨基酸序列为蛋白激酶功能域;红色下划线表示ATP结合位点,红色箭头表示与ATP结合的氨基酸为赖氨酸(K);黑色下划线依次表示N端的豆蔻酰化位点、自抑制功能域和C端的4个EF-hand手型结构
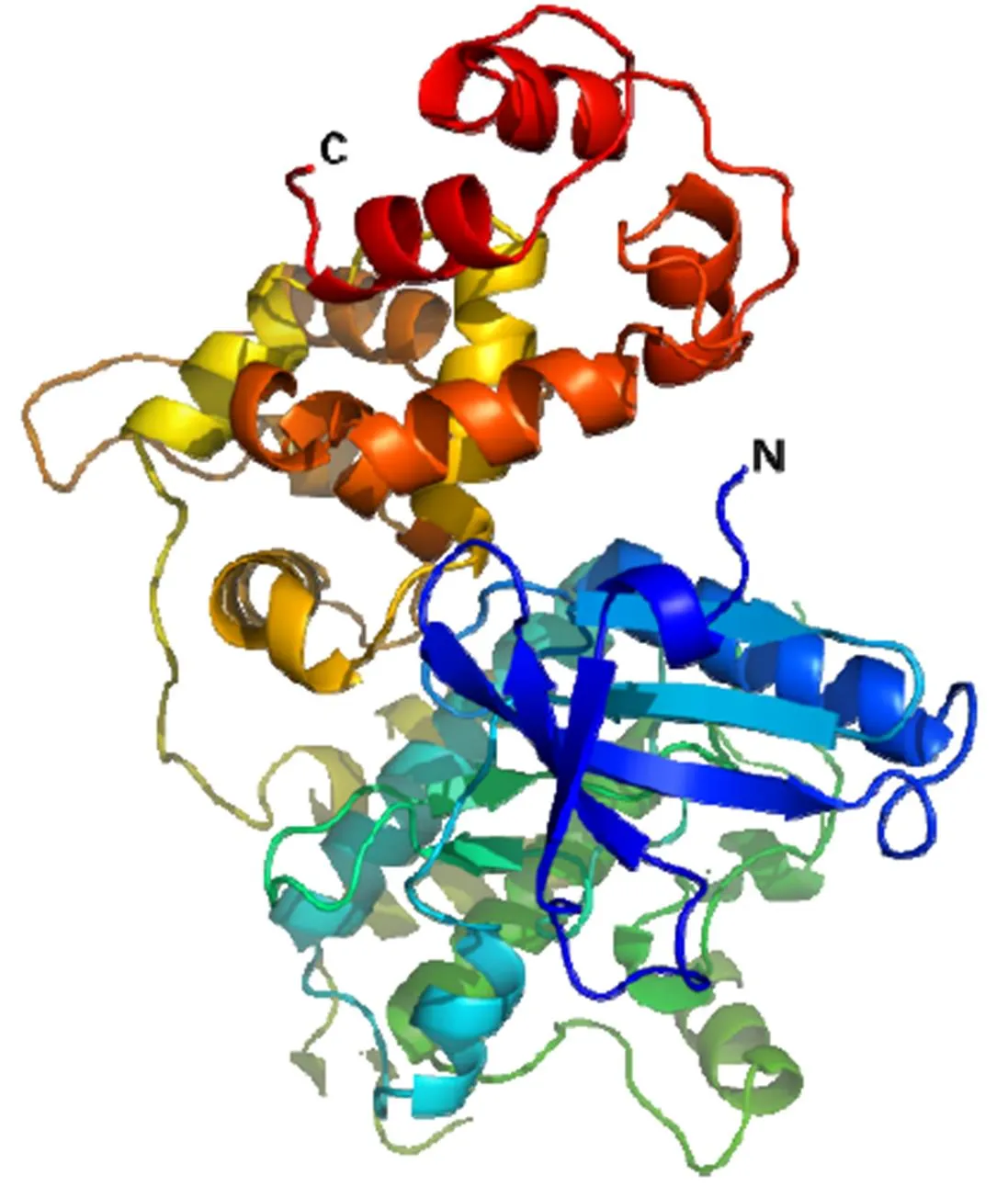
图4 CsCDPK17的3D结构预测模型
2.4 CsCDPK17基因启动子序列分析
启动子区顺式作用元件的数量和种类是基因转录水平调控的重要方式,对克隆出的起始密码子上游约2 000 bp的启动子区进行分析,发现了多个基因转录所必须的元件(如与转录起始相关的核心元件TATA-box、CAAT-box等)、多个与光响应相关的元件(如G-box、Box4等)、多个与激素响应相关的元件(如与脱落酸相关的ABRE、与茉莉酸相关的CGTCA-motif元件、与生长素相关的AuxRR-core)等;此外还发现了多个与非生物胁迫响应、类黄酮代谢相关的TC-rich repeats、MBSI等元件(图5和表2)。启动子区广泛存在的各种类型的转录因子说明该基因可能普遍参与了茶树的生长发育和胁迫响应等调控过程。
2.5 亚细胞定位
使用水稻原生质体瞬时表达法对CsCDPK17的亚细胞定位分析发现,与该蛋白融合的GFP荧光在原生质膜和细胞核上均有发现(图6),说明该蛋白具有细胞质膜和细胞核双定位。为了进一步确认该定位的准确性,我们又使用了烟草叶片瞬时表达法进行验证,结果同样表明CsCDPK17是细胞核和细胞质膜双定位蛋白(图6)。CsCDPK17在细胞质膜和细胞核的双定位模式说明其在生物学功能上可能同时具有细胞膜信号转导和核基因表达水平调控的双重功能。
2.6 CsCDPK17基因的表达模式分析
2.6.1 组织表达特异性
组织表达特异性检测结果显示,基因在各组织中的表达水平均明显低于内参基因。不同组织之间,在成熟叶和种子中的表达水平较高,根中的表达量最低,在第一叶、花、芽、茎中的表达量居中(图7),表明在成熟叶和种子中呈现出明显的特异性表达。
2.6.2 不同胁迫处理下的表达模式
对龙井43、大面白、浙农12和浙农113这4个品种自然冷驯化(越冬)和脱驯化过程的表达情况进行分析。结果发现,在自然冷驯化期间(10月至次年1月),基因表达水平随着气温逐渐降低而逐渐提高,1月17号时在4个品种中的表达水平均达到最高,并且在4个品种中呈现出相同的表达模式;在脱驯化(次年1月至3月份)过程中,表达水平随着气温的升高又显著降低(图8-A)。上述结果说明可能参与了茶树冷驯化和脱驯化过程的调控,这也与我们前期发现的钙离子信号通路参与了茶树冷驯化的调控这一结果相符[22]。
低温条件下,在茶树新梢中的表达与4℃低温处理的时间密切相关,短时间的低温处理并不能诱导显著上调表达,低温处理24 h后开始显著上调表达,约为对照(0 h)的2.2倍;随着处理时间延长,72 h时表达与对照相比上调了约5.1倍,上述结果说明的表达受到低温的诱导(图8-B)。
干旱胁迫条件下,使用PEG处理2 d后基因的表达显著上调,约为处理前的2.3倍,说明参与了干旱胁迫的响应。随着处理时间的延长,可能是由于茶树对干旱胁迫产生了一定程度的适应性,表达在处理后的4~8 d逐渐下调至与处理前无显著差异的水平(图8-C)。

注:图中标注了MYB、MYC结合位点,序号j~s、黑色方框及红色方框与表2中的顺式作用元件相对应
表2启动子区域的顺式作用元件分析
Fig 2 Analysis of the-acting elements inpromoter region
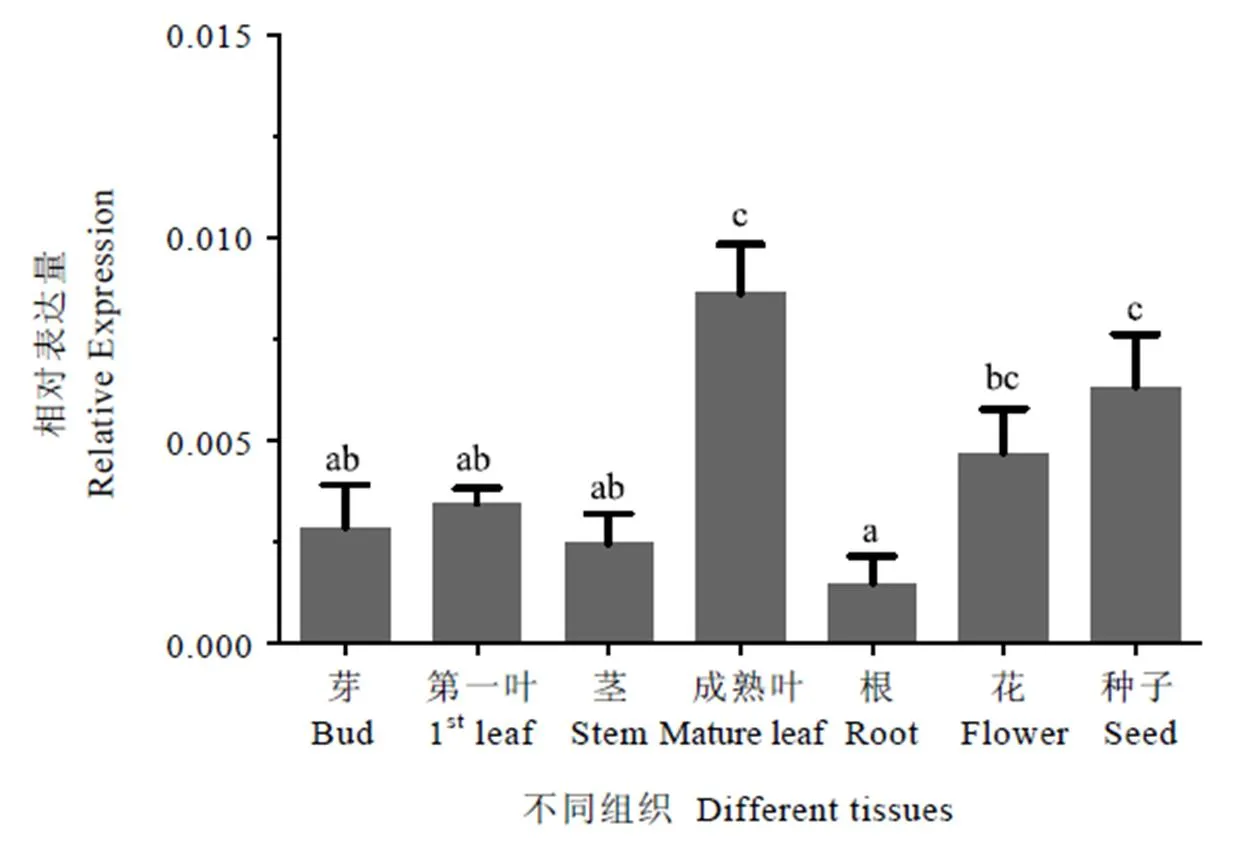
注:数据分析采用Mean with SEM方法,方差分析采用LSD法,柱上小写字母不同表示差异达显著水平(P<0.05)
渗透胁迫条件下基因的表达模式与干旱胁迫类似,在处理后的2~4 d基因显著上调表达,均达到处理前的2.4倍左右,说明基因也参与了茶树对渗透胁迫的响应(图8-D)。
3 讨论
本研究从茶树中克隆到1条与拟南芥AtCPK17同源的钙依赖性蛋白激酶编码基因,并命名为。进化树分析显示该蛋白聚类于CDPK家族的第二亚家族,具备钙依赖性蛋白激酶典型的结构域,即N端可变结构域、激酶结构域、自抑制结构域及C端的4个EF-hand手型结构域。通过与其他物种中已经报道的CDPK氨基酸序列进行比对发现,位于CsCDPK17第111号位点的赖氨酸参与激酶与ATP的结合;位于385~413、421~449、457~485和492~520这4个区域的手型结构可能参与了CsCDPK17与钙离子的结合[23]。综合上述生物信息学分析发现,CsCDPK17属于典型的钙依赖性蛋白激酶。
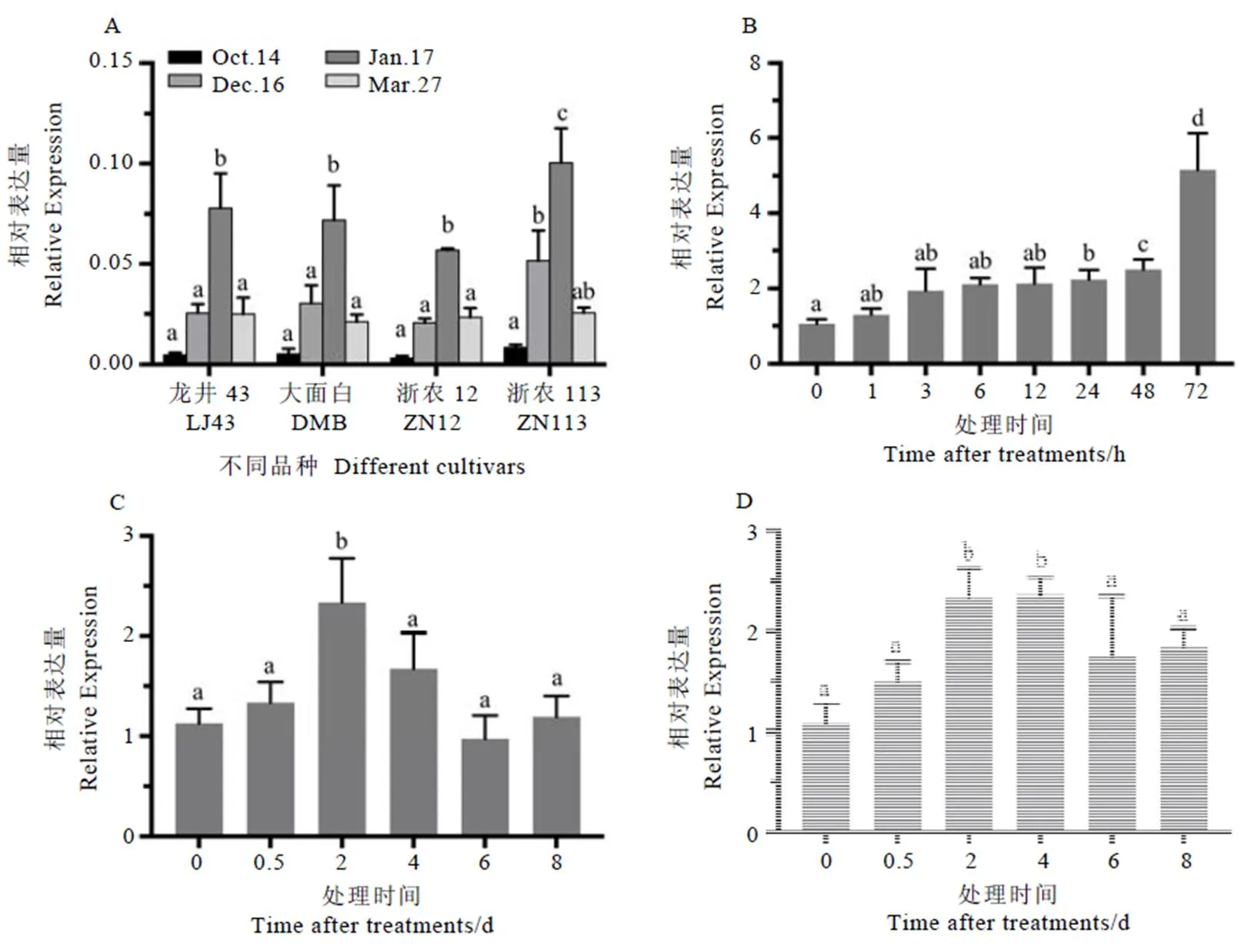
注:数据分析采用Mean with SEM方法,方差分析采用LSD法,柱上小写字母不同表示差异达显著水平(P<0.05)。A:冷驯化;B:低温;C:干旱;D:渗透胁迫
CDPK家族作为最重要的钙离子信号受体之一,各成员在细胞中的定位并不完全相同。有分析发现,CDPK蛋白在亚细胞水平的定位受到其N端可变结构域修饰的影响,N端豆蔻酰化有利于CDPK特异性膜靶向定位[24-25],但是与之直接相关的试验证据还不充分。在拟南芥中具有N端豆蔻酰化修饰位点的AtCPK3/5/20均定位于细胞质膜;而不具有该修饰位点的AtCPK4/11/29等蛋白则是定位于细胞质和细胞核中[6];采用点突变的研究发现N端豆蔻酰化修饰位点突变后AtCPK2/34不再定位于细胞质膜[26]。本研究中,通过序列比对发现CsCDPK17的N-末端具有豆蔻酰化位点(MGNCCS),推测其可能具有细胞质膜定位。使用水稻原生质体和烟草叶片两种瞬时表达的方法均证实CsCPK17定位于细胞膜和细胞核,揭示CsCDPK17可能同时参与了细胞膜Ca2+信号转导和细胞核基因转录水平的调控。
水稻、拟南芥等模式植物中已有的研究表明,CDPK不仅能够依靠自身的磷酸激酶活性直接参与各种生命活动的调控,还能够通过与ABA信号、ROS信号通路互作参与生长发育和逆境迫响应等过程的调控[27]。在拟南芥中,有至少12条基因在花器官中特异表达并且参与了花器官发育的调控,例如:与野生型相比,双突变体的花粉管发育受到严重的影响,说明直接参与了花粉管伸长调控[28];在不同组织中的表达水平依次为成熟叶、种子、花、第一叶、芽、茎、根,其中在成熟叶和种子的表达水平显著高于其他器官,说明该基因可能也参与了茶树中某些组织器官发育的调控。
基因对植物胁迫响应的调控作用已经被广泛报道。拟南芥中,通过ABA信号通路介导的气孔运动增强了转基因拟南芥对干旱胁迫的抗性[29]。在土豆中,是细胞质膜定位的激酶,该蛋白能够与同样定位于细胞质膜的RBOH蛋白(Respiratory burst oxidase homolog protein)相互作用,直接参与土豆细胞中ROS代谢[30]。过表达水稻能够抑制细胞内ROS的积累,从而增强转基因水稻对盐胁迫的耐受性[31];过表达植株具有更强的低温抗性,具体表现为脯氨酸含量的增加和GSH/GSSG(还原型谷胱甘肽/氧化型谷胱甘肽)比率的升高[21]。本研究发现,自然冷驯化过程中4个不同抗寒性的茶树品种中均呈现类似的表达趋势,说明该基因可能参与了茶树越冬过程中的自然冷驯化调控,这一结果也与在成熟叶中表达水平较高和前期研究发现的钙离子信号通路参与了茶树冷驯化过程的调控[22]等结果相一致。在本研究中的低温、干旱和渗透等胁迫处理下,均表现出不同程度的诱导表达,说明该基因在茶树的非生物胁迫响应过程中发挥有一定的生物学功能。同时,在启动子区发现的参与ABA、MeJA、光等信号响应的顺势作用元件也为该基因生物学功能的解析提供了参考;另外,前面提到CsCDPK17是细胞质膜和细胞核双定位的蛋白激酶,其细胞核定位也与启动子中发现的转录顺势调控元件相符合,可在一定程度上调控下游基因的逆境胁迫响应。在茶树的生长发育和胁迫响应等过程中具体的功能、其对钙离子信号的感知过程、下游的磷酸化底物的种类和数量以及与ABA、ROS等信号通路之间的关联将会是后续研究的重点。
[1] Valmonte G R, Arthur K, Higgins C M, et al. Calcium-dependent protein kinases in plants: evolution, expression and function [J]Plant Cell Physiol, 2014, 55(3): 551-569.
[2] Bagur R, Hajnoczky G. Intracellular Ca2+sensing: its role in calcium homeostasis and signaling [J]. Mol Cell, 2017, 66(6): 780-788.
[3] Dupont G, Sneyd J. Recent developments in models of calcium signalling [J]. Current Opinion in Systems Biology, 2017, 3: 15-22.
[4] Schulz P, Herde M, Romeis T. Calcium-dependent protein kinases: hubs in plant stress signaling and development [J]. Plant Physiol, 2013, 163(2): 523-530.
[5] Shi S, Li S, Asim M, et al. TheCalcium-dependent protein kinases (CDPKs) and their roles in plant growth regulation and abiotic stress responses [J]International Journal of Molecular Sciences 2018, 19(7). Doi: 10.3390/ijms19071900.
[6] Cheng S H, Willmann M R, Chen H C, et al. Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family [J]. Plant Physiol, 2002, 129(2): 469-485.
[7] Ray S, Agarwal P, Arora R, et al. Expression analysis of calcium-dependent protein kinase gene family during reproductive development and abiotic stress conditions in rice (L. ssp.) [J]Mol Genet Genomics, 2007, 278(5): 493-505.
[8] Zuo R, Hu R, Chai G, et al. Genome-wide identification, classification, and expression analysis of CDPK and its closely related gene families in poplar () [J]. Mol Biol Rep, 2013, 40(3): 2645-2662.
[9] Mittal S, Mallikarjuna M G, Rao A R, et al. Comparative Analysis of CDPK Family in Maize,, rice, and sorghum revealed potential targets for drought tolerance improvement [J]Front Chem, 2017, 5: 115. Doi: 10.3389/fchem.2017.00115.
[10] 张成才. 茶树育性相关基因的克隆与表达研究[D]. 武汉: 华中农业大学, 2017.
[11] Wang M, Li Q, Sun K, et al. Involvement ofandin regulation of thermotolerance in tea plant () [J]. Plant Molecular Biology Reporter, 2018, 36(2): 176-187.
[12] Li A L, Zhu Y F, Tan X M, et al. Evolutionary and functional study of the CDPK gene family in wheat (L.) [J]. Plant Molecular Biology, 2008, 66(4): 429-443.
[13] Komatsu S, Yang G, Khan M, et al. Over-expression of calcium-dependent protein kinase 13 and calreticulin interacting protein 1 confers cold tolerance on rice plants [J]. Molecular Genetics & Genomics, 2007, 277(6): 713-723.
[14] Jiang S, Zhang D, Wang L, et al. A maize calcium-dependent protein kinase gene,, positively regulated abscisic acid signaling and enhanced drought stress tolerance in transgenic[J]. Plant Physiology and Biochemistry, 2013, 71: 112-120.
[15] Franz S, Ehlert B, Liese A, et al. Calcium-dependent protein kinase CPK21 functions in abiotic stress response in[J]. Mol Plant, 2011, 4(1): 83-96.
[16] 林郑和, 钟秋生, 游小妹, 等. 低温胁迫对茶树抗氧化酶活性的影响[J]. 茶叶科学, 2018, 38(4): 363-371.
[17] 孙海伟, 曹德航, 尚涛, 等. 茶树抗寒育种及转基因研究进展[J]. 山东农业科学, 2013, 45(6): 119-122.
[18] Wei C, Yang H, Wang S, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences, 2018, 115(18): E4151-E4158.
[19] Hao X, Horvath D, Chao W, et al. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant ((L.) O. Kuntze) [J]. International Journal of Molecular Sciences, 2014, 15(12): 22155-22172.
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–Δ∆Ctmethod [J]. Methods, 2001, 25(4): 402-408.
[21] Liu Y, Xu C, ZhuY, et al. The calcium-dependent kinase OsCPK24 functions in cold stress responses in rice [J]. J Integr Plant Biol, 2018, 60(2): 173-188.
[22] Wang X, Zhao Q, Ma C, et al. Global transcriptome profiles ofduring cold acclimation [J]. Bmc Genomics, 2013, 14(1): 415. https://doi.org/10.1186/1471-2164-14-415.
[23] Rutschmann F, Stalder U, Piotrowski M, et al., a calcium-dependent protein kinase from tomato. Plasma membrane targeting and biochemical characterization [J]. Plant Physiol, 2002, 129(1): 156-168.
[24] 丁玉娇, 韩颖颖, 周婧雯. 棕榈酰化蛋白及蛋白质的棕榈酰化研究进展[J]. 亚热带植物科学, 2018, 47(4): 43-50.
[25] MartõÂn M L, Busconi L. Membrane localization of a rice calcium-dependent protein kinase (CDPK) is mediated by myristoylation and palmitoylation [J]. The Plant Journal, 2000, 24(4): 429-435.
[26] T Gutermuth, R Lassig, MT Porteset, et al. Pollen tube growth regulation by free anions depends on the interaction between the anion channel SLAH3 and calcium-dependent protein kinases CPK2 and CPK20 [J]. Plant Cell, 2013, 25(11): 4525-4543.
[27] Xu X, Liu M, Lu L, et al. Genome-wide analysis and expression of the calcium-dependent protein kinase gene family in cucumber [J]. Mol Genet Genomics, 2015, 290(4): 1403-1414.
[28] Zhao L N, Shen L K, Zhang W Z, et al. Ca2+-dependent protein kinase11 and 24 modulate the activity of the inward rectifying K+channels inpollen tubes [J]. Plant Cell, 2013, 25(2): 649-661.
[29] Zou J J, Wei F J, Wang C, et al. Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stomatal regulation in response to drought stress [J]. Plant Physiol, 2010, 154(3): 1232-1243.
[30] Kobayashi M, Yoshioka M, Asai S, et al. StCDPK5 confers resistance to late blight pathogen but increases susceptibility to early blight pathogen in potato via reactive oxygen species burst [J]. New Phytol, 2012, 196(1): 223-237.
[31] Asano T, Hayashi N, Kobayashi M, et al. A rice calcium-dependent protein kinase OsCPK12 oppositely modulates salt-stress tolerance and blast disease resistance [J]. Plant J, 2012, 69(1): 26-36.
Identification and Expression Analysis of Calcium-dependent Protein Kinasein Tea Plant ()
LEI Lei, WANG Lu, YAO Lina, HAO Xinyuan, ZENG Jianming, DING Changqing*, WANG Xinchao*, YANG Yajun
Tea Research Institute of the Chinese Academy of Agricultural Sciences/National Center for Tea Improvement/Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China
Calcium-dependent protein kinases (CDPKs or CPKs) are important calcium sensors in higher plants, which are extensively involved in plant development and stress responding. In this study, one sequence that contained a complete ORF of 1 611 bp encoding a 568 amino acids protein was cloned fromcv.Longjing43. Sequence alignments revealed that this protein was a typical plant CDPK possesses N-terminus myristoylation site and protein kinases domain and showed the highest similarity with Arabidopsis. Thus, the gene was defined asbase on further phylogenetic analysis (Genbank accession No. MK238482).Basic protein character analysis shows that CsCDPK17 was a hydrophilic membrane-binding protein with molecularweight of 59.9 kD and PI of 5.43. Further subcellular localization assay using transientexpression in rice protoplasts and tobacco leaves proved that CsCDPK17 was localized in plasma membrane and nucleus. A series of gene transcription, light and hormone (such as ABA, SA, MeJA, etc) responding related-elements were detected in2 000 bp promoter regions. Tissue-specific expression analysis found that high expressions ofwere in the mature leaves and seeds, while the lowest transcription in roots. The transcription ofwas increased during cold acclimation and decreased during de-acclimation procedures in four cultivars with different cold resistance abilities. Moreover, stress induced expression indicated thatcould be induced by cold, drought and osmotic stresses with the highest induction levels of 5.1, 2.3 and 2.4 folds, respectively. Overall, our results suggest that the newly clonedmight be involve in the regulation of both development and abiotic stress responses (such as cold, drought and osmotic stress) in tea plants.
tea plant, CDPK gene, subcellular localization, abiotic stress, expression analysis
S571.1;Q52
A
1000-369X(2019)03-267-13
2018-11-29
2018-12-29
国家自然科学基金(31770735)、现代农业(茶叶)产业技术体系(CARS-19)、浙江省农业新品种选育重大科技专项(2016C02053-4)
雷蕾,硕士研究生,主要从事茶树遗传育种与抗逆机理研究。*通信作者:chqding@tricaas.com,xcw575@tricaas.com

