光促进6-三氟甲基-菲啶衍生物的合成
杨晓博, 吴松晓, 潘文娜, 田 瑶, 刘书扬
(沈阳师范大学 化学化工学院, 沈阳 110034)
0 引 言
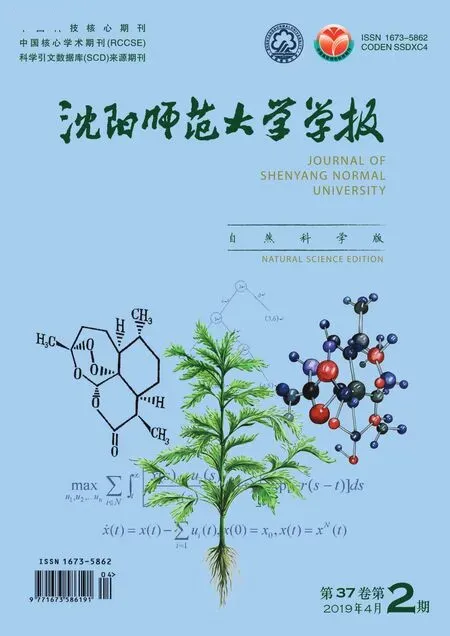
菲啶骨架广泛存在于天然产物分子及药物分子中[1-2]。因此,发展一种获得各种菲啶衍生物的简便有效的合成方法至关重要。在之前的文献报道中,6-取代的菲啶化合物通常是通过自由基加成和芳基异氰化物的环化来合成的[3-5]。近年来,2-芳基异氰衍生物,作为良好的自由基受体,利用不同类型的自由基与其加成并环化合成不同的6-取代的菲啶受到了广泛关注[6-9]。其中6-三氟甲基取代的菲啶的合成,因其含有在药物分子中常见的三氟甲基(CF3),更是得到了科研工作者前所未有的重视[10-13]。一般来讲,在三氟甲基化中,三氟甲基源的选择对三氟甲基化反应的成功与否起关键作用,并且在某种程度上决定了反应的可能性和速率[14-17]。迄今为止,在使用2-芳基异氰为底物合成6-三氟甲基-菲啶衍生物的方法中,涌现出一大批有效的三氟甲基化试剂,如CF3I[18],CF3SO2Cl[19-20],TMSCF3[21],Togni试剂[22-23],Umemoto试剂[24],Langlois试剂[25-27]等(图1(a))。 这其中,Langlois试剂,作为一种稳定且廉价的固体,在过去几年中更是被广泛采用[28-31]。然而,在以往报道的此种类型的反应中,三氟甲基自由基[25-27]的生成通常使用过量的氧化剂如TBHP(叔丁基过氧化氢)或K2S2O8(过硫酸钾),这些氧化剂的过量使用,不仅大大降低了此类方法放大,还增加了合成中的爆炸风险。因此,寻找一种无需使用外部氧化剂,直接由Langlois试剂产生三氟甲基自由基以构建6-三氟甲基-菲啶的方法非常必要。
光促进的有机反应是近年来绿色化学的研究热点之一,在有机合成领域得到了广泛应用,它具有环境友好、可持续等优点[32-35],往往使反应可以在非常温和的条件下进行。2016年,李朝军教授课题组报道了一种光促进的由Langlois试剂产生三氟甲基自由基实现富含电子芳烃的三氟甲基化的新方法,该方法无需外加氧化剂,丙酮作为溶剂的同时也充当了氧化剂[36]。最近,胡金波课题组报道了一种通过可见光促进的合成6-氟烷基代菲啶的新方法,该方法使用异氰化物和氟化砜为底物,采用的氟代化试剂廉价易得,且反应简便高效[37]。随后,刘课题组发现,在可见光照射下,可以在非常温和条件下利用Langlois试剂合成6-三氟甲基菲啶衍生物,反应收率较高,但遗憾的是在该反应中需要加入当量的过硫酸钾[38](图1(b))。
为了解决上述方法中存在的问题,实现6-三氟甲基菲啶衍生物的绿色合成,合理利用光能,受到已有优秀工作的启发,特别是李朝军教授课题组在2016年对光促进富电子芳烃的三氟甲基化研究的启发,提出如下设想:在紫外光照射下,激发态的丙酮也可以作为自由基引发剂及氧化剂促使廉价易得的Langlois试剂产生三氟甲基自由基,从而与2-芳基异氰类化合物发生反应,实现光促进的串联的分子间三氟甲基化及分子内环化反应,生成一系列的具有潜在生物活性的6-三氟甲基-菲啶的衍生物(图1(c))。
过去的工作:
本文工作:

图1 由2-芳基异氰衍生物合成6-三氟甲基菲啶Fig.1 The synthesis of 6-trifluoromethyl-phenanthridines from aryl isocyanides
1 实验仪器及试剂
1.1 实验仪器
德国布鲁克公司500 MHz核磁共振谱仪用于测定化合物的核磁共振氢谱、碳谱和氟谱。日本岛津公司GCMS-QP2010型气质联用仪用于监测反应及测定化合物的质谱。METTLER TOLEDO公司AL104型电子天平,灵敏度0.1 mg。北京泰克公司X-4型显微熔点仪测定化合物熔点。
1.2 实验试剂
乙酸乙酯、正戊烷、丙酮等分析纯常规溶剂全部购自于天津市津东天正精细化学试剂厂,直接使用。各种合成2-芳基异氰衍生物的苯硼酸,Langlois试剂(CF3SO2Na)等均购自于安耐吉化学,实验所用无机碱、无机盐购自北京偶合科技有限公司。所有化学品纯度均在98%以上,直接使用。
2 结果与讨论
2.1 反应条件的优化
为证实上述设想,选择2-芳基异氰(1c)为底物与CF3SO2Na(2)反应作为模板反应,并在此基础上对各种反应条件进行筛选(图2)。
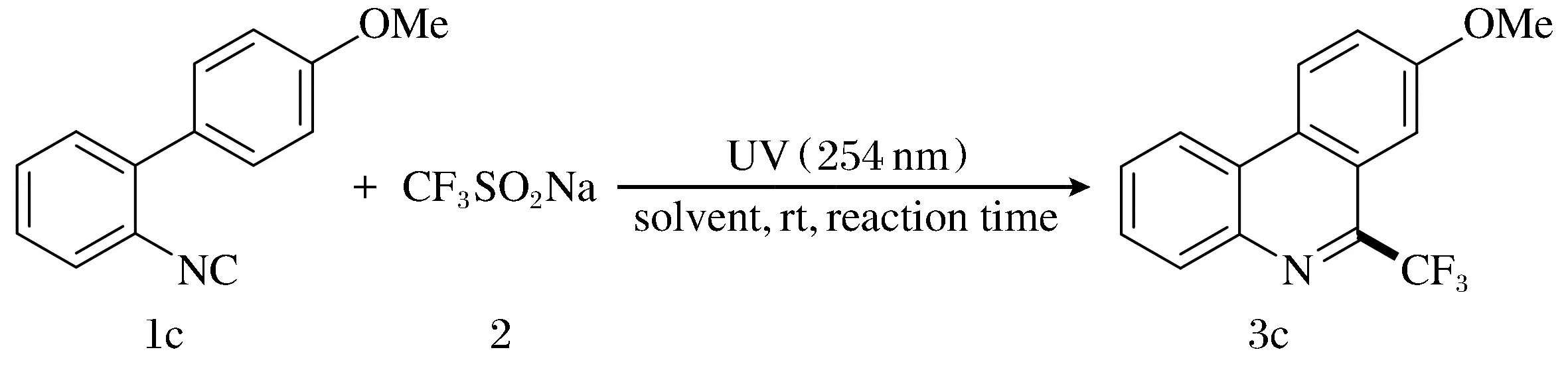
图2 模板反应Fig.2 Template reaction
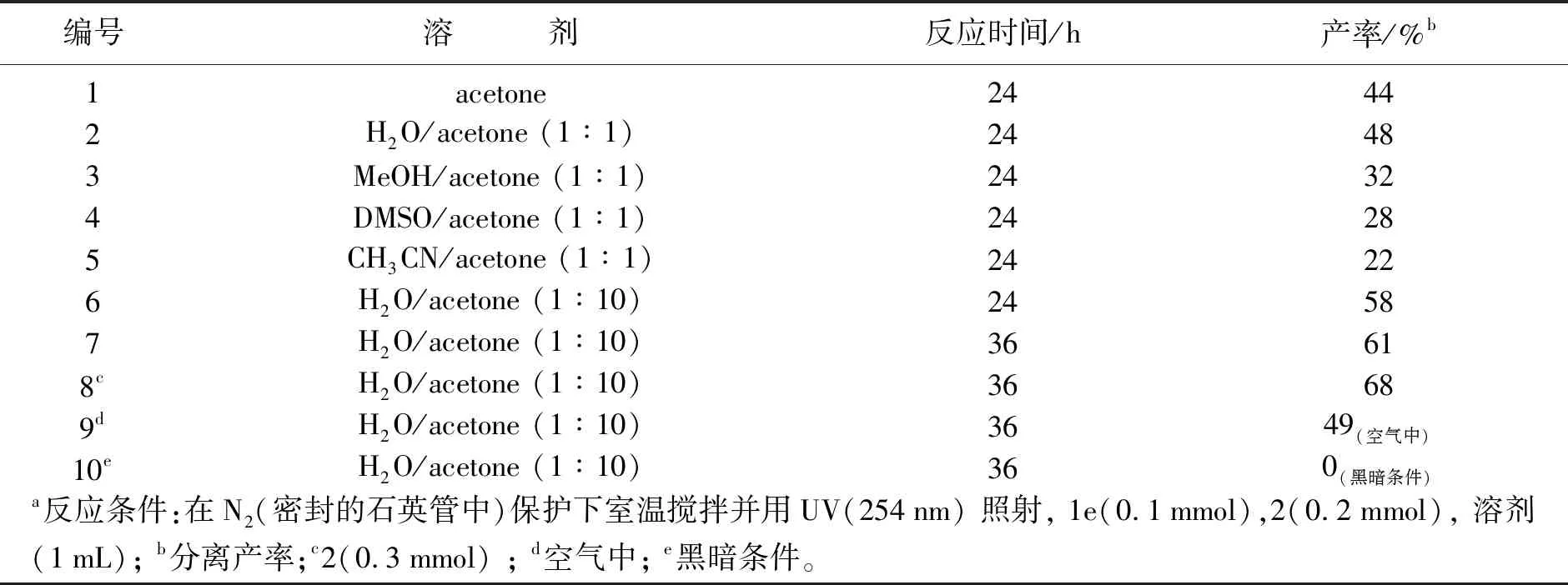
编号溶 剂反应时间/h产率/%b1acetone24442H2O/acetone (1∶1)24483MeOH/acetone (1∶1)24324DMSO/acetone (1∶1)24285CH3CN/acetone (1∶1)24226H2O/acetone (1∶10)24587H2O/acetone (1∶10)36618cH2O/acetone (1∶10)36689dH2O/acetone (1∶10)3649(空气中)10eH2O/acetone (1∶10)360(黑暗条件)a反应条件:在N2(密封的石英管中)保护下室温搅拌并用UV(254nm) 照射, 1e(0.1mmol),2(0.2mmol), 溶剂(1mL); b分离产率;c2(0.3mmol) ; d空气中; e黑暗条件。
首先,使用1c和2为底物,以丙酮为溶剂,在室温下用紫外光照射(254 nm)进行反应24 h。由表1可以看出,反应产生了所需的6-三氟甲基-菲啶3c,产率为44%(编号1)。接着,考虑到底物的溶解性的问题,几种混合溶剂被使用来提高反应的效率,综合结果不难看出,水/丙酮(1∶1)效果较好(编号2~5)。丙酮在该反应中起关键作用,因此增加混合溶剂中丙酮的比例,当水/丙酮为1∶10时,该反应的收率可以提高到58%(编号6)。为了进一步提高反应效率,还延长了反应时间和增加了CF3SO2Na的用量,反应时间延长至36 h,3c的产率略有增加(编号7),提高CF3SO2Na的量至3当量可获得68%的最佳收率(编号8)。此外,对比实验表明,在没有光照射的情况下,该自由基反应不能够进行,且当在空气中进行反应时,3c的产率降低至49%。因此,得到该反应的最佳反应条件为:2-芳基异氰化物和3当量的Langlois试剂,以水/丙酮(1∶10)为溶剂,室温(约25 ℃),氮气保护下,用紫外光照射(254 nm)反应36 h。
2.2 6-三氟甲基-菲啶衍生物的合成
在上述反应体系选取和及反应优化的基础上,得到了如下合成通法:
2-芳基异氰化物(1)(0.1 mmol)与CF3SO2Na(2)(0.3 mmol)以H2O/丙酮(1∶10,1 mL)为溶剂在室温(约25 ℃)下,在密闭石英反应管中,用紫外光照射(254 nm)反应36 h。然后过滤反应液,滤液加入10 mL水稀释后,使用乙酸乙酯(10mL×3)萃取。
表26-三氟甲基菲啶衍生物的合成
Table 2Synthesis of 6-trifluoromethyl phenanthridine derivatives

注: a反应条件:在室温中N2(在密封的石英管中)保护并用UV(254 nm)照射下搅拌36 h,1(0.1 mmol),2(0.3 mmol), H2O/丙酮=1∶10(1 mL); b分离产率
分离有机层,减压条件下蒸去溶剂,最后通过柱层析法纯化残余物,正戊烷:乙酸乙酯(20∶1)作为洗脱剂,得到最终的目标产物(3)。
为检验该方法的通用性和官能团的容忍性,利用上述的合成通法合成了11种6-三氟甲基代菲啶衍生物,总体来看,大部分底物都能实现高效的转化,取得不错的收率,电子效应及空间效应对反应的效率及选择性影响不大。此外该方法对官能团氟(3h)、氯(3d,3i)、甲基(3g)和甲氧基(3c,3e,3j)等具有良好的容忍性,均能顺利地实现三氟甲基化,得到中等产率的目标产物(表2)。
获得的各种衍生化合物3a-3k的NMR结构表征数据如下:
6-(trifluoromethyl) phenanthridine (3a)[21]
洗脱剂:正戊烷:乙酸乙酯=20∶1;收率:15 mg(62%);黄色固体,熔点:68-70 ℃。
1H NMR(500 MHz,CDCl3)δ8.72(d,J=8.4 Hz,1H),8.64~8.60(m,1H),8.40(d,J=8.4 Hz,1H), 8.33~8.28(m,1H),7.99~7.89(m,1H),7.85~7.76(m,3H).13C NMR(126 MHz,CDCl3)δ146.5(q,JC-F=33.0 Hz),141.8,134.0,131.4,131.2,129.3,129.2,128.1,126.0(q,JC-F=3.3 Hz),125.1,122.5,122.1,121.9(q,JC-F=277.1 Hz),121.8.19F NMR(471 MHz,CDCl3)δ-63.46.GCMS:C14H8F3N calculated mass 247.1, found mass 247.0.
8-methyl-6-(trifluoromethyl) phenanthridine (3b)[21]
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:20 mg(77%);黄色固体,熔点:123~125 ℃。
1H NMR(500 MHz,CDCl3)δ8.56(m,2H), 8.30~8.24(m,1H),8.14(s,1H),7.8~7.74(m,2H),7.75~7.72(m, 1H),2.63(s,3H).13C NMR(126 MHz,CDCl3)δ146.2(q,JC-F=32.8 Hz),141.4,138.2,133.2, 131.9,131.0,129.1,128.8,125.2(q,JC-F=3.1 Hz),125.2,122.4,122.0,122.0(q,JC-F=277.1 Hz),121.9,21.9.19F NMR(471 MHz,CDCl3)δ-63.48.GCMS:C15H10F3N calculated mass 261.1, found mass 261.0.
8-methoxy-6-(trifluoromethyl) phenanthridine(3c)[19]
洗脱剂:正戊烷:乙酸乙酯=20∶1;收率:19 mg(68%);白色固体,熔点:116~118 ℃。
1H NMR(500 MHz,CDCl3)δ8.58(d,J=8.8 Hz,1H),8.50(s,1H),8.25~8.26(m,1H),7.75(m,2H),7.66(s,1H),7.53(d,J=8.2 Hz,1H),4.00(s,3H).13C NMR(126 MHz,CDCl3)δ159.0,145.5(q,JC-F=33.0 Hz),141.0,131.0,129.2,128.4,128.3,125.3,124.1,123.1,122.5,122.0(q,JC-F=277.1 Hz),121.6,105.5(q,JC-F=3.2 Hz),55.5.19F NMR(471 MHz,CDCl3)δ-64.08. GCMS: C15H10F3NO calculatedd mass 277.1, found mass 277.0.
2,8-dichloro-6-(trifluoromethyl) phenanthridine (3d)
洗脱剂:正戊烷:乙酸乙酯=20∶1;收率:19 mg(60%);黄色固体,熔点:154~156 ℃。
1H NMR(500 MHz,CDCl3)δ8.53(d,J=8.9 Hz,1H),8.49(m,1H),8.35~8.29(m,1H),8.21(d,J=8.8 Hz,1H),7.89(dd,J=8.9,2.0 Hz,1H),7.76(dd,J=8.7,2.2 Hz,1H).13C NMR(126 MHz,CDCl3)δ145.7(q,JC-F=33.7 Hz),140.1,136.0,135.1,132.7,132.4,131.3,130.4,125.6,125.3(q,JC-F=3.5 Hz),124.3,122.7,121.7,121.5(q,JC-F= 277.0 Hz).19F NMR(471 MHz,CDCl3)δ-63.71. HR-MS(ESI)[M+H]+m/z calculated for C14H7Cl2F3N+315.990 2, found 315.9905.
2-chloro-8-methoxy-6-(trifluoromethyl)phenanthridine (3e)
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:16 mg(52%);白色固体,熔点:159~161 ℃。
1H NMR(500 MHz,CDCl3)δ8.48(d,J=9.1 Hz,1H),8.44(s,1H),8.17(d,J=8.7 Hz,1H),7.66(m,2H),7.54(d,J=9.1 Hz,1H),4.00(s,3H).13C NMR(126 MHz,CDCl3)δ159.5,145.7(q,JC-F=33.0 Hz),139.3,135.4,132.5,129.0,127.4,126.3,124.2,123.4,122.7,121.9(q,JC-F=277.0 Hz),121.2,105.6(q,JC-F=3.5 Hz),55.6.19F NMR(471 MHz,CDCl3) δ -64.20. HR-MS(ESI)[M+H]+m/z calculated for C15H10ClF3NO+312.039 8, found 312.039 7.
2-chloro-8-phenyl-6-(trifluoromethyl) phenanthridine (3f)
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:21 mg(60%);黄色固体,熔点:160~162 ℃。
1H NMR(500 MHz,CDCl3)δ8.64(d,J=8.6 Hz,1H),8.58~8.51(m,2H),8.21(d,J=8.7 Hz,1H), 8.16(d,J=8.4 Hz,1H),7.78~7.70(m,3H),7.57~7.54(m,2H),7.49~7.45(m,1H).13C NMR(126 MHz,CDCl3)δ146.8(q,JC-F=33.3 Hz),141.7,140.1,139.5,135.5,132.6,131.9,131.0,129.9,129.2,128.4,127.5, 126.0,123.8(q,JC-F=3.3 Hz),123.1,122.4,121.8,121.8(q,JC-F=277.2 Hz).19F NMR(471 MHz,CDCl3)δ-63.44. HR-MS(ESI)[M+H]+m/z calculated for C20H12ClF3N+358.060 5, found 358.060 6.
2-fluoro-8-methyl-6-(trifluoromethyl) phenanthridine(3g)
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:19 mg(68%);白色固体,熔点:158~160 ℃。
1H NMR(500 MHz,CDCl3)δ8.46(d,J=8.5 Hz,1H),8.27(m,1H),8.18~8.15(m,2H),7.77(d,J=85 Hz,1H),7.51(td,J=8.5,2.7 Hz,1H),2.65(s,3H).13C NMR(126 MHz,CDCl3)δ162.6(d,JC-F=250.4 Hz),145.5(q,JC-F=33.2 Hz),139.1,138.3,133.5(d,JC-F=9.6 Hz),13.3,131.4(d,JC-F=4.3 Hz), 126.9(d,JC-F=9.4 Hz),125.3(q,JC-F=3.2 Hz),122.6, 122.0,121.9(q,JC-F=277.0 Hz),118.0(d,JC-F=24.6 Hz),107.0(d,JC-F=23.6 Hz),22.0.19F NMR(471 MHz,CDCl3)δ-63.53, -109.09. HR-MS(ESI)[M+H]+m/z calculated for C15H10F4N+280.074 4, found 280.074 4.
8-fluoro-2-methyl-6-(trifluoromethyl) phenanthridine (3h)[22]
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:18 mg(62%);白色固体,熔点:126~128 ℃。
1H NMR(500 MHz,CDCl3)δ8.66(m,1H),8.30(s,1H),8.16(d,J=8.3 Hz,1H),7.97(d,J=9.8 Hz,1H),7.6~7.58(m,2H),2.65(s,3H).13C NMR(126 MHz,CDCl3)δ161.4(d,JC-F= 249.7 Hz),144.7(q,JC-F=33.2 Hz),140.1,139.8,131.0,130.9,130.4,125.1(d,JC-F=8.7 Hz),124.6,122.9(d,JC-F=8.5 Hz),121.9(q,JC-F=276.7 Hz),121.4,120.6(d,JC-F=24.0 Hz),110.6(dq,JC-F=23.2,3.3 Hz),22.2.19F NMR(471 MHz,CDCl3)δ-63.91, -110.29. GCMS: C15H9F4N calculated mass 279.1, found mass 279.0.
8-chloro-2-methyl-6-(trifluoromethyl) phenanthridine (3i)[22]
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:16 mg(54%);白色固体,熔点:149~151 ℃。
1H NMR(500 MHz,CDCl3)δ8.60(d,J=8.9 Hz,1H),8.35~8.29(m,2H),8.16(d,J=8.4 Hz,1H),7.84(dd,J=8.9,2.1 Hz,1H),7.65(dd,J=8.4,1.5 Hz,1H),2.66(s,3H).13C NMR(126 MHz,CDCl3)δ144.5(q,JC-F=33.3 Hz),140.1,140.0,134.1,132.0,131.8,131.5,131.0,125.1(q,JC-F=3.6 Hz),124.4,124.2,122.7,121.5,121.7(q,JC-F=276.9 Hz),22.2.19F NMR(471 MHz,CDCl3)δ-63.51. GCMS:C15H9ClF3N calculated mass 295.0, found mass 295.0.
8-methoxy-2-methyl-6-(trifluoromethyl) phenanthridine (3j)[23]
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:16 mg(55%);白色固体,熔点:147~149 ℃。
1H NMR(500 MHz,CDCl3)δ8.55(d,J=9.2 Hz,1H),8.26(s,1H),8.13(d,J=8.4 Hz,1H),7.64(s,1H),7.56(d,J=8.3 Hz,1H),7.50(dd,J=9.1,2.5 Hz,1H),3.99(s,3H),2.63(s,3H).13C NMR(126 MHz,CDCl3)δ158.8,144.5(q,JC-F=32.7 Hz),139.5,139.3,130.7,130.1,128.1,125.1,124.1,123.2,122.2,122.1(q,JC-F=276.8 Hz),121.1,105.4(q,JC-F=3.4 Hz),55.5,22.1.19F NMR(471 MHz,CDCl3)δ-63.96. GCMS:C16H12F3NO calculated mass 291.1, found mass 291.0.
2-methyl-8-phenyl-6-(trifluoromethyl)phenanthridine (3k)[23]
洗脱剂:正戊烷∶乙酸乙酯=20∶1;收率:18 mg(54%);白色固体,熔点:121~123 ℃。
1H NMR(500 MHz,CDCl3)δ8.73(d,J=8.7 Hz,1H),8.55~8.51(m,1H),8.39(s,1H),8.18(d,J=8.3 Hz,1H),8.14(dd,J=8.6,1.7 Hz,1H),7.79-7.73(m,2H),7.63(d,J=8.3 Hz,1H),7.55(t,J=7.6 Hz,2H),7.46(t,J=7.4 Hz,1H),2.67(s,3H).13C NMR(126 MHz,CDCl3)δ145.6(q,JC-F=32.6 Hz),140.8,140.1,139.9,139.7,132.6,131.1,130.8,130.4,129.1,128.2,127.5,124.9,123.7(q,JC-F=3.3 Hz),123.1,122.3,121.7,122.1(q,JC-F=277.0 Hz),22.2.19F NMR(471 MHz,CDCl3)δ-63.24. GCMS:C21H14F3N calculated mass 337.1, found mass 337.0.
2.3 反应机理的研究
为了更好地理解此反应的反应机理,进行了如下的对比试验(图3):紫外光下在原有反应体系中加入2当量自由基捕获剂TEMPO(2,2,6,6-四甲基哌啶氮氧化物),进行1a至3a的反应,结果显示该反应几乎完全被抑制,由此推测该反应可能为自由基过程。
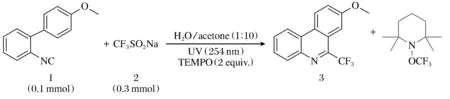
图3 反应机理的研究Fig.3 Study of reaction mechanism
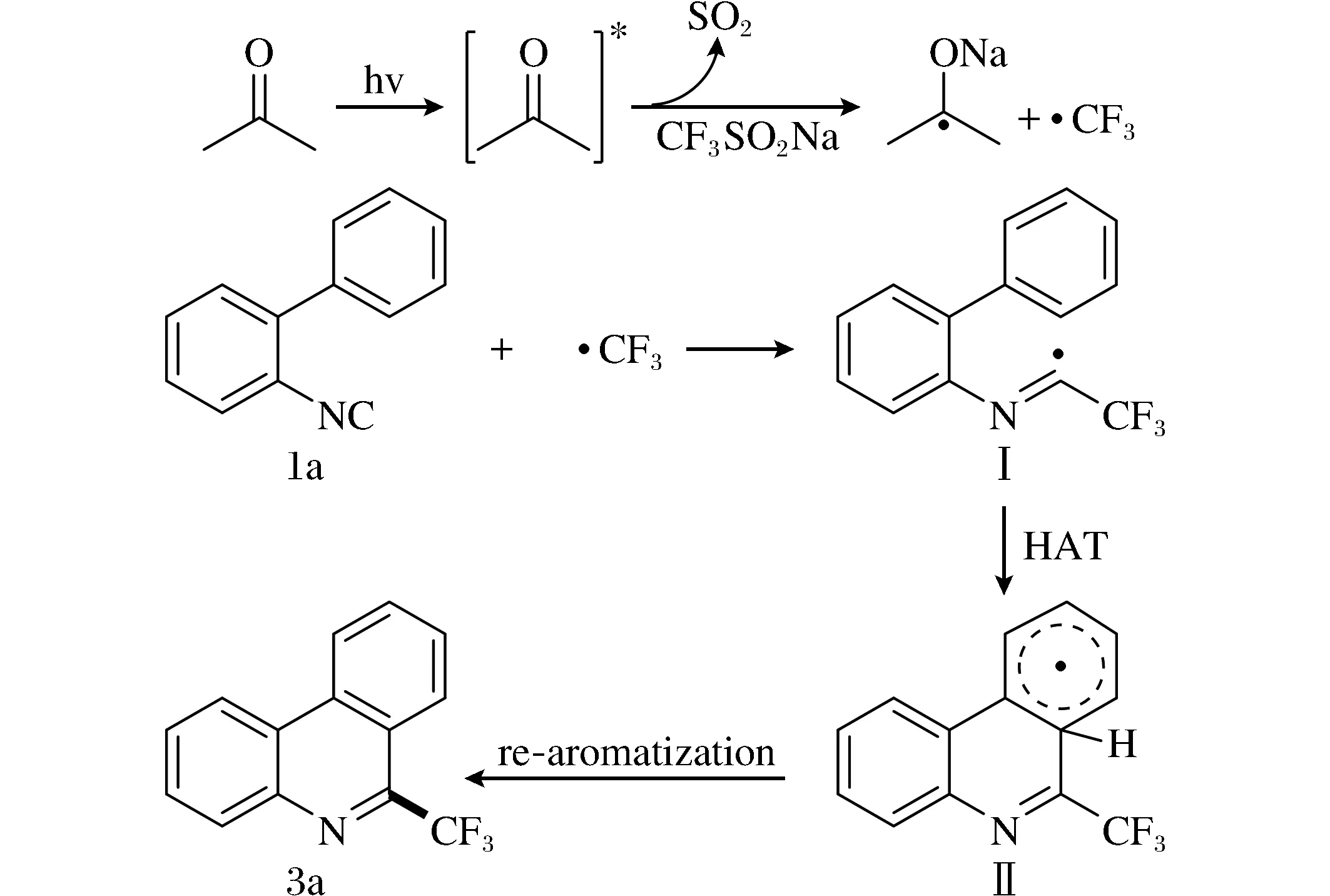
图4 可能的反应机理Fig.4 Possible reaction mechanism
因此,参考此前的报道,据上述实验结果,对反应机理进行了如下预测(图4)。 首先,在紫外光照射下,丙酮中的羰基被激发,并形成双自由基物种,然后与三氟甲烷亚磺酸钠反应释放一分子的二氧化硫并产生三氟甲基自由基。随后,三氟甲基自由基进攻1a中的异氰基,得到亚胺自由基Ⅰ,进而发生氢转移过程,实现分子内环化,产生中间体Ⅱ。 最后,中间体II发生再芳构化,得到所需产物3a。
3 结 论
综上所述,发展出一种光促进的三氟甲基化和分子内的自由基环化反应,发展了一种更为简便的方法实现容易制备的2-芳基异氰化物与Langlois试剂合成6-三氟甲基-菲啶衍生物的新方法,并优化确定了该方法的最佳反应条件:2-芳基异氰化物和3当量的Langlois试剂,以水/丙酮(1∶10)为溶剂,室温(约25 ℃),氮气保护下,用紫外光照射(254 nm)反应36 h。利用该方法合成了11种具有潜在生物活性的6-三氟甲基-菲啶衍生物。该方法具有无需外部氧化剂,良好的官能团耐受性和非常温和的反应条件等优点。并以此方法合成表征了11种6-三氟甲基-菲啶衍生物,除此之外,本论文还提出供了一种光促进、环境友好的,可用于构建高附加值含氮杂环的新策略。