电针风池穴对脑缺血再灌注大鼠突触素、生长相关蛋白-43的影响
韩清,徐鸣曙,张英杰,徐佳,葛林宝
电针风池穴对脑缺血再灌注大鼠突触素、生长相关蛋白-43的影响
韩清1,徐鸣曙2,张英杰2,徐佳3,葛林宝4,5
(1.复旦大学附属金山医院,上海 201508;2.上海市针灸经络研究所,上海 200030;3.上海中医药大学附属岳阳中西医结合医院,上海 200437;4.上海市气功研究所,上海 200030;5.上海市针灸经络研究中心,上海 201203)
观察电针风池穴对脑缺血再灌注大鼠突触素(synaptophysin, SYN)、生长相关蛋白-43(growth associated protein-43, GAP-43)表达变化的影响。将32只SD雄性大鼠随机分为正常组、假手术组、模型组、电针组,每组8只。模型组和电针组采用线栓法制作脑缺血再灌注模型。采用电针双侧风池穴对电针组大鼠进行治疗,每日1次,每次30 min,至动物处死。应用免疫组织化学法检测SYN和GAP-43的表达。模型组和电针组造模后2 h和造模后6 d Bederson评分与正常组和假手术组比较,差异均有统计学意义(<0.05)。模型组和电针组造模后6 d海马和皮层SYN IOD值和GAP-43 IOD值与正常组和假手术组比较,差异均具有统计学意义(<0.05)。电针组造模后6 d海马和皮层SYN IOD值和GAP-43 IOD值与模型组比较,差异均具有统计学意义(<0.05)。电针风池穴可促进脑缺血再灌注模型大鼠的GAP-43和SYN的表达,表明电针可以促进轴突再生,对突触的可塑性具有正向改善作用。
针刺疗法;电针;穴,风池;脑缺血;再灌注损伤;突触素;生长相关蛋白-43
卒中是近年来严重威胁人类健康的三大疾病之一,呈现出高发病率、高死亡率、高致残率的三高特征。缺血性卒中占卒中70%以上[1-2]。随着老年人在社会人群中的比例不断上升,其发病率仍会进一步上升。医学技术的进步虽然在一定程度上减少了死亡率,但也一定程度上增加了中风病的致残率水平,给社会和家庭造成巨大负担。相关研究表明,神经系统对机体内、外环境变化进行适应或应变而发生结构与功能变化称为神经可塑性[3],而突触是神经可塑性变化的关键结构部位。突触素(synaptophysin, SYN)是一种与突触结构和功能均有密切联系的磷酸蛋白,其主要存在于神经元突触前囊泡,在突触囊泡的转运、导入及递质的释放中发挥重要作用,是突触小泡特异性蛋白。SYN既可以影响突触结构,又参与了突触囊泡转运和排放过程,由此实现了调控突触传递的效能,从而在突触可塑性中起一定作用[4]。故SYN是公认的神经可塑性的主要标记物。而神经生长相关蛋白-43(growth associated protein-43, GAP-43)是一种广泛存在于神经元轴突内的特异性磷酸蛋白,在神经生长发育和再生过程中大量合成[5],通过参与调节生长锥形态而促进轴突生长。国际上将GAP-43作为神经元轴突再生的分子标志,是神经可塑性研究的首选分子探针[6]。本研究观察电针风池穴对脑缺血再灌注大鼠SYN和GAP-43表达变化的影响,探索电针治疗缺血性卒中的作用机制,现报道如下。
1 材料与方法
1.1 实验动物与分组
选用8周龄健康雄性清洁级Spraguer-dawley(SD)大鼠32只,体重240~280 g,由上海中医药大学附属岳阳中西医结合医院实验动物中心提供。所有大鼠均按照清洁级标准饲养,每笼饲养4只,室温控制在22℃~25℃,湿度40%~70%,明暗光照比为12 h:12 h。大鼠可进行自由饮水,每日每只饮食20 g。按照随机、对照原则,采用完全随机实验设计方法,运用SPSS 19.0软件将大鼠随机分为正常组、假手术组、模型组和电针组,每组8只。实验周期为7 d。
1.2 主要仪器与试剂
ECLIPSE TI-SR倒置荧光显微镜(日本尼康株式会社);华佗牌针灸针(0.25 mm×13 mm,苏州医疗用品厂有限公司);G6805-1A电针治疗仪(上海华谊医用仪器厂);RM2016病理切片(上海徕卡仪器有限公司);KD-P组织摊片机(浙江省金华市科迪仪器设备有限公司)。
75%乙醇(杭州欧拓普生物技术有限公司);无水乙醇(国药集团化学试剂有限公司);EDTA抗原修复液(武汉谷歌生物科技有限公司);BSA(A7030,美国Sigma公司);苏木素染液(武汉谷歌生物科技有限公司);一抗(SYN,ab32127,稀释比为1:500,英国Abcam);二抗(HRP-山羊抗兔/鼠二抗,K5007,丹麦DAKO公司);组化试剂盒DAB显色剂(K5007,丹麦DAKO公司)。
1.3 模型制备
实验大鼠饲养7 d以适应环境。术前大鼠禁食12 h,室温保持在25℃,用水合氯醛(0.3 mL/100 g)腹腔注射麻醉。参考Longa EZ等[7]报道的线栓法大脑中动脉闭塞模型(middle cerebral artery occlusion, MCAO)进行造模。手术完成后,将大鼠置于室内温度保持在25℃环境中苏醒。
正常组不做任何处理;假手术组大鼠用水合氯醛(0.3 mL/100 g)腹腔注射麻醉后分离出右侧颈总动脉、颈外动脉和颈内动脉,然后缝合。
1.4 神经功能缺损评分
采用Bederson评分法,时间点选择造模前、造模后2 h及造模后6 d。具体方法为,提鼠尾离开地面约50 cm,观察前肢屈曲情况,如双前肢对称伸向地面,记为0分;如手术对侧前肢出现肩或(和)肘内收屈曲,肩关节内旋,或者肩肘关节屈曲同时伴有内旋者,记为1分。将大鼠放在光滑平面上,手推双肩分别向另一侧移动,检测两侧侧推阻力并对比,如两侧侧推阻力对等且有力记为0分;若向脑损伤对侧推动时阻力下降者,记为1分。将大鼠两前肢放于金属网上,观察对比两前肢的肌张力大小,两前肢肌张力近似相等且力量充足者为0分;如脑损伤对侧前肢肌张力下降,记为1分。将大鼠提尾距离平面约50 cm高度,若大鼠有不停地向脑损伤对侧一个方向旋转者,记为1分。满分为4分,分数越高表示大鼠行为障碍越严重[8-9]。
1.4.1 纳入标准
动物苏醒后,运用Bederson改进评分法对所有大鼠进行评分,2~4分为有效模型。
1.4.2 排除标准
①动物死亡;②神经缺损评分<2分;③术后1 d大鼠体重快速下降到200 g以下。
1.5 干预方法
在术后1 d即对电针组实验大鼠进行电针治疗[10]。取双侧风池穴。常规消毒后,采用0.25 mm×13 mm毫针直刺3 mm,然后将针柄分别连接至电针仪,采用疏密波,频率为2~10 Hz,电流强度为1~3 mA,电压为3~5 V,强度以大鼠双耳稍稍颤动为度,治疗时间30 min。每日1次,均在上午10时左右进行,连续治疗5 d。治疗完毕将大鼠放入笼内。
假手术组和模型组不治疗;模型组和电针组大鼠每只单独饲养,并予以高能量饮食。
1.6 标本采集
分别于动物造模脑缺血6 d后,采用10%用水合氯醛(0.3 mL/100 g)麻醉大鼠,打开胸腔迅速暴露心脏,经左心室生理盐水灌洗后,再行4%多聚甲醛磷酸盐缓冲液灌注固定,后于冰上迅速小心断头取脑,在视交叉后切开,冠状切取2 mm厚包含皮质梗死灶区域;距离大脑皮质后缘向前约5 mm位置,钝性剥离皮质,暴露并取缺血侧海马,冠状切取2 mm厚组织;将所取组织置于4%多聚甲醛液体中固定,后进行脱水、透明、浸蜡、包埋,将石蜡包埋块切成5mm厚防脱切片,用于免疫组织化学染色。
1.7 免疫组织化学染色
免疫组化染色步骤如下,石蜡切片常规脱蜡脱水;柠檬酸抗原修复15 min,后PBS液(pH值为7.4)洗涤3×5 min;放入3%过氧化氢溶液室温避光孵育25 min, PBS液(pH值7.4)洗涤3×5 min;滴加3%BSA封闭 30 min;滴加一抗覆盖组织(用3%BSA按一定比例稀释),湿盒内4℃孵育过夜,PBS液(pH值7.4)洗涤3×5 min;滴加二抗(HRP标记)覆盖组织(与一抗相应种属),室温孵育50 min,PBS液(pH值7.4)洗涤3×5 min;滴加新鲜配制的DAB显色液,显微镜下控制显色时间(阳性为棕黄色),自来水冲洗切片终止显色;Harris苏木素复染约3 min,自来水冲洗;1%盐酸乙醇分化数秒,自来水冲洗;氨水返蓝,流水冲洗;常规脱水,晾干,中性树胶封片;在通风厨中放置1~2 h晾干,显微镜下观察、分析。
1.8 图像分析和统计学方法
确定SYN、GAP-43免疫反应产物的分布。标记强度用光密度值(OD值)表示。采用Eclipse Ti-SR光学显微镜观察SYN及GAP-43切片,采用Image pro-plus 6.0图像分析软件分析大鼠大脑右侧皮质病灶区及海马区组化图片,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD)。所有数据采用SPSS18.0软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用检验。以<0.05表示差异具有统计学意义。
2 结果
2.1 各组造模后6 d不同部位SYN IOD值比较
免疫组化染色显示,SYN阳性物质主要见于梗死区域周围大脑皮质和海马神经元胞浆、突起及纤维束中,呈棕褐色颗粒状或点状(见图1、图2)。
由表1可见,模型组和电针组造模后6 d海马和皮层SYN IOD值与正常组和假手术组比较,差异均具有统计学意义(<0.05)。电针组造模后6 d海马和皮层SYN IOD值与模型组比较,差异均具有统计学意义(<0.05)。
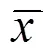
表1 各组造模后6 d不同部位SYN IOD值比较 (±s)
注:与正常组比较1)<0.05;与假手术组比较2)<0.05; 与模型组比较3)<0.05
2.2 各组造模后6 d不同部位GAP-43 IOD值比较
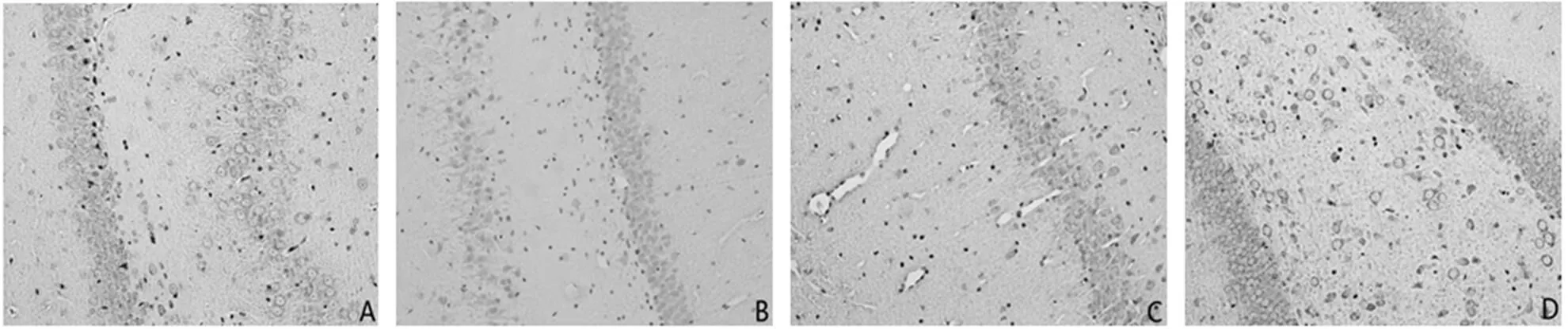
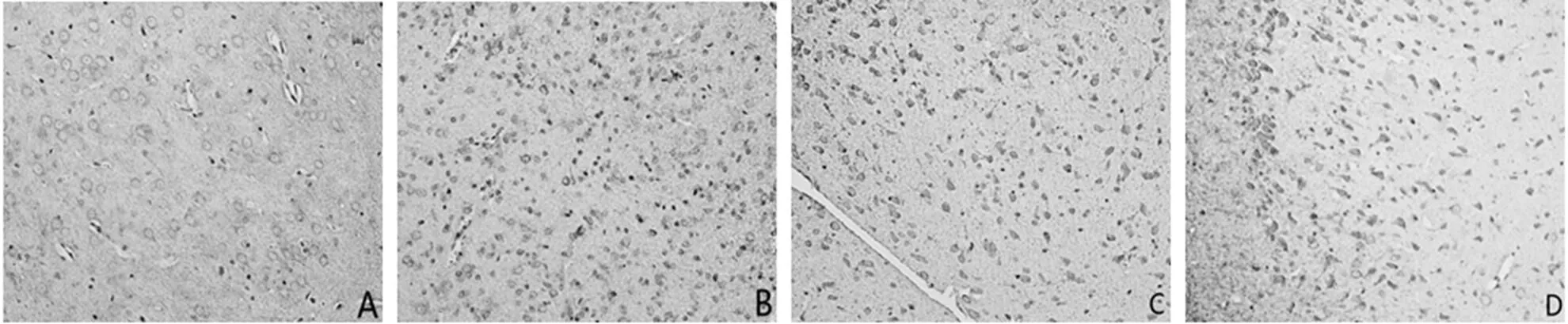
梗死周围皮质区域和海马均有GAP-43的表达(见图3、图4)。
由表2可见,模型组和电针组造模后6 d海马和皮层GAP-43 IOD值与正常组和假手术组比较,差异均具有统计学意义(<0.05)。电针组造模后6 d海马和皮层GAP-43 IOD值与模型组比较,差异均具有统计学意义(<0.05)。
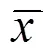
表2 各组造模后6 d不同部位GAP-43 IOD值比较(±s)
注:与正常组比较1)<0.05;与假手术组比较2)<0.05; 与模型组比较3)<0.05
注:A为正常组,B为假手术组,C为模型组,D为电针组
注:A为正常组,B为假手术组,C为模型组,D为电针组

注:A为正常组,B为假手术组,C为模型组,D为电针组
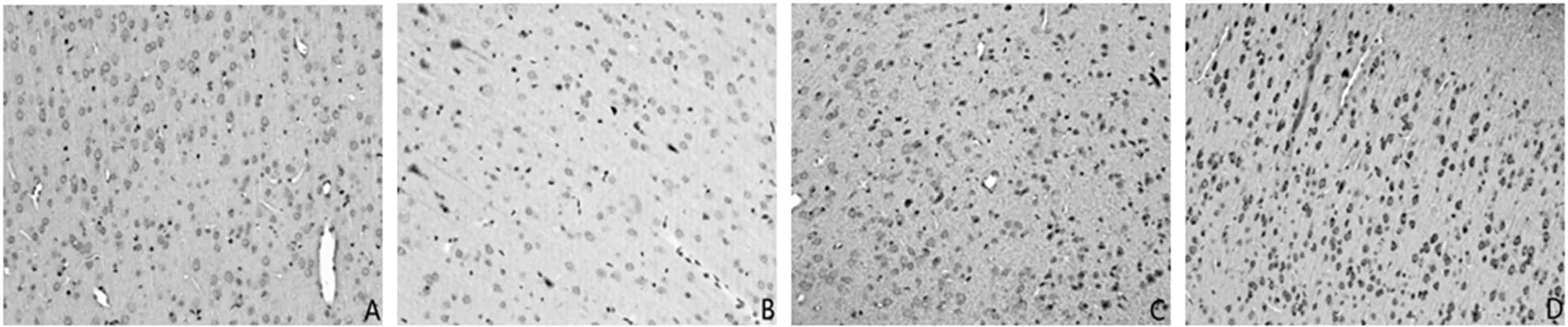
注:A为正常组,B为假手术组,C为模型组,D为电针组
2.3 各组不同时间点Bederson评分比较
由表3可见,模型组和电针组造模后2 h Bederson评分较正常组和假手术组明显上升,差异均有统计学意义(<0.05);模型组和电针组造模后6 d Bederson评分均有下降,与正常组和假手术组比较,差异均具有统计学意义(<0.05)。电针组造模后2 h和造模后6 d Bederson评分与模型组比较,差异均无统计学意义 (>0.05)。
表3 各组不同时间点Bederson评分比较 (±s,分)
注:与正常组比较1)<0.05;与假手术组比较2)<0.05
3 讨论
突触可塑性是指突触在形态和功能上的改变,是神经系统生长发育损伤修复及学习记忆等活动的神经生物学基础,在卒中后神经功能改善中具有重要作用[11]。本研究所采用的Bederson评分是评估动物脑缺血损伤侧肢体的感觉、运动、反射功能的一种神经功能评估方法,主要评估前肢屈曲情况、前肢肌张力、术侧与手术对侧肌力及转圈行为。线栓法是制作MCAO/R动物模型的常用方法,通过闭塞实验动物大脑中动脉,并于90 min后抽离线栓实现脑组织再灌注,造成大脑中动脉所支配区域脑组织的永久性损伤,故MCAO模型大鼠造模后表现为永久性肢体运动功能障碍。实验中观察到造模后6 d模型组、电针组大鼠神经功能缺损评分均有所降低,但仍高于正常组和假手术组,大鼠肢体仍存在上肢屈曲、转圈行为等神经功能缺损表现,提示实验动物肢体功能难以恢复至损伤前水平。电针组和模型组的评分较造模术后2 h有明显减轻的趋势,提示造模大鼠存在自我修复能力,而模型组和电针组组间比较无显著差异,但电针组Bederson评分仍较造模术后2 h有降低的趋势。这可能与神经功能缺损评分能够宏观评估神经功能,但难以实现相对精细定量评估神经功能相关。
SYN是一种与突触结构和功能均有密切联系的磷酸蛋白,其主要存在于神经元突触前囊泡,在突触囊泡的转运、导入及递质的释放中发挥重要作用,是突触小泡特异性蛋白[12-15]。因此,通过检测SYN的密度和分布可间接评估突触数量的多寡和分布特点,是公认的神经可塑性的主要标记物[16-19]。Stroemer RP等[20]发现脑缺血损伤后,随着时间的推移,模型动物术侧相应皮质区域SYN的表达增加,且神经行为功能的改善与SYN的表达水平呈正相关。本研究结果显示,脑缺血再灌注后6 d,缺血组、电针组SYN表达相较对照组和假手术组显著变小。这可能是脑缺血后损伤了突触结构,导致突触前囊泡内的SYN低水平,这与既往研究结果相一致[21]。电针组梗死周围皮质区域和海马SYN的表达明显高于模型组,提示电针风池穴可促进SYN的表达,说明电针可以促进脑缺血性损伤区神经末梢突触的形成和重构。电针改善神经功能的作用可能经由此机制发挥,此结果也与既往的研究相一致[22-25]。
GAP-43是一种广泛存在于神经元轴突内的特异性磷酸蛋白,成年后,GAP-43的表达在大部分脑区处于较低水平或不表达,在神经系统发育过程中或神经损伤后,往往出现GAP-43在基因和蛋白水平的表达或上调,与神经可塑性密切相关[26-29]。国际上将GAP-43作为神经元轴突再生的分子标志,是神经可塑性研究的首选分子探针[30]。既往研究证实,神经组织受到损伤、缺血等情况下,机体自身可诱导生长相关蛋白表达。当脑组织损伤时,诱发损伤区域GAP-43水平升高,激活神经纤维发芽、突触重建等一系列神经再生过程,随着损伤修复时间的延长,GAP-43表达逐步回落,直至再生完成[31]。石旺清等[32]发现大鼠脑缺血再灌注后3 d缺血区周边组织神经元凋亡达到高峰,GAP-43表达增强,7 d达到高峰,以后逐渐减弱。有研究发现,电针可增加GAP-43的表达[33]。卿鹏等[34]发现电针结合康复训练能促进大鼠神经功能的恢复及海马CA3区GAP-43的表达,而在针刺方法上,双侧电针法较患侧电针法能更好地促进局灶性脑缺血再灌注损伤大鼠的中枢神经系统功能重塑。刘斐雯等[35]进一步证实,MCAO/R大鼠在电针干预后海马区GAP-43的表达显著增加。本研究结果显示,电针组与模型组比较,GAP-43表达明显增强,提示电针风池穴可促进脑缺血损伤后的神经元轴突再生。
本研究选用的风池穴属足少阳胆经穴,为手少阳经、足少阳经、阳维脉之会,该穴位于头部两侧,依据“腧穴所在,主治所在”,故可以治疗脑血管疾病。干预方法选用电针刺激,相对于单纯针刺,刺激参数易于设定,刺激量可实现定量控制,维持刺激的一致性,且方便操作[36]。近年来,关于风池穴对中风的治疗作用已经得到证实。张晨茜等[37]研究发现以风池、风府为主配合常规针刺治疗缺血性中风有较好的治疗作用。徐佳等[38]发现电针双侧风池穴可逆转大鼠大脑缺血侧诱发电位中Nl波的振幅降低。秦彦强等[39]发现电针风池穴预处理可提高MCAO模型大鼠缺血性耐受,提高大鼠运动、平衡、学习及记忆能力。
综上所述,单纯电针刺激双侧风池穴可显著上调GAP-43和SYN的表达水平,表明电针双侧风池穴对神经元功能有一定的调节作用,在一定程度上可诱导局灶性缺血再灌注大鼠模型的神经轴突再生和突触功能与结构的重构,有利于神经元的再生,从而促进肢体功能的改善。然其是否与多穴刺激具有等同效应,还需要以后的进一步研究。
[1] 孙海欣,王文志.中国60万人群脑血管病流行病学抽样调查报告[J].中国现代神经疾病杂志,2018,18(2): 83-88.
[2] 宋宛珊,郭威,张玉莲,等.突触可塑性相关物质基础研究进展[J].中国老年学杂志,2015,35(17):5039- 5042.
[3] Gispen WH. Neuronal plasticity and function[J]., 1993,16(Suppl 1):S5-S11.
[4] 郭敏,李刚.突触可塑性相关蛋白的研究进展[J].神经药理学报,2013,3(6):57-64.
[5] Coggins PJ, Zwiers H. B-50 (GAP-43): biochemistry and functional neurochemistry of a neuron-specific phosphoprotein[J]., 1991,56(4):1095- 1106.
[6] Udvadia AJ, Köster RW, Skene JH. GAP-43 promoter elements in transgenic zebrafish reveal a difference in signals for axon growth during CNS development and regeneration[J].,2001,128(7):1175-1182.
[7] Longa EZ, Weinstein PR, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats[J]., 1989,20(1):84-91.
[8] Bederson JB, Pitts LH, Tsuji M,. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]., 1986,17(3):472-476.
[9] 詹剑,李小琼,郝仁方.金钗石斛多糖对局灶性脑缺血-再灌注大鼠的作用[J].中国脑血管病杂志,2017,14 (1):25-31.
[10] 徐鸣曙,葛林宝,徐佳,等.电针对脑缺血再灌注大鼠纹状体内单胺类递质更新率的影响[J].上海针灸杂志, 2009,28(4):239-242.
[11] Hasan A, Nitsche MA, Rein B,. Dysfunctional long-term potentiation-like plasticity in schizophrenia revealed by transcranial direct current stimulation[J]., 2011,224(1):15-22.
[12] Maeda I, Tajima S, Ariizumi Y,.Can synaptophysin be used as a marker of breast cancer diagnosed by core-needle biopsy in epithelial proliferative diseases of the breast?[J]., 2016,66(7):369-375.
[13] Yadav L, Babu MK, Das K,.Role of synaptophysin in the intraoperative assessment of quadrantic innervation of the proximal doughnut in Hirschsprung disease[J]., 2017,30(4):187-192.
[14] Griva M, Lagoudaki R, Touloumi O,.Long-term effects of enriched environment following neonatal hypoxia-ischemia on behavior, BDNF and synaptophysin levels in rat hippocampus: Effect of combined treatment with G-CSF[J]., 2017,1667:55-67.
[15] Xiao Z, Peng J, Wu L,.The effect of IL-1β on synaptophysin expression and electrophysiology of hippo campal neurons through the PI3K/Akt/mTOR signaling pathway in a rat model of mesial temporal lobe epilepsy[J]., 2017,39(7):640-648.
[16] Chen YY, Zhang L, Shi DL,.Resveratrol Attenuates Subacute Systemic Inflammation-Induced Spatial Memory Impairment via Inhibition of Astrocyte Activation and Enhancement of Synaptophysin Expression in the Hippocampus[J]., 2017,47(1):17-24.
[17] Matsukuma K, Olson KA, Gui D,.Synaptophysin- Ki67 double stain: a novel technique that improves interobserver agreement in the grading of well- differentiated gastrointestinal neuroendocrine tumors[J]., 2017,30(4):620-629.
[18] Tudoraşcu DR, Pirici D, Târtea EA,.Synaptophysin expression as prognostic factor for survival in colorectal carcinomas[J]., 2017,58(4): 1409-1415.
[19] 朱旭红,张萍淑,程赞赞,等.突触可塑性相关蛋白及其与临床疾病的关系[J].华北理工大学学报(医学版), 2017,19(3):237-241.
[20] Stroemer RP, Kent TA, Hulsebosch CE. Neocortical neural sprouting, synaptogenesis, and behavioral recovery after neocortical infarction in rats[J]., 1995,26(11):2135-2144.
[21] Madinier A, Bertrand N, Mossiat C,. Microglial involvement in neuroplastic changes following focal brain ischemia in rats[J]., 2013,4(12): e8101.
[22] Yi W, Xu NG, Wang GB. Experimental study on effects of electro-acupuncture in improving synaptic plasticity in focal cerebral ischemia rats[J]., 2006,26(8):710-714.
[23] Xia WG, Zheng CJ, Zhang X,. Effects of "nourishing liver and kidney" acupuncture therapy on expression of brain derived neurotrophic factor and synaptophysin after cerebral ischemia reperfusion in rats[J]., 2017,37(2):271-278.
[24] 陈鹏,张大雁,吴思苇,等.电针结合天麻素增加局灶性脑缺血大鼠额叶皮质生长相关蛋白-43以及突触素的免疫组化表达[J].医学理论与实践,2017,30(1):1-3.
[25] 赵嘉培,黄丹霞,黄赛娥,等.电针“曲池”和“足三里”对脑缺血大鼠皮质突触素、脑源性神经营养因子表达的影响[J].中国动脉硬化杂志,2017,25(11):1099- 1106.
[26] Coggins PJ, Zwiers H. B-50 (GAP-43): biochemistry and functional neurochemistry of a neuron-specific phosphor- protein[J]., 1991,56(4):1095-1106.
[27] Zhu X, Wang P, Liu H,.Changes and Significance of SYP and GAP-43 Expression in the Hippocampus of CIH Rats[J]., 2019,16(3):394-402.
[28] Martins CW, de Melo Rodrigues LC, Nitsche MA,. AMPA receptors are involved in prefrontal direct current stimulation effects on long-term working memory and GAP-43 expression[J]., 2019,362: 208-212.
[29] Nemes AD, Ayasoufi K, Ying Z,.Growth Associated Protein 43 (GAP-43) as a Novel Target for the Diagnosis, Treatment and Prevention of Epileptogenesis[J]., 2017,7(1):17702.
[30] Han XF, Zhang Y, Xiong LL,. Erratum to: Lentiviral-Mediated Netrin-1 Overexpression Improves Motor and Sensory Functions in SCT Rats Associated with SYP and GAP-43 Expressions[J]., 2017,54(3):1698.
[31] Gorup D, Bohaček I, Miličević T,. Increased expression and colocalization of GAP43 and CASP3 after brain ischemic lesion in mouse[J]., 2015,597:176-182.
[32] 石旺清,郑关毅,陈晓东,等.大鼠脑缺血/再灌注后bFGF和GAP-43的表达与神经再生[J].中国应用生理学杂志,2013,29(1):63-67.
[33] 张鹏飞,徐成成,李文磊,等.电针对局灶性脑缺血大鼠10号染色体同源丢失性磷酸酶张力蛋白和神经生长相关蛋白-43表达的影响[J].中国康复理论与实践, 2015,21(1):35-38.
[34] 卿鹏,柴铁劬,丁红梅,等.双侧电针结合康复训练对局灶性脑缺血/再灌注损伤大鼠海马CA3区神经生长相关蛋白43及突触素表达的影响[J].针刺研究,2016, 41(4):314-320.
[35] 刘斐雯,俞坤强,彭洪卫,等.电针百会、神庭穴对局灶性脑缺血再灌注大鼠学习记忆能力及海马区GAP-43蛋白表达的影响[J].中国中医急症,2016,25(2):189- 192,207.
[36] 周元成,吴新贵,肖贻财.电针刺激“足三里”和“内关”对脑梗死大鼠GAP-43表达的影响[J].中国针灸,2011, 31(1):55-59.
[37] 张晨茜,储浩然,程红亮,等.针刺风池、风府穴对缺血性脑卒中患者血浆内皮素的影响[J].上海针灸杂志, 2012,31(1):15-17.
[38] 徐佳,徐鸣曙.电针对大鼠脑缺血-再灌注过程中体感诱发电位P1-N1、N1-P2峰峰值变化的影响[J].上海针灸杂志,2010,29(8):542-545.
[39] 秦彦强,孙忠人,魏庆双,等.针刺风池穴预处理对脑梗死大鼠的缺血耐受现象研究[J].针灸临床杂志,2015, 31(9):65-68.
Effect of Electroacupuncture at Fengchi (GB20) on Synaptophysin and Growth Associated Protein-43 in Rats with Ischemia/Reperfusion Injury
1,-2,-2,3,-4,5.
1.,201508,; 2.,200030,; 3.,200030,; 4.,200437,; 5.,201203,
To study the effect of electroacupuncture at Fengchi (GB20) on the expressions of synaptophysin (SYN) and growth associated protein-43 (GAP-43)in rats with ischemia/reperfusion (I/R) injuryThirty-two male Sprague-Dawley (SD) rats were randomized into normal, sham operation, model and electroacupuncture groups, with 8 rats in each group. The middle cerebral artery occlusion (MCAO) rat model was generated by thread embolization in the model and electroacupuncture groups. The electroacupuncture group received electroacupuncture at bilateral Fengchi (GB20), once a day, 30 min each time, until the rats were executed. The expressions of SYN and GAP-43 were examined by immunohistochemistry method.The Bederson scores 2 hours and 6 days after modeling in the model and electroacupuncture groups were significantly different from those in the normal and sham operation groups (<0.05). The integrated optical density (IOD) values of SYN and GAP-43 in hippocampus and cortex 6 days after modeling in the model and electroacupuncture groups were significantly different from those in the normal and sham operation groups (<0.05). The IOD values of SYN and GAP-43 in hippocampus and cortex 6 days after modeling in the electroacupuncture group were significantly different from those in the model group (<0.05).Electroacupuncture at Fengchi (GB20) can promote the expressions of SYN and GAP-43 in rats with I/R injury, which suggests that electroacupuncture can promote axon regeneration and improve synaptic plasticity.
Acupuncture therapy; Electroacupuncture; Acupoint, Fengchi (GB20); Cerebral ischemia; Ischemia and reperfusion injury; Synaptophysin; Growth associated protein-43; Rats
R2-03
A
10.13460/j.issn.1005-0957.2019.13.0071
1005-0957(2019)13-0071-07
2018-12-03
上海市卫生和计划生育委员会科研课题(201640128);上海市自然科学基金项目(17ZR1427500)
韩清(1981—),男,住院医师,硕士,Email:dada1981xiaoxiao@163.com
徐鸣曙(1978—),男,副研究员,博士,Email:mingshuxu@163.com

