毛细管电泳法分离5种β受体阻滞剂
赵凌国1 尹江伟1 钟伟燕1 李红华1 吴洲铭 杨灵芝
(1.深圳市宝安区疾病预防控制中心,深圳 518100;2.深圳大学药学院,深圳 518060)
β受体阻滞剂(Beta Blockers, BBs)是降低心力衰竭患者发病率和死亡率的一类重要心血管药物,可竞争性与β受体结合而产生拮抗β激动剂的效应,包括对心脏兴奋的抑制作用和对支气管及血管平滑肌的舒张作用等。在临床上,β受体阻滞剂广泛应用于多种疾病,包括高血压、急性心肌梗死、充血性心力衰竭、原发性震颤、偏头痛、青光眼和控制焦虑发作情况下的急性恐慌症状等[1,2]。不同构型β受体阻滞剂可以具有不同的药效学和立体选择性作用机理,在药代动力学、药理作用和毒性方面存在差异[3-6],部分药物药效作用可相差百倍[7],甚至一种具有活性,另外一种对映体完全无活性或具有副作用[8-11]。目前临床上使用的β受体阻滞剂绝大多数为外消旋体,因此,β受体阻滞剂药物的手性分离研究,有利于药物动力学、药效学研究和药物质量控制,对开发药效更高、副作用更小的药物具有重要的意义。
在众多手性拆分方法中,毛细管电泳法(CE)具有高效、快速、分离模式和手性选择剂种类多、低成本、样品用量少、低污染特点,并可通过在缓冲液中直接添加手性选择剂来实现拆分目的,被认为是分离对映异构体最有效的技术之一。β-环糊精(β-CD)被用作CE手性试剂分离了美托洛尔对映体[12]和普萘洛尔对映体[13]。2-甲基-β-CD被用作手性试剂分离了卡维地洛对映体[14]。羟丙基β-CD被用作手性试剂分离了4种β受体阻滞剂及类似物[15]。磺酸化-β-环糊精被用作手性试剂分离了5 种β受体阻滞剂。6-磺化-β-环糊精和heptakis (2,3-diacetyl-6-sulfato)-β-CD等带负电荷的衍生化环糊精对β-受体阻滞剂表现出良好的手性识别能力[16,17]。羧甲基β-CD(CM-β-CD)也被单独用作手性试剂分离β-受体阻滞剂[18-20],或者与其它环糊精或离子液体组成双手性拆分试剂分离β-受体阻滞剂[21-24]。本研究以羧甲基-β-环糊精(CM-β-CD)为手性试剂,成功拆分5种β受体阻滞剂,并以普萘洛尔为分离对象,系统探讨了相关分离机制及影响因素,相比于部分文献使用低pH值[21-23]和高的环糊精浓度(0.9%~1.8%)[20-23],本研究在较宽的pH和电压范围内,添加少量CM-β-CD,获得了优于文献报道的分离度以及基线平稳的手性分离效果[12-15, 17,18, 20-23],并在此基础上发现普萘洛尔对映体的分离度和分析时间与CM-β-CD浓度存在线性关系,此前未见报道。
1 实验部分
1.1 仪器与试剂
SCIEX P/ACETMMDQ PLUS毛细管电泳仪(AB Sciex,Fullerton,CA,USA),配备二极管阵列检测器、32 Karat 10.2工作站;熔融石英毛细管(河北永年光纤厂),内径75 μm,外径365 μm,有效长度40 cm,总长50 cm;无水甲醇和氢氧化钠购自天津市大茂化学试剂厂;无水磷酸氢二钠、无水磷酸二氢钠、冰乙酸、无水乙酸钠、无水柠檬酸和二水合柠檬酸三钠均购自国药集团化学试剂有限公司;羧甲基-β-环糊精购自山东滨州智源生物科技有限公司(2,6位不定位取代度6.879);(±)-盐酸普萘洛尔、(S)-(-)-普萘洛尔盐酸盐、(R)-(+)-普萘洛尔盐酸盐、(±)-酒石酸美托洛尔、阿替洛尔、倍他洛尔、卡拉洛尔购自上海阿拉丁生化科技股份有限公司。
1.2 缓冲液及样品制备
缓冲液配置方法如下: 分别配制pH 5.5、6.5、7.5和8.5的磷酸盐缓冲液(磷酸根浓度为5 mM),以及10 mM、20 mM、40 mM的磷酸盐缓冲液(pH5.5)。配制pH 5.5的乙酸-乙酸钠缓冲液(乙酸根浓度5 mM)及柠檬酸-柠檬酸钠缓冲液(柠檬酸根浓度5 mM)。将羧甲基-β-环糊精用对应的缓冲液溶解,分别配制为0.05%、0.1%、0.2%、0.4%、0.8%(m/v)的运行缓冲液(临用现配)。无水甲醇溶解β受体阻滞剂,配成1mg/mL的储备液,临用时,用对应缓冲液配置成0.1 mg/mL的标准品溶液。
1.3 毛细管电泳分析方法的建立
毛细管电泳分析条件如下:20 psi压力下,用水、0.1 mol/L NaOH、水、运行缓冲液冲洗毛细管各5 min,样品在0.5 psi压力下进样5s,柱温为20℃,检测波长普萘洛尔为235nm,美托洛尔为224nm,阿替洛尔为225nm,倍他洛尔为225nm,卡拉洛尔为235nm。
2 结果与讨论
2.1 CM-β-CD浓度对手性分离的影响
研究首先考察手性选择剂CM-β-CD浓度对普萘洛尔拆分效果的影响,结果如图1所示。在0.05%~0.8%范围内,普萘洛尔对映体的分离度Rs和分析时间t随CM-β-CD浓度增加呈线性增长(相关系数r均为0.988)。这主要是由于在pH5.5时,CM-β-CD带负电荷,其电迁移方向与电渗流EOF相反(图2),当带正电的普萘洛尔对映体与CM-β-CD相互作用时(静电作用力、疏水作用能以及包合作用),会降低对映体的表观迁移速率,从而增加迁移时间。同时,随着CM-β-CD浓度的增加,对映体与CM-β-CD结合的概率提高,由于R和S对映体与CM-β-CD的包合作用存在差异,结合概率的升高导致对映体分子间的淌度之差更加显著,分离度增加。研究发现,有文献报道对映体分离度和分析时间随CM-β-CD浓度增加而增大的现象[19-21],但文献未作进一步探讨。本研究首次明确指出低浓度下,普萘洛尔对映体分离度和分析时间与CM-β-CD浓度的线性关系。
根据Wren等[25]提出的理论模型,在CE手性分离中,对映体分子间的淌度之差是手性选择剂浓度的函数,存在一个最大值。但高浓度下,Rs增加缓慢[19],且电流过大,峰展宽,基线不稳[20,21],并考虑到在0.8%CM-β-CD浓度时,分析时间已接近1小时,高浓度CM-β-CD不具备分析速度优势,未作继续探讨。

图1 CM-β-CD浓度对普萘洛尔对映体分离的影响.电压: +25 kV; 缓冲液:5mM 磷酸盐缓冲液(pH5.5)
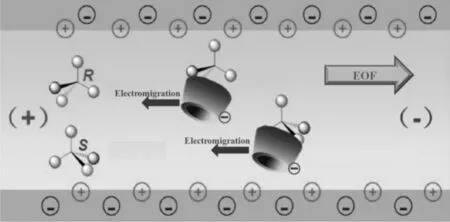
图2 CM-β-CD分离普萘洛尔对映体机制示意图
2.2 pH值对手性分离的影响
考察pH值对普萘洛尔对映体拆分效果的影响,结果如图3所示。随pH值增加,对映体分析速度加快,柱效增加,但选择因子和分离度下降。这是因为缓冲液pH值会影响毛细管内壁硅羟基解离,从而影响电渗流。随pH值增加,EOF增大,分析时间缩短,对映体分子朝不同方向纵向扩散时间缩短导致柱效增加。此外,分析时间缩短会导致对映体与CM-β-CD相互作用时间减少,对映体表观趟度差异减少,选择因子和分离度下降。同时相互作用的减少相当于降低了传质阻力,柱效升高,即所谓的缩短分析时间,有利于提高柱效,但不利于分离,反之亦然。因此,实验可以调节pH值,操控电渗流,在满足分离度的情况下,以加快分析速度。缓冲液pH值除了影响电渗流,还可能会影响手性选择剂和对映体的荷电状态,但由于羧甲基的pKa约为4,在pH5.5~8.5的范围内,CM-β-CD分子几乎全部去质子化而带负电荷。同样普萘洛尔的pKa约为9.4,在pH5.5~8.5的范围内始终带正电荷。因此,在本研究中不考虑pH值对手性选择剂和对映体荷电状态的影响。

图3 pH值对普萘洛尔分离的影响电压: +25 kV; 缓冲液: 5mM磷酸盐缓冲液; CM-β-CD浓度: 0.2%.
2.3 电压对手性分离的影响
毛细管电泳具有高柱效的重要原因是内径小,散热快,从而可使用高电场强度。从图4可以看到,和调节pH值一样,增大电压同样可以加大电渗流,从而产生相似的分离效果,即分析时间缩短,柱效增加,选择因子和分离度下降。值得注意的是,增大电压同样会提高CM-β-CD朝阳极的电迁移速度(图2),但是通常情况下,相比于电渗流,电迁移的速率相差一个数量级,本研究中电迁移速率的变化对电泳趟度的影响可以忽略。此外,电压并非越高越好,从图4可以看出,当电压达到25kV时,体系内产生焦耳热已经不能忽略,导致柱效下降。

图4 电压对普萘洛尔对映体分离的影响缓冲液: 5mM磷酸盐缓冲液(pH5.5); CM-β-CD浓度: 0.2%.
2.4 缓冲液种类对手性分离的影响
考察缓冲液种类对普萘洛尔对映体拆分效果的影响,结果如图5所示。磷酸盐缓冲液中,对映体具有最大的分离度,但柱效最低,分析时间最长。乙酸盐缓冲液具有最高的柱效,而柠檬酸盐缓冲液具有最快的分析速度,但分离度最差,实验结果显示缓冲液种类对普萘洛尔手性分离具有明显的影响,是值得考虑的优化条件之一。

图5 缓冲液种类对普萘洛尔对映体分离的影响 电压:+25 kV; 缓冲液pH: 5.5; CM-β-CD浓度: 0.2%.
2.5 其他4种β肾上腺素受体阻滞剂的分离
β-CD具有疏水内腔,手性化合物的疏水结构可以进入CD内部空腔,同时β-CD还具有多个手性作用位点,能够与手性分子发生三维立体结构的匹配,形成包合络合物。由于对映体构型不同,形成的包合络合物具有不同的稳定性,导致电泳表观趟度存在差异而分离。考虑到β受体阻滞剂是碱性药物,本研究针对性地采用CM-β-CD作为手性选择剂,以便产生静电作用。因为这种较强的远距离静电相互作用,可以促进CM-β-CD和β受体阻滞剂最初始的非立体选择性结合,有利于接下来的近距离定向立体选择性相互作用,如氢键、π-π相互作用以及β-CD手性空腔包合作用等[26]。此外,CM-β-CD电迁移方向与EOF相反,有利于CM-β-CD和β受体阻滞剂发生相互作用。如图6和表1所示,以CM-β-CD为手性选择剂,本研究成功分离了美托洛尔、阿替洛尔、倍他洛尔和卡拉洛尔对映体,分离度均大于1.5,效果良好。
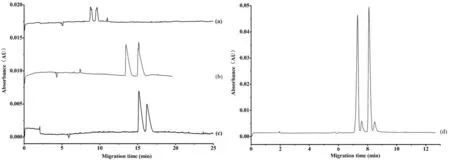
图6 阿替洛尔(a)、美托洛尔(b)、倍他洛尔(c)和卡拉洛尔(d)对映体电泳分离图CM-β-CD浓度: 0.4%;缓冲液: 5 mM磷酸盐缓冲液(pH5.5); 电压: 25 kV
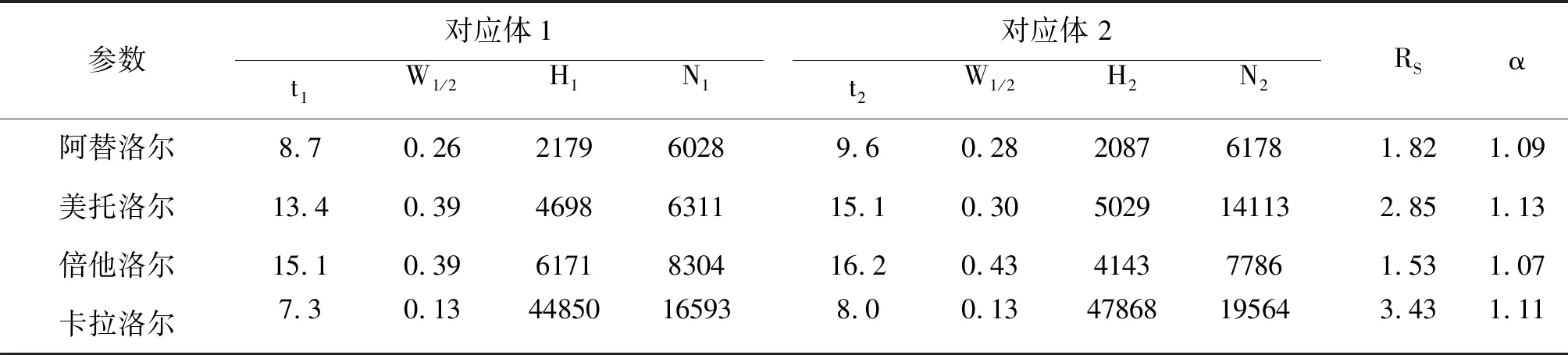
参数对应体1t1W1/2H1N1对应体 2t2W1/2H2N2RSα阿替洛尔8.70.26217960289.60.28208761781.821.09美托洛尔13.40.394698631115.10.305029141132.851.13倍他洛尔15.10.396171830416.20.43414377861.531.07卡拉洛尔7.30.1344850165938.00.1347868195643.431.11
3 结论
鉴于手性药物对映体只表现出旋光性差异,故依靠理化性质的传统分离技术一般难以拆分。本研究以CM-β-CD为手性选择剂,运用毛细管电泳技术成功拆分了5种β受体阻滞剂,并探讨分离过程中涉及的作用机理。本研究在较宽的pH和电压范围内,添加少量CM-β-CD,获得了分离度良好、基线平稳的手性分离效果,完全分离了5种β受体阻滞剂,并发现普萘洛尔对映体的分离度和分析时间与CM-β-CD浓度存在线性关系。本体系采用非强酸环境,电渗流大,分析速度快,普萘洛尔、阿替洛尔和卡拉洛尔均可在10分钟内实现完全分离,美托洛尔和倍他洛尔在20分钟内实现完全分离。本方法快速、高效、灵活方便,对相关手性药物分离研究具有一定的理论和实际参考价值。

