利多卡因辅助麻醉在老年创伤性颈胸段脊髓损伤减压手术的应用
金培程,程正江
当前由于各种因素的影响,我国老年性脊柱疾病发病率越来越高,创伤性颈胸段脊髓损伤患者逐渐增加[1-2]。特别是脊柱病变可造成脊髓和神经根压迫,导致自主神经功能障碍,使患者的生活质量显著下降甚至失能[3-4]。创伤性颈胸段脊髓损伤的病理生理变化比较复杂,多合并自主反射系统异常、呼吸系统异常、心血管功能低下、体温调节紊乱、高钾血症等[5-6]。由于该病的病情发展比较快,患者入院后需要及时开展减压手术,并且在手术过程中要采取积极正确的麻醉处理,保证手术顺利进行与预后改善[7]。特别是颈胸段脊髓损伤对麻醉要求比较高,必须熟悉有关麻醉的病理生理,才能保证手术的顺利进行与安全[8]。纳洛酮能阻滞阿片受体,可干扰β-内啡肽活性,显著增加脑和脊髓的血流量,降低血管阻力,促进其功能恢复[9-10]。氯胺酮可降低脊髓缺血性损伤时Ca2+含量,减轻脊髓组织水肿,降低脊髓损伤发生率[11-12]。利多卡因作为局部麻醉药,具有镇痛和抗炎作用,常用于神经阻滞或椎管内麻醉,能够抑制中性粒细胞的趋化反应[13],对人体脊髓损伤的保护作用未见相关报道。本文探讨了利多卡因辅助局部麻醉在老年创伤性颈胸段脊髓损伤减压手术的应用效果。
临床资料
1 研究对象
回顾性分析2015年2月—2017年12月湖北医药学院附属襄阳市第一人民医院进行诊治的78例创伤性颈胸段脊髓损伤老年患者的临床资料。其中男性42例,女性36例;平均年龄(68.24±3.22)岁;道路交通伤41例,高处坠落伤21例,重物砸伤9例,运动损伤7例。纳入标准:符合创伤性颈胸段脊髓损伤的诊断标准,择期拟全麻下行颈椎手术;医院伦理委员会批准此次研究;患者签署知情同意书;年龄60~75岁,具有手术指征;均有明确的创伤史,均于伤后24h内进行手术治疗。排除标准:合并肿瘤或肿瘤转移等疾病;妊娠与哺乳期妇女;合并其他部位尤其颅脑创伤及感染者;严重贫血或肝肾功能不全或糖尿病及糖耐量异常者;酗酒或者滥用药物倾向者;临床资料缺项者。根据麻醉方法不同分为利多卡因组(利多卡因辅助麻醉)与右美托咪定组(右美托咪定辅助麻醉),各39例。两组患者的骨折部位、伤后手术时间、体重指数、年龄、性别、致伤原因等资料对比差异无统计学意义(P>0.05)。见表1。
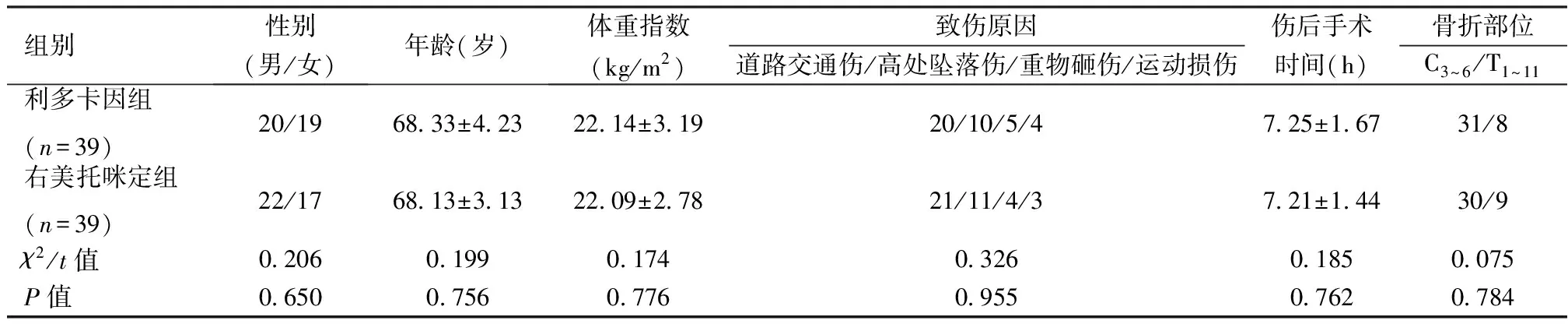
表1 两组基线资料比较
2 治疗与麻醉方法
所有患者给予减压手术治疗,术前常规禁食、禁饮,术前30min肌注盐酸戊已奎醚0.08mg/kg;入室后监测生命体征,开放左上肢静脉,面罩吸氧,桡动脉穿刺,静脉注射依托咪脂0.2mg/kg、咪达唑仑0.05mg/kg、舒芬太尼0.5μg/kg。插管后接麻醉机行机械通气,机械通气参数:潮气量8~10mL/kg,流量2L/min,氧浓度为60%。保持患者头部牵引、头颈中轴位置,双肩向脚部牵拉。
右美托咪定组:给予右美托咪定(国瑞药业,批号:1312031)0.6μg/kg负荷量静注,然后以0.4μg/(kg·h)持续泵注,直至手术结束。
利多卡因组:给予利多卡因(上海朝晖药业,批号:1306J09)1.5mg/kg负荷量静注,然后以2.0mg/(kg·h)持续泵注,直至手术结束。术前5min静注舒芬太尼0.2μg/kg后接自控镇痛泵(配方:舒芬太尼3.0μg/kg、曲马多0.1g/kg、氟哌利多0.02mg/kg),加生理盐水至100mL,2mL/h,锁定时间30min,自控每次1mL。
3 观察指标
(1)所有患者在麻醉前、术后1h进行收缩压、舒张压、心率等生命体征的监测,使用菲利普公司的多功能生命体征监护仪。(2)术后3d进行脊髓神经功能评定,0级:完全瘫痪;Ⅰ级:偶尔可见肌肉轻微收缩;Ⅱ级:肢体只能在床上进行平行移动;Ⅲ级:肢体能抬离床面;Ⅳ级:肢体能做对抗外界阻力的运动。(3)术后3d与术后3个月采用日本骨科协会颈椎评分系统(JOA)对患者的颈椎功能进行评定。(4)术后14d对患者进行问卷调查,以明确其对本次麻醉的满意度,80~100分为非常满意,60~79分为比较满意,<60分为不满意,(非常满意+比较满意)/组内例数×100.0%=满意度。(5)术后1d与术后14d抽取患者的静脉血3~5mL,3 000r/min离心10~15min,取上清液,采用免疫夹心双抗体酶联免疫吸附测定法(ELISA)检测血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)等水平。
4 统计学分析

结 果
1 两组生命体征比较
患者均顺利完成手术与麻醉,围手术期无严重并发症发生。两组患者在麻醉诱导前、术后1h的收缩压、舒张压、心率无显著波动(P>0.05)。见表2。
2 两组脊髓神经功能比较
术后3d利多卡因组中脊髓神经功能0级1例,Ⅰ级2例,Ⅱ级2例,Ⅲ级4例,Ⅳ级30例;右美托咪定组中分别为5、6、8、10例与10例(P<0.05)。见表3。
3 两组JOA评分比较
利多卡因组与右美托咪定组术后3个月的JOA评分均高于术后3d,利多卡因组也高于右美托咪定组(P<0.05)。见表4。
4 两组炎症因子变化比较
两组术后14d的血清TNF-α、IL-6值低于术后1d,利多卡因组低于右美托咪定组(P<0.05)。见表5。
5 两组麻醉满意度比较
术后14d利多卡因组与右美托咪定组的麻醉满意度分别为100.0%和84.6%(P<0.05)。见表6。
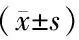
表2 两组麻醉前后生命体征变化情况对比
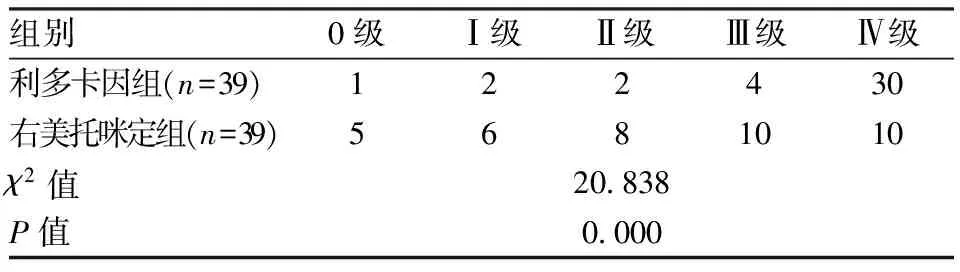
表3 两组术后3d脊髓神经功能比较(n)
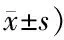
表4 两组术后不同时间点JOA评分比较(分,
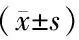
表5 两组术后不同时间点炎症因子变化比较

表6 两组术后14d麻醉满意度比较(n)
讨 论
当前由于各种因素的影响,我国老年创伤性颈胸段脊髓损伤患者逐渐增加[14]。颈胸段脊髓损伤常导致严重的肢体瘫痪,可导致炎症水肿和兴奋性氨基酸释放,诱发血管性水肿的形成[15]。减压手术为创伤性颈胸段脊髓损伤的主要方法,但是手术装置的压迫、手术后的炎症反应等均可导致脊髓的继发性损伤[16]。目前有关预防脊髓继发性损伤的研究主要包括手术和药物,由于神经元细胞损伤后难以再生,当前在临床上多采用麻醉药物预防脊髓损伤。
老年患者麻醉的关键在于最大程度地降低对心肺功能的干扰,尽量减少对患者生理机能的干扰,也要满足手术要求[17]。为此尽可能选用安全范围大、对生理功能影响干扰小的药物,争取用最小的药量达到最佳麻醉效果[18]。利多卡因是一种麻醉及循环常用药,早期应用利多卡因能阻止挫伤脑组织局部血流量的减少,减少急性脑挫伤后白细胞的聚集,改善其局部脑血流量。利多卡因静脉注射用于全身麻醉时有镇痛和抗炎作用,对急性脊髓损有保护作用,可以改善脊髓组织水肿[19]。本研究显示患者均顺利完成手术与麻醉,围手术期无严重并发症发生,两组患者在麻醉诱导前、术后1h的收缩压、舒张压、心率无显著波动(P>0.05),表明利多卡因的应用具有很好的安全性。
老年患者由于骨质疏松且组织发生退行性变性,在经受较轻外力时即可造成颈胸段脊髓损伤,如不及时予以减压则会造成不可逆损伤[20]。不过减压手术后继发性损伤也比较多见,在手术中也需要积极控制脊髓损害的范围。有研究显示利多卡因进入血液循环可导致中枢症状,可使线粒体功能障碍,对脊髓和神经则有毒性作用,从而激活凋亡系统,导致神经元凋亡[21]。但也有研究认为利多卡因静脉应用时具有中枢神经保护作用,利多卡因动脉内灌注可以减轻脊髓再灌注损伤,抑制兴奋性氨基酸神经递质释放,从而抑制自由基的生成[22]。并且利多卡因的安全系数较大,具有较好的抗氧化作用,能够显著抑制氧自由基反应,对抑制继发损害具有重要意义[23]。本研究显示术后3d利多卡因组中脊髓神经功能0级1例,Ⅰ级2例,Ⅱ级2例,Ⅲ级4例,Ⅳ级30例;右美托咪定组中分别为5、6、8、10例与10例(P<0.05);利多卡因组与右美托咪定组术后3个月的JOA评分均高于术后3d,利多卡因组也高于右美托咪定组(P<0.05),表明利多卡因的应用能促进保护脊髓神经功能与改善颈椎功能。当前研究也表明利多卡因可降低儿茶酚胺的浓度,对细胞膜钠通道有阻滞作用,减轻自由基对脊髓的继发损害[24]。
脊髓损伤可影响短暂和剧烈的交感神经异常,从而导致严重高血压、心律失常等,为此对于麻醉的要求比较高[25]。本研究显示术后14d利多卡因组与右美托咪定组的麻醉满意度分别为100.0%和84.6%(P<0.05)。同时老年患者循环系统代偿能力差,麻醉管理中需特别注意并发症的防治。术前充分了解患者的生命体征,了解心肝肾等重要脏器的功能,充分扩容,积极纠正电解质紊乱,选择对脊髓血流灌注和血流动力学影响较小的麻醉药物[26]。
脊髓损伤时,星形胶质细胞合成分泌多种炎症因子,可参与神经元的再生分化[27]。TNF-α是由单核细胞/巨噬细胞分泌的一种重要炎症介质,可参与机体的免疫病理损伤,也是机体免疫防护的重要介质[28]。IL-6是由单核巨噬细胞、淋巴细胞、血管内皮细胞等多种细胞产生的糖蛋白,是机体重要的促炎细胞因子,具有广泛的免疫调节作用,可参与代谢、再生、神经通路重建等过程[29-30]。当前研究表明血清TNF-α、IL-6水平在脊髓损伤后1d快速升至高峰,然后逐渐下降,升高程度与脊髓损伤程度有关[31]。本研究显示两组术后14d的血清TNF-α、IL-6值低于术后1d,利多卡因组低于右美托咪定组(P<0.05)。利多卡因具有抗炎作用,其可通过抑制趋化因子诱导的白细胞迁移而抑制白细胞聚集,该药物还可通过抑制炎症反应保护脊髓神经元功能[32-33]。不过本研究也存在一定的不足,缺乏动物模型分析,本研究所选取的利多卡因剂量是根据临床常用剂量范围,不同剂量的作用效果也有待进一步分析。
总之,利多卡因辅助局部麻醉在老年创伤性颈胸段脊髓损伤减压手术的应用具有很好的安全性,能促进保护脊髓神经功能与改善颈椎功能,抑制炎症因子的释放,具有很好的麻醉效果。

