CEUS定量分析联合血清uPA、Hpa检测在甲状腺结节性质判断中的价值
李柠肖,邝永卫,陈君耀,窦丹燕
(海南医学院第二附属医院,海口570203)
甲状腺结节大部分为良性病变,少部分为恶性癌变。甲状腺的位置表浅,对于触诊检查不满意的甲状腺结节,临床常采用超声诊断。常规超声造影(CEUS)可通过增强模式和增强强度进行定性诊断,而CEUS定量技术可通过甲状腺造影灌注的实时相关曲线参数实现定量分析,有利于提高临床诊断效率[1]。目前,CEUS定量分析在消化道及腹腔恶性肿瘤的临床诊断中应用广泛,但在甲状腺结节的性质鉴别上尚缺乏统一标准。结节病变组织病理复杂,CEUS时由于仪器的灵敏度及图像分析技术差异可致结果差异。近年研究[2]发现,乙酰肝素酶(Hpa)、尿激酶纤溶酶原激活物(uPA)与甲状腺结节关系密切,其与甲状腺恶性肿瘤的发生发展、侵袭转移及预后有密切关系,可作为潜在新的肿瘤标志物。本研究通过分析甲状腺结节患者临床资料,研究CEUS定量分析联合血清uPA、Hpa检测在甲状腺结节性质判断中的价值。
1 资料与方法
1.1 临床资料 选择2013年1月~2016年12月于本院进行治疗的300例甲状腺结节患者,男185例、女115例,年龄24~77(48.92±6.13)岁。纳入标准:①在本院进行甲状腺结节穿刺活检或手术切除的患者;②病理诊断符合WHO甲状腺肿瘤组织学分类标准[3];③在检查前与患者及家属谈话,获得知情同意书。排除标准:①同时并发其他恶性肿瘤的患者;②伴有心脏、肝脏、肾脏功能障碍患者;③甲状腺微小癌患者;④对造影剂过敏的患者;⑤甲状腺功能亢进、甲状腺功能减退、桥本甲状腺炎;⑥术前进行过手术、放疗、化疗等治疗的患者。纳入的300例患者中176例经术前穿刺活检证实,124例手术切除治疗并于术后进行组织病理检测证实。本研究获得本院伦理委员会批准,患者或其家属知情同意。
1.2 CEUS定量分析 采用Simens2000彩色多普勒超声诊断仪进行检测,设置探头频率为5~9 MHz。超声造影剂为SonoVue(Bracco公司)。注入前使用5 mL生理盐水振荡混匀备用,患者采取平卧位,头部后仰,充分暴露颈部前区,先行常规二维彩色多普勒超声检查,观察甲状腺结节的大小、位置、形态、包膜、边界、是否钙化等,做出CEUS初步诊断。使用双幅显示功能,将结节固定于能显示结节及结节周围部分的最大切面,抽1 mL备好的造影剂于肘部浅静脉团注,随后注入5 mL生理盐水冲洗使造影剂进入血液循环,开启计时器,连续观察造影过程3 min,观察期间嘱患者保持平静呼吸,避免吞咽,将造影图像动态储存至硬盘。造影结束后,使用Contrast Dynamic 分析软件进行造影图像定量分析,观察比较结节的超声造影增强模式,选取感兴趣区域,进行结合时间-强度曲线定量分析。分析峰值强度(PD)、达峰时间(TTP)、平均渡越时间(MTT)。所有数据由两名经验丰富的医师进行独立分析,意见不一致时两人进行分析讨论最后给出统一结论。
1.3 血清uPA、Hpa检测 于术前清晨空腹采集所有患者外周血5 mL,3 000 r/min离心10 min,去上清,-80 ℃保存。采用ELISA法检测血清uPA、Hpa浓度,试剂盒购自上海晶抗生物工程有限公司,所有操作严格按照说明书进行。

2 结果
2.1 病理检测结果 共324个结节,结节最大直径0.3~4.1(1.96±0.64)cm。穿刺活检和术后病理检查结果证实良性甲状腺结节患者220例共236个结节(良性组),其中甲状腺腺瘤122例,结节性甲状腺肿86例,其他良性甲状腺结节12例;恶性甲状腺结节患者80例共88个结节(恶性组),其中乳头状甲状腺癌50例,滤泡性甲状腺癌24例,其他类型甲状腺癌6例。
2.2 二维彩色多普勒超声检测结果 良性组边界清晰167个(70.76%),不清晰69个(29.24%);内部回声均匀188个(79.66%),不均匀48个(20.34%);形态规则150个(63.56%),不规则86个(36.44%);有钙化70个(29.66%),无钙化166个(70.34%)。恶性组边界清晰25个(28.41%),不清晰63个(71.59%);内部回声均匀32个(36.36%),不均匀56个(63.64%);形态规则23个(26.14%),不规则65个(73.86%);有钙化46个(52.27%),无钙化42个(47.73%)。两组肿块边界、内部回声、形态和钙化情况比较差异有统计学意义(P均<0.05)。恶性结节多表现为边界不清晰、形态不规则,内部回声不均匀;良性结节在常规超声中多表现为边界清晰、内部回声均匀。
2.3 CEUS定量分析检测结果 良性组和恶性组的时间-强度曲线中,PD、TTP和AUC差异有统计学意义(P均<0.05),良性组和恶性组MTT比较差异无统计学意义(P>0.05),见表1。

表1 两组CEUS定量分析检测结果比较
2.4 CEUS定量分析判断结节性质的价值 88枚恶性甲状腺结节,经超声造影及定量分析确诊70枚,误诊良性18枚;236枚良性甲状腺结节,经超声造影及定量分析确诊211枚,误诊为恶性甲状腺结节25枚。CEUS定量分析判断结节性质的灵敏度为79.54%,特异度为89.41%,诊断准确率为80.25%。
2.5 两组血清uPA、Hpa水平比较 良性组与恶性组血清uPA水平分别为(814.76±197.83)、(1 254.18±361.35)pg/mL,血清Hpa水平分别为(44.67±12.29)、(79.83±140.34)U/mL,两组比较差异有统计学意义(P均<0.05)。
2.6 各指标检测的诊断效能比较 绘制的ROC曲线见图1。血清Hpa检测的临界值为56.24 U/mL,AUC为0.760;uPA单项检测的临界值为1 036.75 pg/mL,AUC为0.784。CEUS定量分析、Hpa、uPA联合检测的AUC为0.906,高于单项检测(P均<0.05)。联合检测灵敏度为90.90%,高于单项检测(P<0.05);联合检测特异度为80.09%,与单项检测比较差异无统计学意义(P>0.05);CEUS定量分析、Hpa、uPA单项检测与联合检测诊断效能比较见表2。
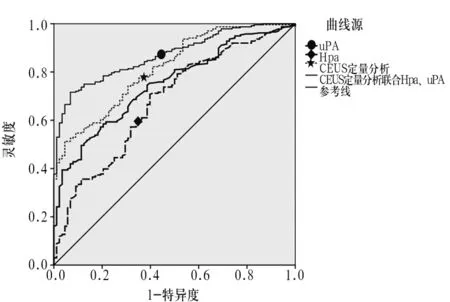
图1 CEUS定量分析、Hpa、uPA单项检测与联合检测诊断甲状腺结节的ROC曲线表2 CEUS定量分析、Hpa、uPA单项检测与联合检测诊断效能比较

指标AUC标准误95%可信区间灵敏度 特异度CEUS定量分析0.8010.260.750~0.85279.54%(70/88)89.83%(212/236)Hpa0.7600.270.707~0.81273.86%(65/88)85.17%(201/236)uPA0.7840.280.728~0.84070.45%(62/88)86.86%(205/236)CEUS定量分析联合Hpa、uPA0.9060.160.874~0.93890.90%(80/88)80.09%(189/236)
3 讨论
甲状腺结节的发病率居内分泌腺体肿瘤的第一位,近年呈上升趋势[4]。大部分甲状腺结节为良性结节,少部分为恶性肿瘤,且恶性肿瘤中80%为低度恶性,如甲状腺乳头状癌,只有少部分为高度恶性的甲状腺未分化癌,所以确定甲状腺结节的性质是临床治疗关键[5]。超声诊断已成为甲状腺结节病变临床首选影像学检查方法,但各良恶性结节肿块在不同增生时期,其常规二维超声特征复杂多样,具有一定的交叉和重叠性,且人为因素亦会影响其客观性,术前准确诊断仍有一定难度。CEUS定量分析可通过造影结合时间-强度曲线来实现定量分析,提高诊断的准确率[6]。uPA和Hpa是近年来广受关注的两种新的肿瘤标志物,与恶性肿瘤的发生发展和转移密切相关[7]。 本研究结果显示,甲状腺癌的二维超声主要特点为形状不规则、边界不清晰、无完整包膜、边缘不光整,可伴有微钙化,实质性低回声,其后方回声衰减、无完整声晕;良性结节多表现为边界清晰、边缘光滑,表现为囊性或实行结节,高回声、回声均匀,声晕完整,二者表现差异有统计学意义。通过超声造影的增强模式比较发现,恶性结节多表现为不均匀强化(慢进低增强、不均匀低增强),良性结节多表现为均匀高增强或周边环形高增强、快进低增强。时间-强度曲线定量分析发现,良性组和恶性组PD、TTP比较差异有统计学意义。原因是恶性肿瘤内部血管生长迅速,过快的恶性生长破坏正常组织结构,导致恶性结节内的血管走向杂乱无章,与原有血管不协调;与良性结节和周围组织相比,恶性结节表现出不同的微血管密度,在增强模式上则表现为不均匀增强[8]。良性结节多为增生性病变,组织长期处于反复增生、修复过程,进而形成结节,膨胀性生长的瘤体会将正常血管往周边推,形成周边环状血流,结节的血流状态一般改变不大,较接近于正常组织,所以在增强模式上表现为周边环形增强或均匀性增强[9]。本研究纳入的良性结节多为甲状腺腺瘤和结节性甲状腺肿,这两种结节血供丰富,瘤体对血管的破坏较少,所以造影剂进入更多,PD更大,表现为更大的时间-强度曲线下面积。
恶性甲状腺肿瘤临床比例较低,发病隐匿,不易察觉,大多在确诊时可能已伴有不同程度转移,据报道,20%~35%的甲状腺癌患者死于癌细胞的扩散和转移[10]。Hpa是哺乳动物体内的一种葡萄糖醛酸酯酶,是体内惟一能对乙酰肝素进行特异性识别和剪切的酶,广泛存在于细胞膜和外基质中,参与肿瘤细胞的增殖分化、侵袭和转移,一般在正常组织中不表达或低表达,在甲状腺乳头状癌患者血清中呈高表达,对甲状腺癌的诊断有指导意义[11]。uPA 是一种丝氨酸蛋白酶,属于纤维蛋白溶解系统,由肿瘤细胞分泌,与肿瘤生长、浸润和转移有关,在诸多恶性肿瘤组织、血清、血浆中检测到高表达[12],Higashi等[13]发现,高活性的uPA主要由甲状腺乳头状癌细胞分泌,因此认为uPA可作为甲状腺癌检测和治疗的指标。李建业等[14]采用免疫组化检测到uPA在分化型甲状腺癌组织中表达,且与Hpa的表达呈正相关关系,认为Hpa和uPA参与甲状腺癌的发生发展,且与肿瘤分化程度相关。研究发现,Hpa过表达会破坏体内乙酰肝素的平衡,破坏细胞外基质和基底膜的稳定性,损害细胞间质的屏障功能,加速肿瘤细胞的侵袭和转移,促进肿瘤发展;同时细胞外基质的降解会导致肿瘤细胞外基质上uPA释放,增强肿瘤细胞侵袭作用[13,15]。
本研究结果显示,单项检测的AUC在0.760~0.801,均有较高的诊断价值,同时单项检测均有较好的特异度,但灵敏度仍有待提升;获得血清Hpa、uPA的诊断临界值分别为56.24 U/mL、1 036.75 pg/mL。李建业等[16]研究发现,Hpa、uPA两者联合检测的AUC为0.812,显著高于单项检测,可预测淋巴结是否转移。何颖等[17]发现,联合检测诊断甲状腺癌的灵敏度和特异度分别是90.48%、84.75%。本研究以CEUS定量分析检测结果为阳性,且同时血清uPA、Hpa中任意指标检测阳性为联合诊断阳性,联合诊断AUC为0.906,灵敏度为90.90%,特异度为80.09%,诊断价值高。
综上所述,CEUS定量分析联合血清uPA、Hpa有助于判断甲状腺结节的性质。

