UPLC-MS/MS 法测定凡纳滨对虾中呋喃西林新型生物标志物
胡梦玲,张小军,严忠雍,梅光明,方双琪,,张 帅,
(1.浙江海洋大学食品与医药学院,浙江舟山 316021;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316022)
硝基呋喃类抗生素是一系列广谱抗菌药物的总称,常用的主要有以下4 种:呋喃唑酮(Forazolidone,FZD)、呋喃它酮(Furaltadone,FTD)、呋喃西林(Nitrofurazone,NFZ)和呋喃妥因(Nitrofurantoin,NFT)[1-2],以呋喃西林为例,原药及其代谢产物氨基脲的2-硝基苯甲醛(NP)衍生物结构式如图1 所示。
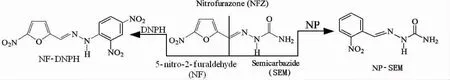
图1 原药呋喃西林(Nitrofurazone,NFZ)及其衍生物(NP-SEM,DNPH-NF)的结构图Fig.1 Structure diagram of parent NFZ and derivatives
硝基呋喃类药物是人工合成的一类广谱抗菌药物[2-4],此类抗生素以其良好的抗菌作用、药物代谢较快的特性和价格低等特点[5-6],最早被用于家禽、家畜、水产养殖动物细菌性疾病的防治[3]。常因用于预防和治疗鱼类及畜禽类因感染沙门氏菌和大肠埃希菌而产生的疾病在畜牧业及水产养殖中曾被广泛使用[2-3]。
硝基呋喃类药物在生物体内代谢速率非常快[7-8],消除半衰期从几小时到十几小时不等,因此,从饲料或给药动物体内检测硝基呋喃原形药是比较困难且不准确的,原药的残留量不足以反映真实的用药情况。然而,硝基呋喃的代谢产物5-甲基吗啉-3-氨基-2-噁唑烷基酮(AMOZ)、氨基脲(semicarbazide,SEM)、1-氨基-2-内酰脲(AHD)、3-氨基-2-噁唑烷基酮(AOZ)能与组织蛋白结合而长期存在[8-12]。硝基呋喃类药物有一定的毒性,尤其代谢物被证实长期服用具有潜在的“三致”作用(致癌、致畸和致突变)[13-17]。因此包括中国在内的大多数国家已禁止在动物源性食品中使用[18-19]。目前针对呋喃西林违禁用药的检测方法主要有酶联免疫法(ELISA)[5,12]、原子吸收法[14]高效液相色谱-紫外检测法(HPLC-UV)[5,8,16]、高效液相色谱-串联质谱法(HPLC-MS/MS)[18-19]、免疫胶体金法[9]和分光光度法等。基于SEM 为生物标志物的检测方法无法分辨“阳性”的SEM 究竟来自于呋喃西林还是自然产生,这使得沿用至今的SEM 是否能够继续作为呋喃西林检测的标志物在业内引起了巨大争议[15,17]。近年来,研究人员开发了新的检测方法以及探索新型的呋喃西林生物标志物以解决SEM 检测“假阳性”问题。WANG Yuesong,et al[20]对呋喃西林在鲶鱼体内的代谢途径进行了研究,提出了一种全新的氰基代谢物,并认为可替代SEM 作为呋喃西林检测的确证标志物。对于这种全新的标示物,相关文献仅用同位素质谱法进行了分析推断,如果能够分离出纯物质,采用核磁等方法对氰基代谢物结构加以确证,则会更加有说服力。
判定硝基呋喃类抗生素是否用药的传统检测方法是通过测定其生物标志残留物来实现的,以检测呋喃西林代谢物氨基脲(SEM)为例,在适当的酸性水解氛围下,与组织蛋白结合的SEM 会重新游离出来。从检测的角度出发,SEM 是一类小分子量化合物,对液相色谱常用的紫外和荧光检测器响应均不理想,因而加入2-硝基苯甲醛(NP)作为衍生化试剂,衍生产物NP-SEM 如图1 所示,经过分离纯化后,用UPLC/MS/MS 分析,检测限可达欧盟法规要求的1 μg·kg-1[21]。
本研究以5-硝基-2-糠醛(NF)为新型生物标志物,经2,4-二硝基苯肼(DNPH)柱前衍生后,将NF 转化成稳定的腙类化合物,再进行分离提取并检测,用于识别和确证因呋喃西林用药残留问题,传统SEM 与新型NF 标志物衍生途径分别如图1 所示。
1 材料与方法
1.1 材料与试剂
5-硝基-2-糠醛标准品(CAS:698-63-5,纯度>97%),日本东京化工集团;呋喃西林、氨基脲盐酸盐、13C15N2氨基脲盐酸盐同位素标准品,德国Dr.Ehrenstorfer 公司;呋喃西林药粉,商丘市亮峰卫生用品有限公司;DNPH-NF 衍生物标准品,浙江省海洋水产研究所实验室自制;乙腈、甲醇、乙酸乙酯、正己烷、(均为色谱纯),德国Merck 公司;甲酸、乙酸铵(均为色谱纯),美国Sigma 公司;2,4-二硝基苯肼、硫酸、盐酸、无水磷酸氢二钾(均为AR),上海国药集团有限公司;实验用水均为Millipore-Q 系统制备的超纯水。
1.2 仪器与设备
ACQUITYTM UPLC I-Class/Xevo TQ-S 液相色谱-串联质谱仪(配有电喷雾离子源) 美国Waters 公司;SPE-24 固相萃取装置 美国supelco 公司;N-EVAP-11634 氮气吹干仪 美国Organomation 公司;LPD2500多管漩涡混合仪莱普特科学仪器(北京) 有限公司;超声波清洗器上海科导超声仪器有限公司;Centrifuge 5810 高速离心机 德国Eppendorf 公司;Oasis PRiME HLB 净化柱(柱容量3 mL)美国Waters 公司。
1.3 方法
1.3.1 溶液的配制
磷酸盐缓冲液(0.1 mol·L-1):分别称取二水合磷酸二氢钠2.18 g,十二水合磷酸氢二钠12.90 g,氯化钠8.50 g,用水溶解并定容至1 000 mL。
盐酸溶液(0.2 mol·L-1):量取浓盐酸6 mL,用水溶解并定容至1 000 mL。
2,4-二硝基苯肼衍生化试剂:精确称取药品250 mg 于250 mL 棕色容量瓶中,先用5 mL 乙醇溶解,再加入2.5 mL 盐酸,后用乙醇定容至250 mL,配制成浓度为1 mg·mL-1的使用液,在4 ℃下避光保存。
NF-DNPH 标准溶液:精确称取适量的NF-DNPH 标准品粉末,用乙腈稀释定容至50 mL 容量瓶,4 ℃避光保存,保存时间为6 个月;使用时用乙腈逐级稀释至100 μg·L-1备用。
1.3.2 呋喃西林暴露实验
实验所用凡纳滨对虾购于浙江省舟山市临城华润万家超市,运送至实验室后,立即暂养于配有增氧泵的水槽中,24 h 后检查并剔除死亡的对虾,随后选取个头较小的对虾制样,检测硝基呋喃残留。判定空白无残留后,挑选个体长度、鲜活程度均等的对虾进行药物暴露实验。
因甲壳类动物的特殊性,通过口服、注射等方式难以达到预期的给药效果,结合水产用药的实际情况,本文拟采用药浴的方式给药。称取5、50、500 mg 的呋喃西林药粉,溶解于5 L 水中,分别制成浓度为1、10、100 mg·L-1呋喃西林药浴,如图2 所示,将检测为空白的对虾(每只约15 g)放入药浴中浸泡24 h 后,按标准规范要求去壳后混合制样检测。
1.3.3 样品前处理
称取1.00 g(准确到0.01 g)待测样品,置于50 mL 塑料离心管中,加入10 mL 稀盐酸(0.2 mol·L-1),100 μL 2,4-二硝基苯肼(衍生试剂DNPH,1 mg·L-1),涡旋振荡1 min,超声振荡30 min 后,用磷酸氢二钾(0.1 mol·L-1)调pH 至7.5 后,将8 mL 乙酸乙酯分2 次加入,7 000 r·min-1离心5 min,合并上清液至15 mL 离心管,在40 ℃水浴条件下氮吹浓缩至干,加入1 mL 流动相乙腈/水(7:3,V/V)溶解,旋涡振荡1 min,经Oasis PRiME HLB 净化柱除杂,过0.22 μm 有机微孔滤膜后,液相色谱-质谱分析。
SEM 检测方法参照《农业部783 号公告-1-2006 水产品中硝基呋喃代谢物残留的测定 液相色谱-串联质谱法》[22]。

图2 凡纳滨对虾的呋喃西林药物暴露实验Fig.2 L.vannamei exposure to nitrofurazone
1.3.4 高效液相色谱条件
色谱柱:ACQUITYTM UPLC BEH C18 柱(2.1 mm×50 mm,1.7 μm);进样量10 μL;样品室温度4 ℃;流动相A 为纯水(2 mol·L-1乙酸铵),B 为乙腈,柱温40 ℃;流速0.2 mL·min-1;梯度洗脱:0~4.0 min,70%~30%A;4.0~6.0 min,30%A。
1.3.5 质谱条件
电喷雾离子源,DNPH-NF 检测为负离子扫描(Electrospray ionization,ESI-)模式;NP-SEM 检测为正离子扫描方式:多反应监测模式(Multiple Reaction Monitor,MRM);离子源温度:150 ℃;脱溶剂气温度:380℃;毛细管电压:2.5 kV;锥孔气流量:60 L·h-1;脱溶剂气流量:600 L·h-1;锥孔电压、碰撞能量、分析物母离子及子离子等质谱多反应监测实验条件如表1。
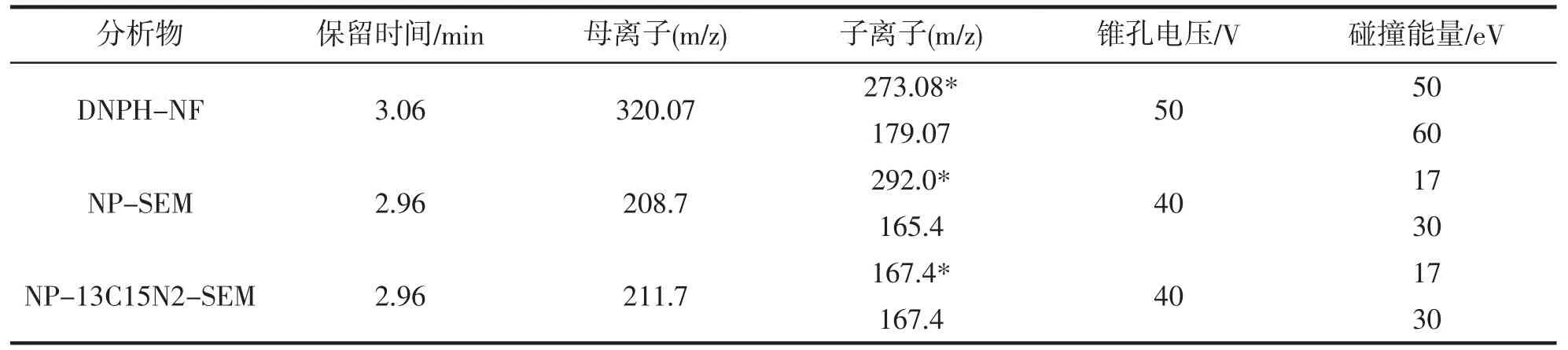
表1 分析物的质谱多反应监测实验条件Tab.1 Conditions of multiple reaction monitoring for analyte
2 结果与分析
2.1 质谱条件优化
由于没有商品化的5-硝基-2-糠醛衍生物标准品可购买,因此本实验组合成并提纯了NF-DNPH,该衍生物的质谱分析条件也无相关文献可供借鉴,分别在电喷雾正、负离子扫描模式下以10 μL·min-1流动注射NF-DNPH 标准溶液,发现该化合物在负离子模式下的响应灵敏,质谱信号强。因此选择电喷雾负离子模式对分析物的质谱参数进行优化。经过一级质谱扫描分析确定NF-DNPH 的母离子峰[M-H]-为m/z 320.07。通过二级碰撞诱导分析收集分析物子离子信息,选取m/z 320.07>273.08 和m/z 320.07>179.07 丰度最强的两个离子碎片峰作为分析物的子离子,并对锥孔电压,碰撞能量等参数进一步优化,如图3 所示,得出最佳的质谱多反应监测条件列于表1。

图3 优化的锥孔电压、碰撞能和子离子质谱碎裂图Fig.3 Optimization of cone volatage collision energy and daughter spectrum
2.2 衍生化条件的优化
柱前衍生反应通常受温度、衍生时间、酸浓度、衍生试剂用量等条件的影响,衍生化条件对衍生效率的影响至关重要并最终影响定量检测的精确性,为提高前处理的高效性,需对柱前衍生反应进行优化。由于5-硝基-2-糠醛本身的热不稳定性,温度过高容易造成分解,衍生效率低,定量不准确;而衍生化温度过低,导致衍生过慢而反应不完全,综合考虑本文采用室温,25 ℃,作为衍生反应温度。
2.2.1 盐酸用量
5-硝基-2-糠醛与2,4-二硝基苯肼的衍生化反应过程,属于羰基的亲核加成反应,反应过程中溶液的酸性氛围可以加强羰基碳的正极性,有利于促进亲核加成反应的进行。因而合适的酸性条件下有利于衍生化反应的顺利完成。实验选取5~30 mL 盐酸(0.2 mol·L-1)进行实验,以盐酸体积与与衍生物峰面积作关系曲线,从图4 可以看出,当加入的盐酸体积超过10 mL 后,衍生物峰面积基本无变化,考虑到磷酸氢二钾中和后的体积,本文选取10 mL 作为盐酸用量。
2.2.2 衍生时间
选取10~60 min 进行实验,以为衍生时间和衍生物峰面积作关系曲线,从图5 可以看出,衍生物峰面积随着衍生时间增加而逐渐提高,10~30 min 时间段提高较为显著,30 min 达到峰值并趋于稳定,可以视为衍生反应基本完全,因此本文选取30 min 作为最佳衍生化时间。
2.2.3 衍生试剂用量
2,4-二硝基苯肼在反应里将较不稳定的5-硝基-2-糠醛转化为腙类,以便衍生物在后续的样品前处理过程中能够稳定存在,因此衍生化试剂的用量对目标化合物的回收率有重要作用。实验对2,4-二硝基苯肼(1 mg·L-1)的用量从50~300 μL。以衍生化试剂的用量和衍生物峰面积作关系曲线,从图6 可以看出,衍生物峰面积随着衍生化试剂的增加而逐渐提高,当用量为100 μL 时候,峰面积达到最高;用量超过100 μL 以后,反而使得峰面积逐渐下降,这可能是由于过量的衍生化试剂使得基质效应增强而干扰了质谱检测,因此要严格控制2,4-二硝基苯肼的用量,本文选取100 μL 作为2,4-二硝基苯肼的最佳用量
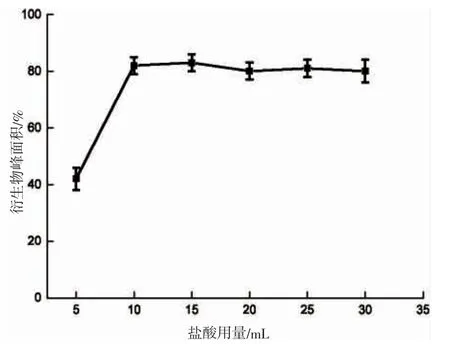
图4 盐酸用量对分析物的影响Fig.4 The amount of hydrochloric acid on the impact of the analyte
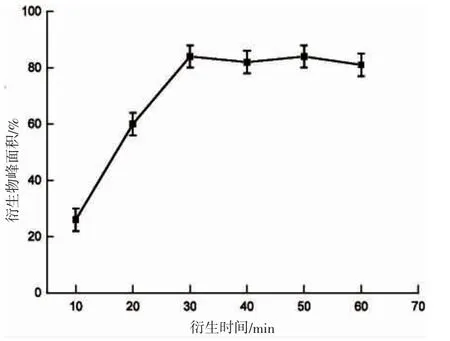
图5 衍生时间对分析物的影响Fig.5 Derivation of the impact of the analyte

图6 衍生试剂用量对分析物的影响Fig.6 Influence of derivative reagent on analyte
2.3 方法验证
为了测试衍生物的稳定性和特异性,在2 个月的周期内,将DNPH-NF 的标准溶液每隔2 周分析1 次,色谱峰面积的相对标准偏差小于5%,这表明DNPH-NF衍生物具备足够的稳定性,可以存放数月。用分析不同种类空白样品(鱼,蟹和虾)的方式考察衍生物的特异性。样品的质谱离子流图显示,检测目标物峰形对称且附近没有基质效应的干扰作用。
将6 种不同浓度的标准溶液各分析3 次,用于建立标准曲线。在上述优化的柱前衍生、色谱-质谱条件下,DNPH-NF 在0.4~20 μg·kg-1的浓度范围内,NP-SEM 在0.5~20 μg·kg-1的浓度范围内线性良好。线性方程相关系数分别为:r2=0.993,r2=0.995。DNPH-NF 用外标法定量,而NP-SEM 采用13C15N-SEM 内标法定量。实际样品的DNPH-N 与NP-SEM 加标回收率范围分别为83.4%~90.3%、85.3%~93.1%,相对标准偏差<10%。方法的理论检出限(LOD)和定量限(LOQ)分别以3 倍信噪比和10 倍信噪比计算,最终确定新型生物标志物检出限和定量限分别为0.3 μg·kg-1和1.0 μg·kg-1。
2.4 实际样品的分析
为考察方法的适用性和实用性,采用本方法对空白及不同浓度呋喃西林浸泡后的凡纳滨对虾样品进行分析检测。
如图7 所示,空白组结果有1~5 μg·kg-1的SEM 检出,说明SEM 内源性问题是存在的;而5-硝基-2-糠醛检出量低于检测限,表明对虾中NF 无内源性产生。
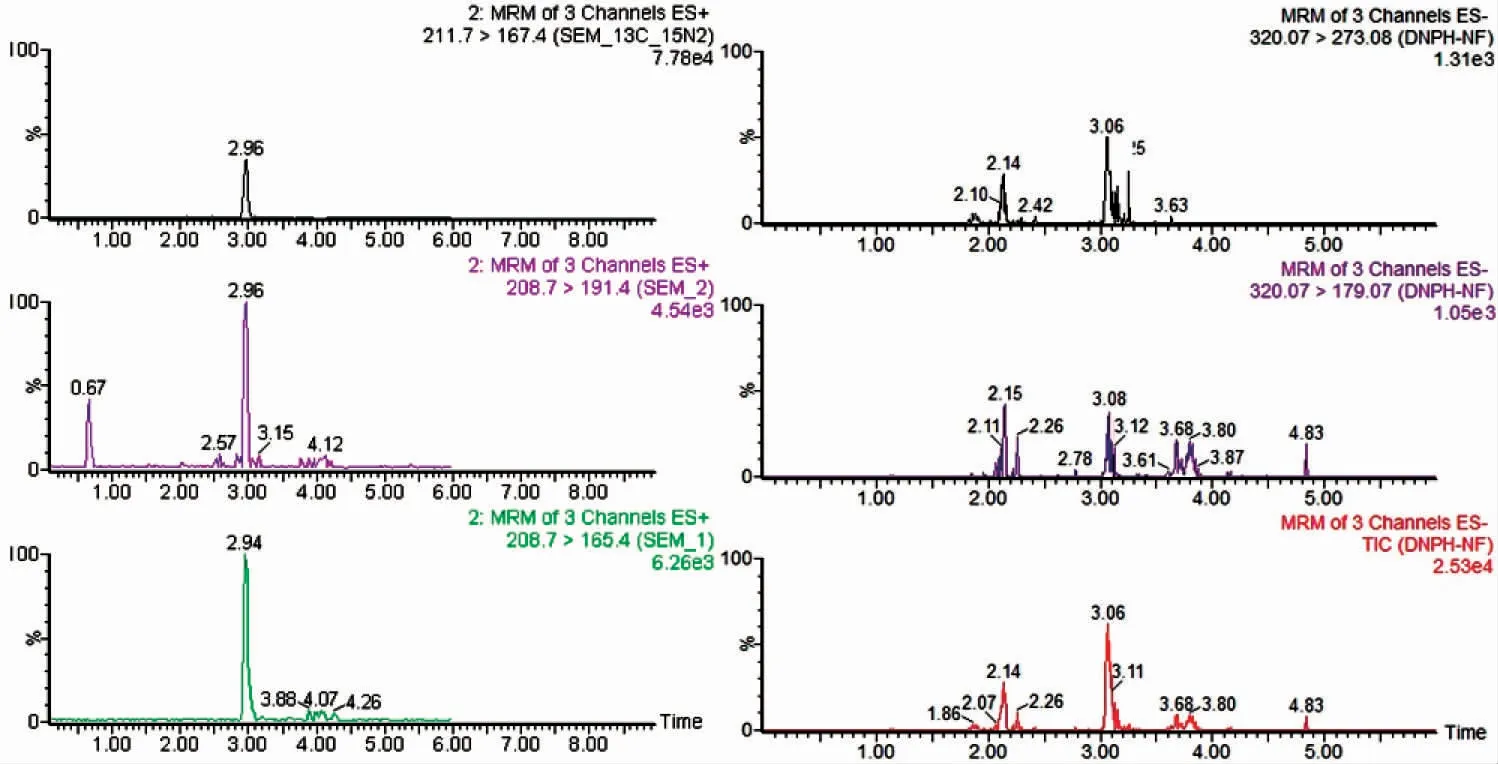
图7 空白对虾样品的MRM 图谱Fig.7 MRM chromatograms of blank L.vannamei
如图8 所示,检测结果表明,在1、10 和100 mg·L-1的呋喃西林浸泡条件下,24 h 后取样分析,SEM 在虾肉中残留分别为55,325 和2 187 μg·kg-1。
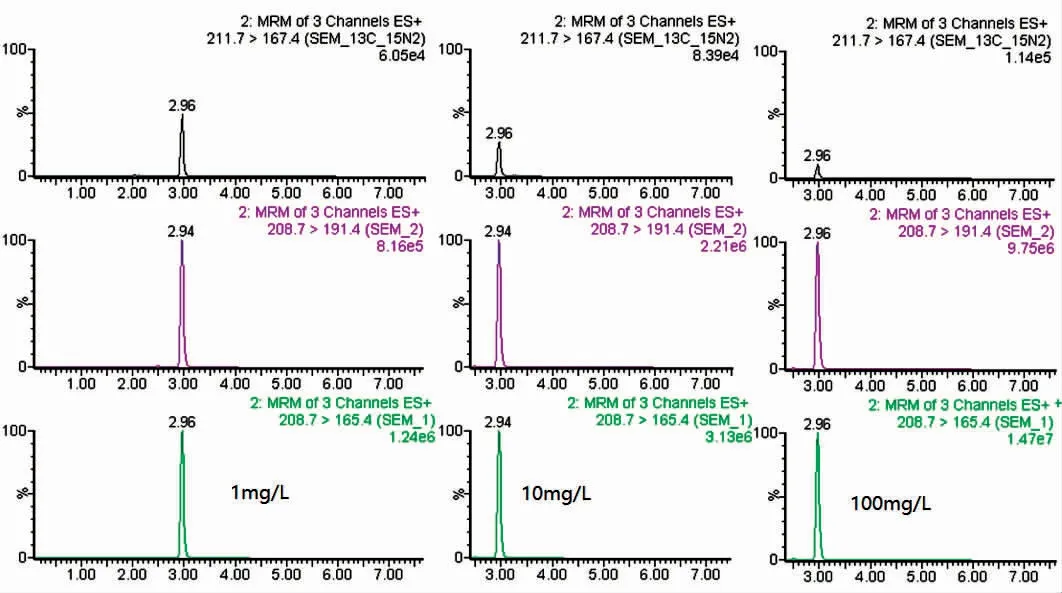
图8 凡纳滨对虾中NP-SEM 质谱图,正离子模式Fig.8 MRM chromatograms of NP-SEM in L.vannamei after the administration of NFZ,positive electrospray ionization
如图9 所示,检测结果表明,在1、10 和100 mg·L-1的呋喃西林浸泡条件下,24 h 后取样分析,NF 在虾肉中残留分别为2.7、19 和173 μg·kg-1。
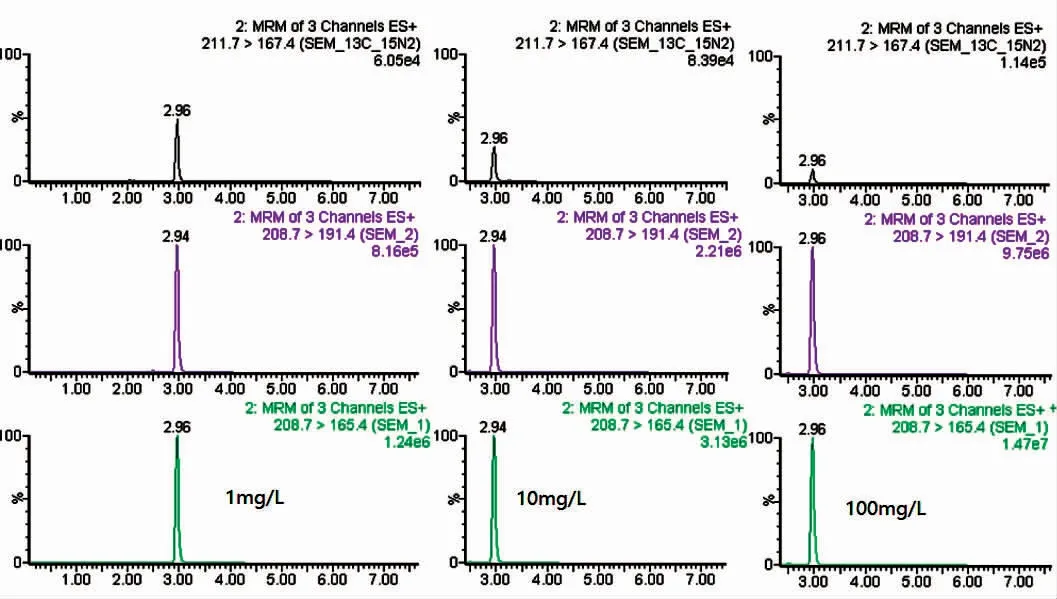
图9 凡纳滨对虾中DNPH-NF 质谱图,负离子模式Fig.9 MRM chromatograms of DNPH-NF in L.vannamei after the administration of NFZ,negative electrospray ionization
与NP-SEM 检测相比,DNPH-NF 检测结果偏低[10]几十倍,除了代谢残留量较低的原因,还有一个因素则是SEM 的检测为内标法定量,13C15N-SEM 同位素内标物可以补偿样品前处理带来的损失,由于5-硝基-2-糠醛的同位素内标物没有出售,因而本文采用了外标法定量[12],也会导致测定结果比真实值偏低。
3 结论
本研究利用5-硝基-2-糠醛为生物标志物检测呋喃西林残留,方法特异性好,无内源性问题[14],衍生化时间短,大大节省了样品前处理的时间,且衍生物性质稳定、质谱响应好,检测灵敏度低至0.3 μg·kg-1。鉴于5-硝基-2-糠醛的化学特性及其在凡纳滨对虾中的实际代谢残留量,本方法可以与传统的氨基脲检测方法配合使用,适用于对虾等氨基脲内源性问题样品的呋喃西林初期用药情况的判定。

