藏药波棱瓜花水溶性多糖提取工艺实验研究
刘 芮,唐 棣,刘 群
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.四川省兽药监察所,四川 成都 610041)
波棱瓜花,藏文音译“色吉美朵”,为葫芦科植物波棱瓜(Herpetospermum pedunculosum(Ser.) Baill)的干燥花,中文药名Bolengguahua,拉丁药名Herpetosper-mi Pedunculosi Flos. 主要产于四川、云南、西藏等省区.根据古籍文献记载,波棱瓜花具有清热解毒,除腑胆热等功效,藏医用于治疗赤巴病、肝胆病等疾病[1].关于波棱瓜花的研究报道目前很少,仅限于波棱瓜的资源考查、性状研究[2]及非药用部位波棱瓜籽的化学成分,如脂肪酸、氨基酸、微量元素(谱)、木脂素等含量研究[3~10],对入药部位花的研究仅见张雨欣等对其质量标准制定研究(水分、浸出物、总灰分、酸不溶性灰分等)[1],波棱瓜花的化学成分、药效学、药动学研究还未见报道.植物多糖为多组分混合物(通常由葡萄糖、果糖、鼠李糖、阿拉伯糖、己糖醛酸、半乳糖醛酸、葡萄糖醛酸等组成),具有不溶于冷水、在热水中呈粘液状、遇乙醇能沉淀的理化特点. 本研究采用水煎醇沉法提取波棱瓜花多糖,以影响多糖提取效率的三个因素(料液比、提取温度、提取时间)为自变量,以提取液多糖含量为响应值,在单因素试验的基础上,运用中心组合设计响应面实验,优化波棱瓜花水溶性多糖提取工艺,现将研究结果报告如下.
1 材料
1.1 实验药材
波棱瓜(Herpetospermum pedunculosum (Ser.).Baill)的干燥花(Herpetospermi Pedunculosi Flos).采集于四川甘孜色达地区,室温通风干燥,避光保存;由西南大学园艺园林学院李先源教授鉴定.
1.2 仪器设备
紫外- 可见分光光度计(Shimadzu Corporation,UV-2007 型);
电热恒温水浴锅(上海一恒科学仪器有限公司,HWS24 型);
电子天平(上海力能电子仪器公司,YB12002 -E);
电热恒温鼓风干燥箱(上海精宏实验设备有限公司,DHG-9023A 型);
数显恒温水浴锅(金坛市富华仪器有限公司,HH-2)等.
1.3 试剂
乙醚、苯酚、三氯乙酸、30%过氧化氢等(成都金山化学试剂有限公司,AR);无水乙醇(成都市科隆化学有限公司,AR);活性碳粉(国药集团化学试剂有限公司,AR)等.
2 方法
2.1 工艺流程
干燥—粉碎—脱脂—水提工艺(料液比、提取温度、提取时间)—脱蛋白—脱色—醇沉—沉淀干燥—多糖.
2.2 波棱瓜花预处理
波棱瓜花干燥至恒重(50 ℃),粉碎,24 目过筛.粉末运用索氏提取法,加入够两次虹吸量的乙醚,加热回流6 h,完成脱脂,4 ℃冰箱保存[11-12].
2.3 水提工艺(单因素试验)
2.3.1 标准曲线
以葡萄糖为标准品,采用苯酚-浓硫酸结合紫外分光光度法(490 nm 波长)测定吸光度,利用最小二乘法对吸光度做线性回归,以获回归曲线及回归方程(Y =aX +b,R2≈1,表明在一定范围内吸光度X 与多糖质量浓度Y 之间的线性关系良好)[13].
2.3.2 标准品和样品紫外-可见光谱图
样品:取脱脂药材粉末1.0 g,蒸馏水10.0 mL,沸水浴2 h,过滤,参照2.3.1“标准曲线的制作”.
紫外-可见光谱图:将反应完全的标准液和样品液倒入10 mL 比色皿中,以空白对照为参比,200 ~800 nm 波段下进行紫外-可见光扫描,获标准品和样品紫外-可见光谱图[14].
2.3.3 单因素试验
根据预试验,确定以下为影响多糖提取的主要因素.
单因素试验操作步骤:
(1)料液比:将7 份脱脂药材粉末1.0 g 分别加入贴好标签的离心管中,固定提取温度60 ℃、提取时间4 h,料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 条件下进行水提;
(2)提取温度:根据最佳料液比,固定提取时间4 h,提取温度分别为40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃的条件下水提;
(3)提取时间:根据最佳料液比和提取温度,提取时间为0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、3.5 h的条件下水提.
水溶性多糖含量测定方法(苯酚-浓硫酸比色法)操作步骤[15]:在不同料液比、不同提取温度和不同提取时间的条件下,纱布过滤,获水溶性多糖提取液(生药1 g);取水溶性多糖提取液1 mL,稀释30倍,苯酚- 硫酸法测多糖:取稀释后的水溶性多糖2 mL,加入到标记好的玻璃试管中,再加入1 mL5%苯酚溶液和5 mL 浓硫酸;紫外分光光度计(490 nm波长)测定吸光值;水溶性多糖含量计算[12,16~18].
2.4 工艺优化(响应面分析)
在单因素试验基础上,选择料液比、提取温度、提取时间作为可变影响3 因素,以波棱瓜花水溶性多糖的提取含量为响应值,设计响应面试验,考查料液比、提取温度、提取时间的一次项、二次项和交互项对波棱瓜花水溶性多糖提取的影响.
2.5 水提工艺重复性检测
精确称取5 份脱脂药材粉末1.0 g,按照优化后的提取工艺,平行制备五份样品溶液,检测提取液中波棱瓜花水溶性多糖含量并计算其相对标准偏差(RSD).结果可用于评价或验证水提工艺的随机误差.
3 结果与分析
3.1 标准曲线
不同浓度标准液在490 nm 处测得溶液的吸光度(A)见表1.

表1 标准液的吸光度Table 1 Absorbance of standard solution
回归方程:绘制标准曲线,横坐标为葡萄糖标准液浓度,纵坐标为吸光度(A),进行回归分析,建立回归方程(见图1).
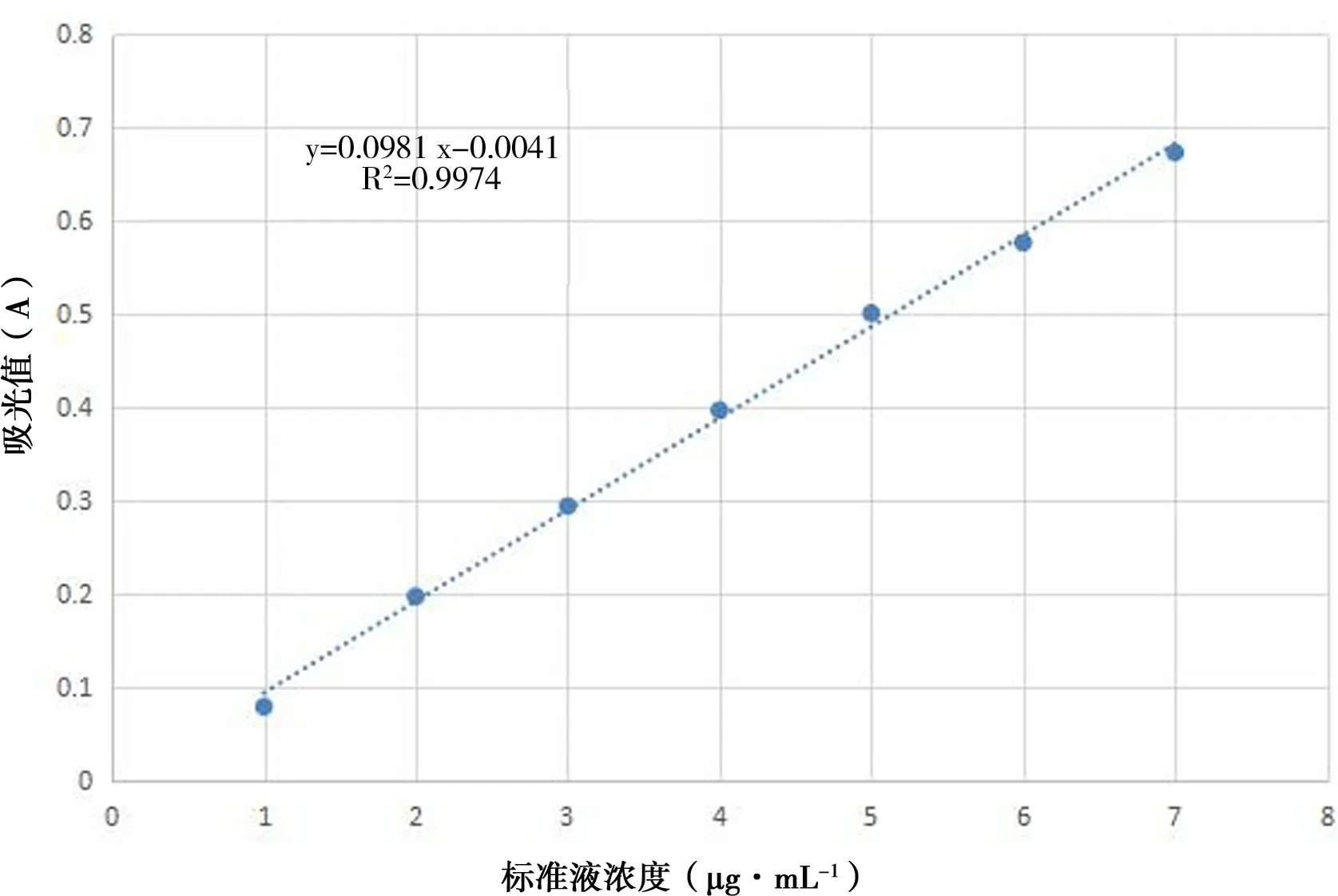
图1 标准曲线Fig.1 The standard curve
表1、图1 表明:回归方程为A =0. 0098C +0.0041,相关系数R2=0.9974,即葡萄糖质量浓度在10~70 μg·mL-1范围内线性关系良好. 按照方程A =0.0098C +0.0041 分别计算出上述各个样品中的水溶性糖浓度,进而换算出多糖提取率,结果如下:
多糖提取率(%) =(水溶性多糖吸光度+0.0041)/0.0981× 定容总体积(30 mL) ×10-3/干燥波棱瓜花质量(1 g) ×料液比×100%.
3.2 单因素实验
3.2.1 料液比对波棱瓜花水溶性多糖提取率的影响
固定提取温度60 ℃、提取时间4 h,不同料液比对水溶性多糖提取率影响的结果见表2、图2.
表2、图2 表明:水溶性多糖提取率随料液比的增加呈现先上升后下降的趋势.料液比为1∶30 时,提取率最高,因此选择1∶25、1∶30、1∶35 作为中心组合实验料液比的三个水平参数.
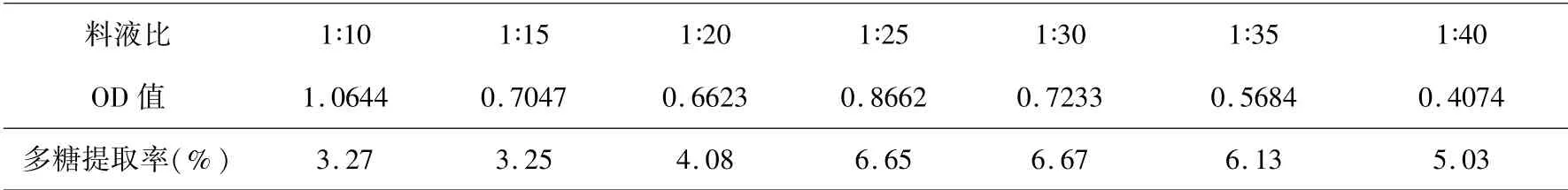
表2 料液比对水溶性多糖提取率的影响Table 2 Effect of solid-liquid ratio on extraction yield of water-soluble polysaccharide
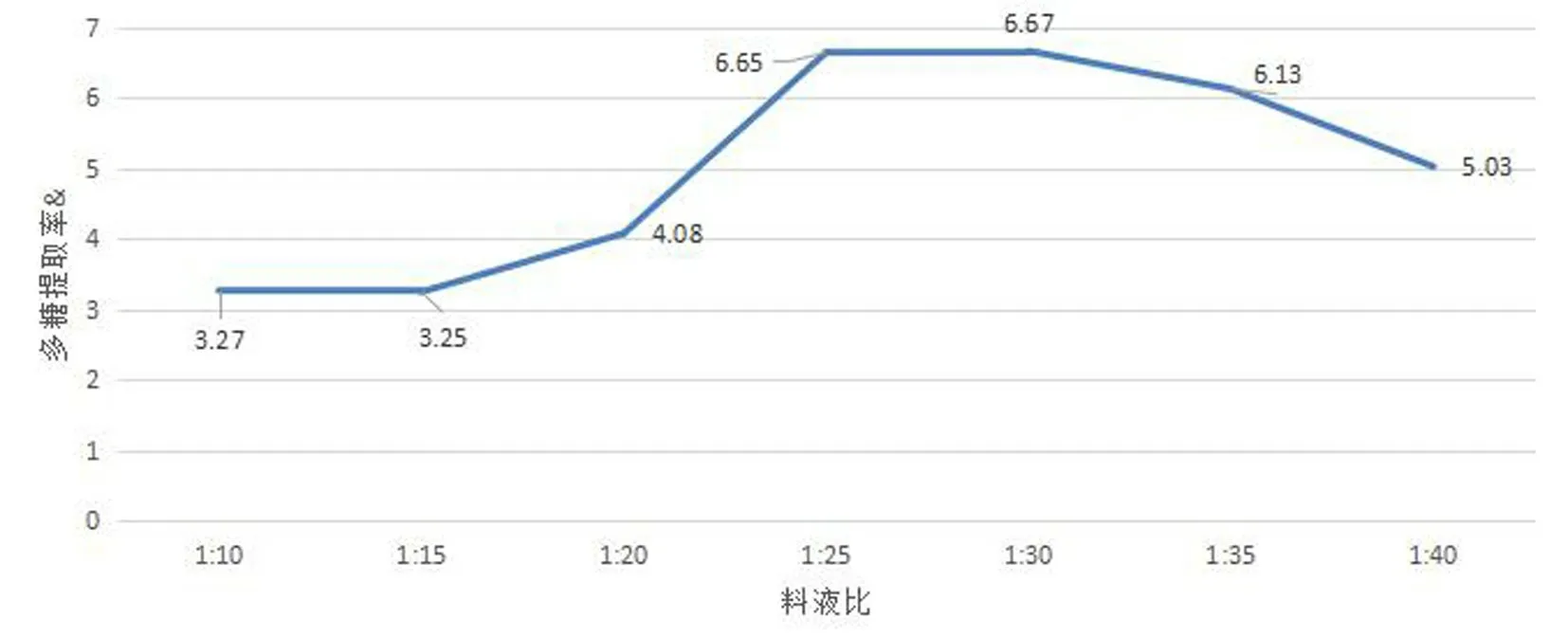
图2 料液比对水溶性多糖提取率的影响Fig.2 Effect of solid-liquid ratio on extraction yield of water-soluble polysaccharide
3.2.2 提取温度对波棱瓜花水溶性多糖提取率的影响
根据3.2.1 提供的最佳料液比(1∶30),固定提取时间4 h,不同提取温度对水溶性多糖提取率影响的结果见表3、图3.
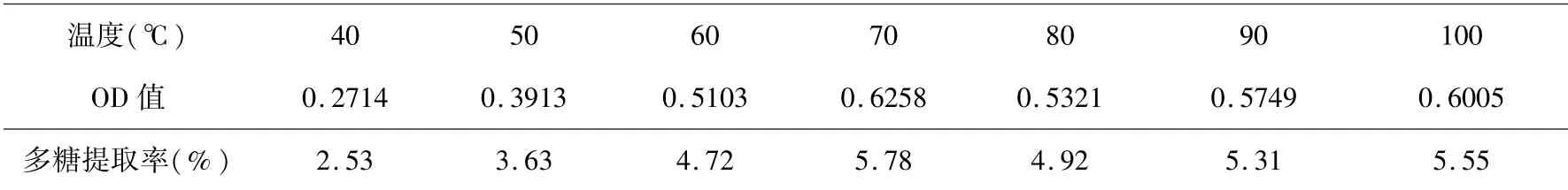
表3 提取温度对水溶性多糖提取率的影响Table 3 Effect of temperature on the extraction yield of water-soluble polysaccharide
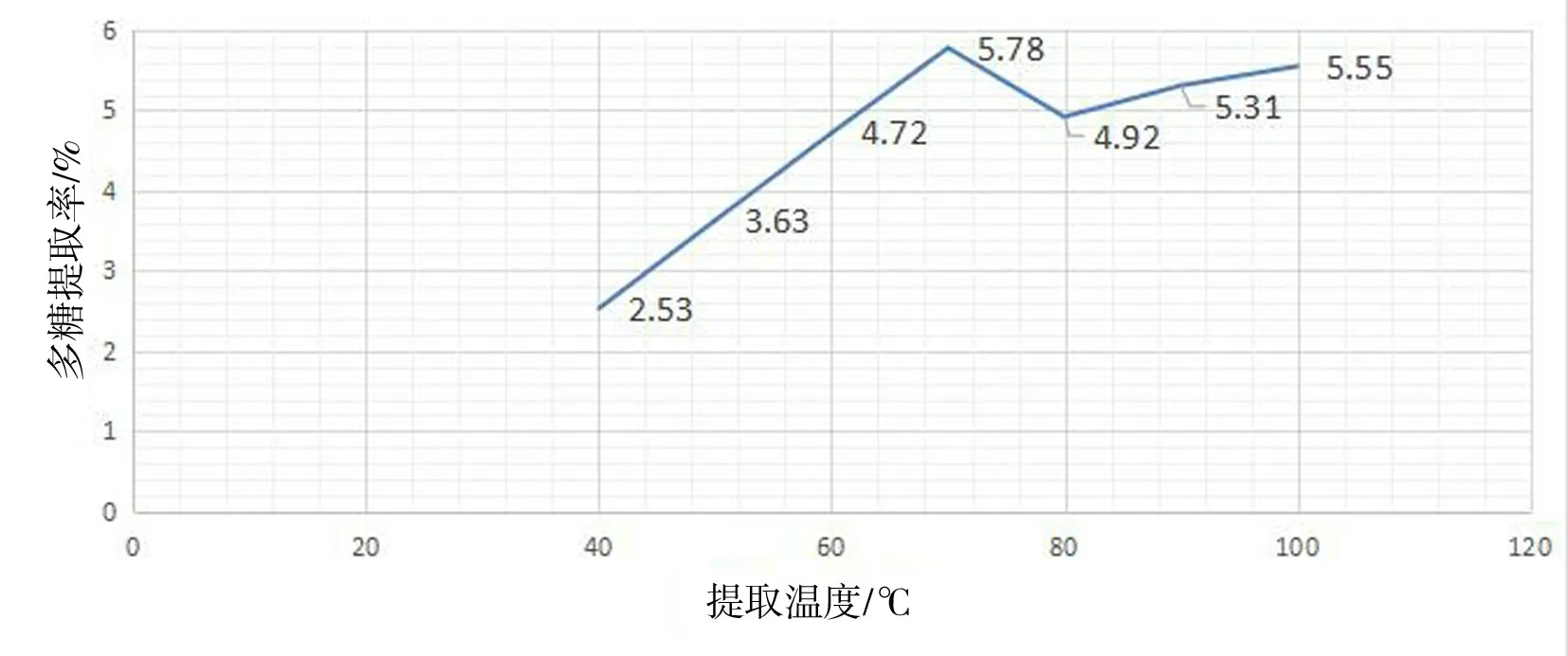
图3 提取温度对水溶性多糖提取率的影响Fig.3 Effect of temperature on the extraction yield of water-soluble polysaccharide
表3、图3 表明:提取温度在40 ℃~70 ℃,水溶性多糖提取率随温度升高而升高,在70 ℃时达到最高;提取温度超过70 ℃时,水溶性多糖提取率随着温度的升高而呈缓下降的趋势;80 ℃之后的提取率略有升高,但变化不大,并未超过70 ℃时的提取率,因此,中心组合实验提取温度的三个水平参数,选择60 ℃、70 ℃、80 ℃.
3.2.3 提取时间对波棱瓜花水溶性多糖提取率的影响
根据3.2.1 提供的最佳料液比(1∶30)、3.2.2 提供的最佳提取温度(70 ℃),不同提取时间对水溶性多糖提取率影响的结果见表4、图4.

表4 提取时间对水溶性多糖提取率的影响Table 4 Effect of time on the extraction yield of water-soluble polysaccharide
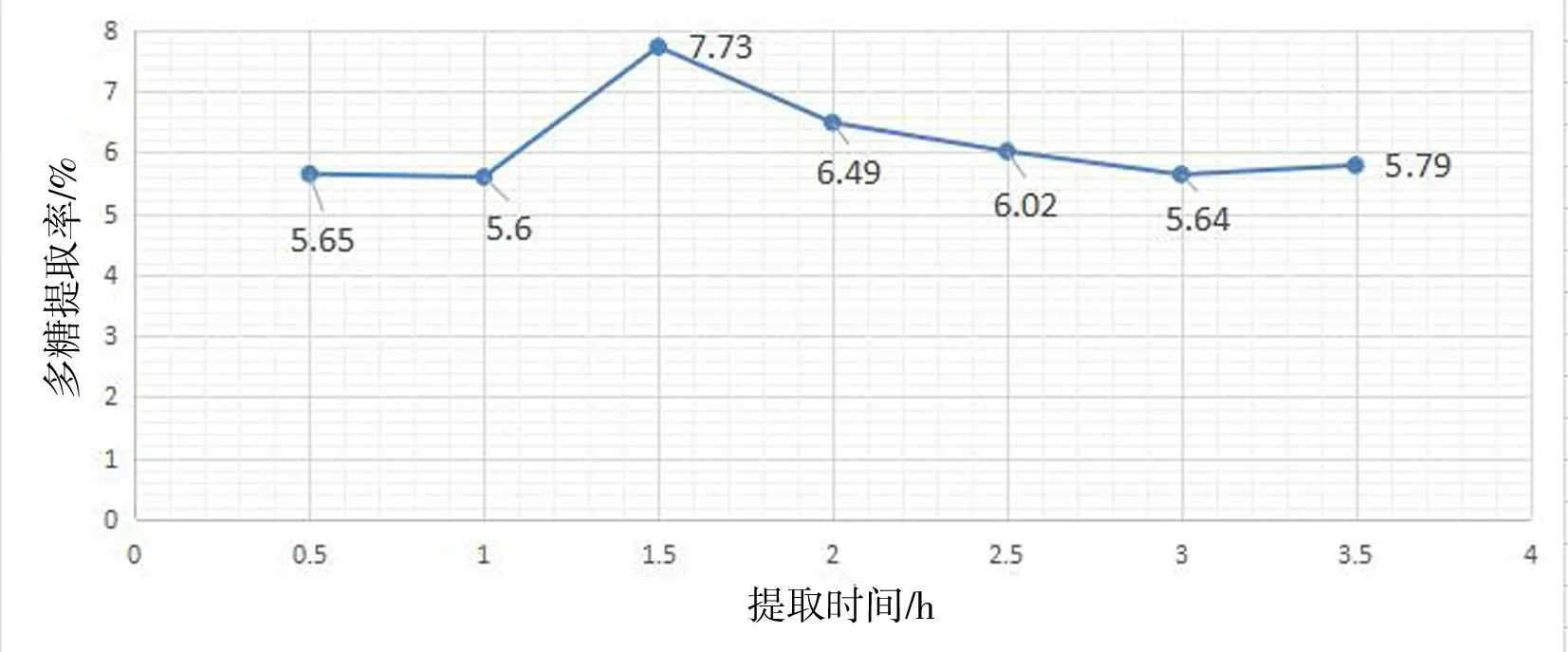
图4 浸取时间对水溶性多糖提取率的影响Fig.4 Effect of time on the extraction yield of water-soluble polysaccharide
表4、图4 表明:提取时间在0.5 ~1.5 h 之间时,波棱瓜花水溶性多糖提取率升高;提取时间在1.5 h~3 h 之间时,水溶性多糖提取率随提取时间的延长而下降;提取时间在1.5 h 时,多糖提取率最大;而提取时间在3 ~3.5 h 之间时,多糖提取率虽有上升,但上升幅度较小.提取时间再多,提取率不会升高,反而杂质的提取量会增加[19].因此选择1 h、1.5 h、2 h 作为中心组合实验时间的三个水平参数.
3.3 响应面实验
3.3.1 回归方程模型及方差分析
根据单因素实验的结果,选择料液比、提取温度、提取时间为自变量的影响因素,藏药波棱瓜花多糖的提取率为响应值,利用Design -Expert 软件中Box -Behnken 组合设计法进行3 因素3 水平的响应面优化试验;具体数据关于影响因素、影响水平和水溶性多糖提取率见表5 ~7.

表5 实验设计的因素及水平编码Table 5 The factors and level coding of experimental design

表6 Box-Behnken 试验设计与试验结果Table 6 Box-Behnken experimental design and results
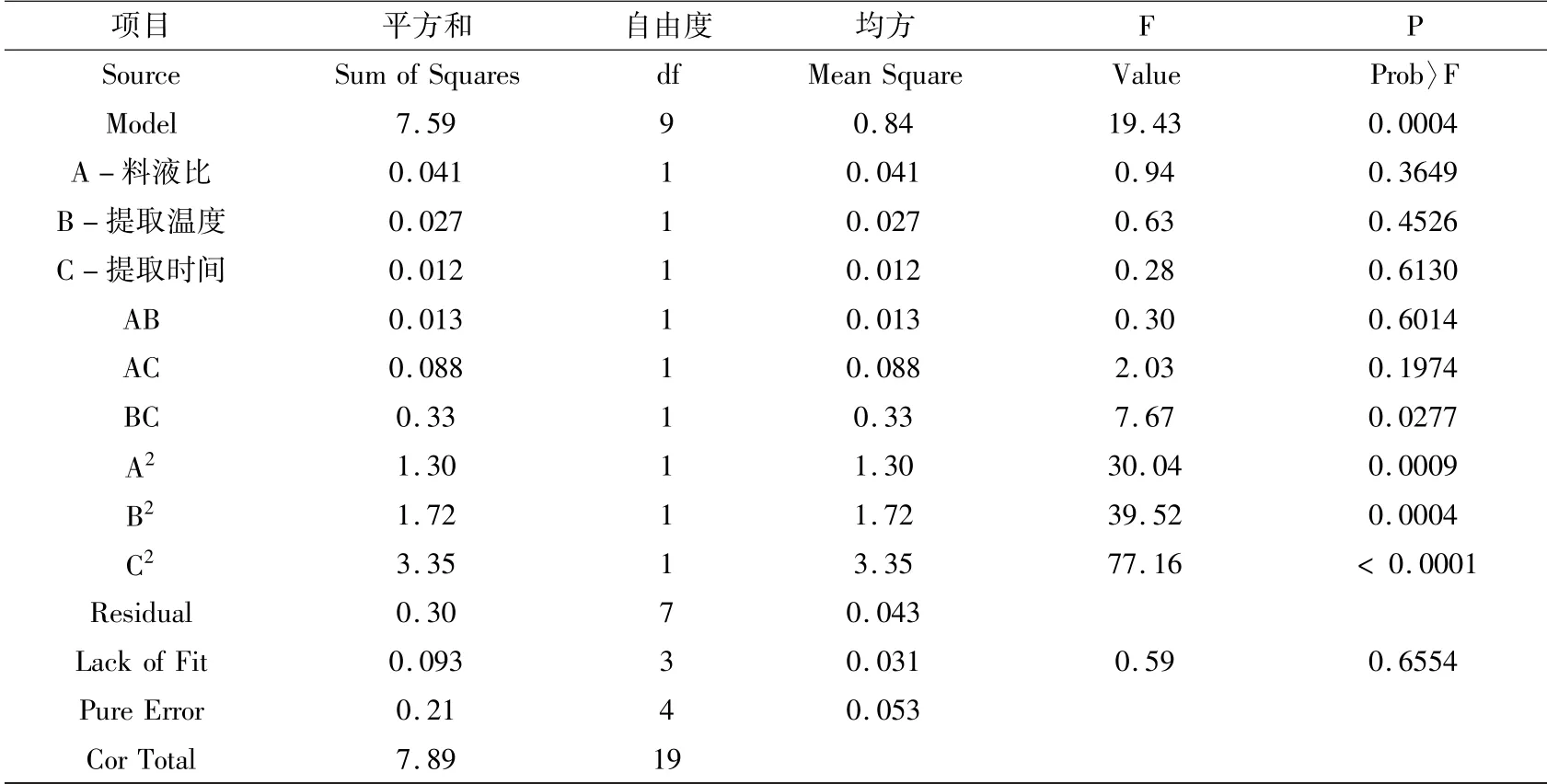
表7 回归模型方差分析Table 7 Variance analysis of regression model
将实验结果导入Design -Expert 软件进行分析,获得响应值与变异因素的多元二次回归方程模型.回归拟合后得到的波凌瓜花水溶性多糖提取率与各因素之间的回归方程为:
Y =6. 35 - 0. 071A +0. 059B +0. 039C +0.057AB-0. 15AC +0. 29BC -0. 56A2-0. 64B2-0.89C2.
通过对该二次多元回归模型进行显著性检验及回归模型系数显著性检验,检验结果表明:二次多元回归模型P 值=0.0004,小于0.01,表明该模型差异极显著;失拟项P =0.6554,大于0.05,无显著性差异,说明模型与试验值的差异较小. 从表中各因素的F 值和P 值可判断,对波棱瓜花水溶性多糖提取率影响最大的是提取温度与提取时间的交互作用;从单个因素来看,对提取率的影响力从大到小为:A(料液比) >B(提取温度) >C(提取时间).
3.3.2 两因素响应面分析
1)料液比和提取温度
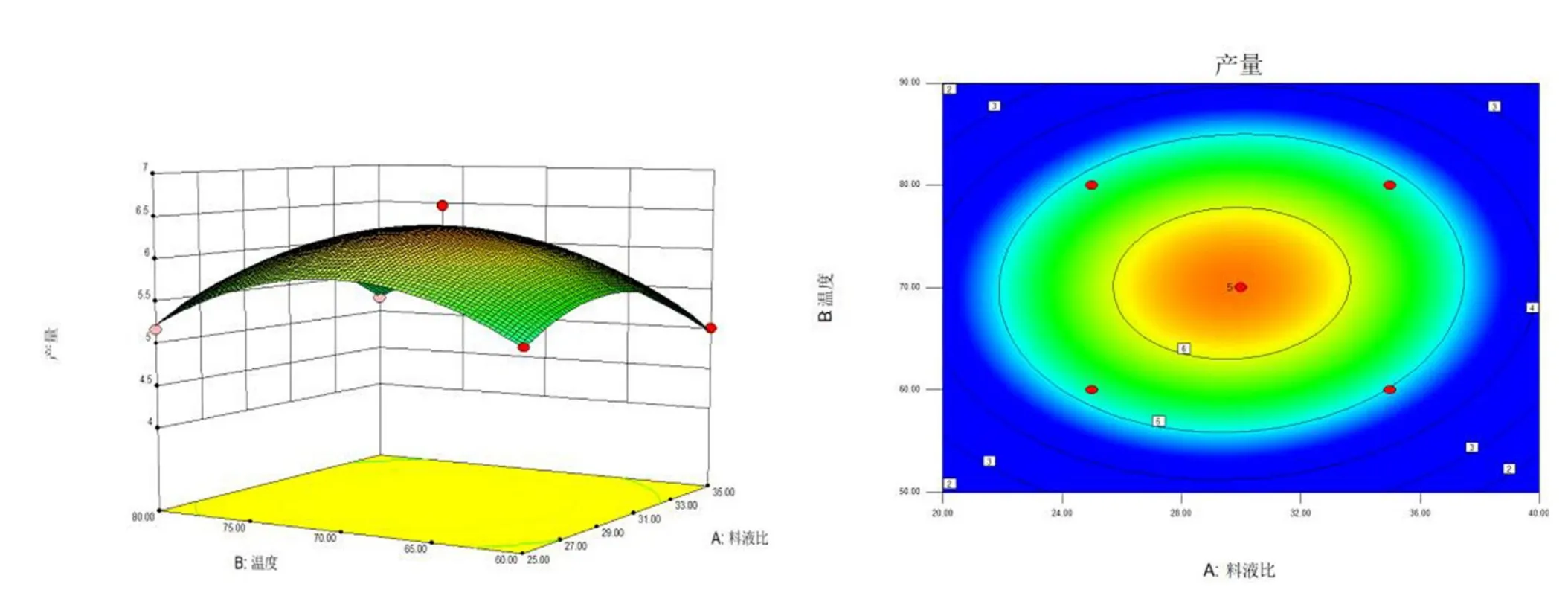
图5 料液比(A)与提取温度(B)交互作用对水溶性多糖提取率的影响Fig.5 Interactive effects of solid-liquid ratio(A) and extraction temperature(B) on the extraction rate of polysaccharide
将C(提取时间)作为零水平,绘制A(料液比)和B(提取温度)交互作用的响应面三维面及等高线图,结果见图5.
图5 表明:当提取温度为70 ℃、料液比为1∶30时,达到最高点,此时波棱瓜花水溶性多糖提取率最高;该响应面虽有最高点,但图形的变化不明显,起伏较低,较为平缓,说明提取温度在60 ~80 ℃,料液比在1∶30 左右时,其交互作用对水溶性多糖的提取率有一定影响,但影响不具显著性.
2)料液比与提取时间
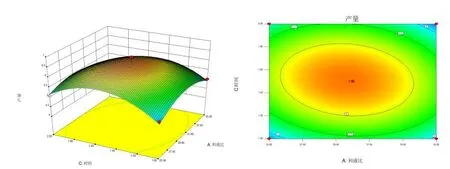
图6 料液比(A)与提取时间(C)交互作用对水溶性多糖提取率的影响Fig.6 Interactive effects of solid-liquid ratio(A) and extraction time(C) on the extraction rate of polysaccharide
将B(提取温度)作为零水平,绘制A(料液比)与C(提取时间)交互作用的响应面三维面及等高线图,结果见图6.
图6 表明:当料液比为1∶30,提取时间在1.5 h左右时,响应面有最高点,此时波棱瓜花水溶性多糖提取率最高,但是该响应面图形的变化起伏相对较低,说明料液比在1∶30,提取时间为1.5 h 时,其交互作用对水溶性多糖的提取率有一定影响,且显著性比料液比与提取温度(AB)的交互作用的更好.
3)提取温度与提取时间
将A(料液比)作为零水平,绘制B(提取温度)与C(提取时间)交互作用的响应面三维面及等高线图,结果见图7.
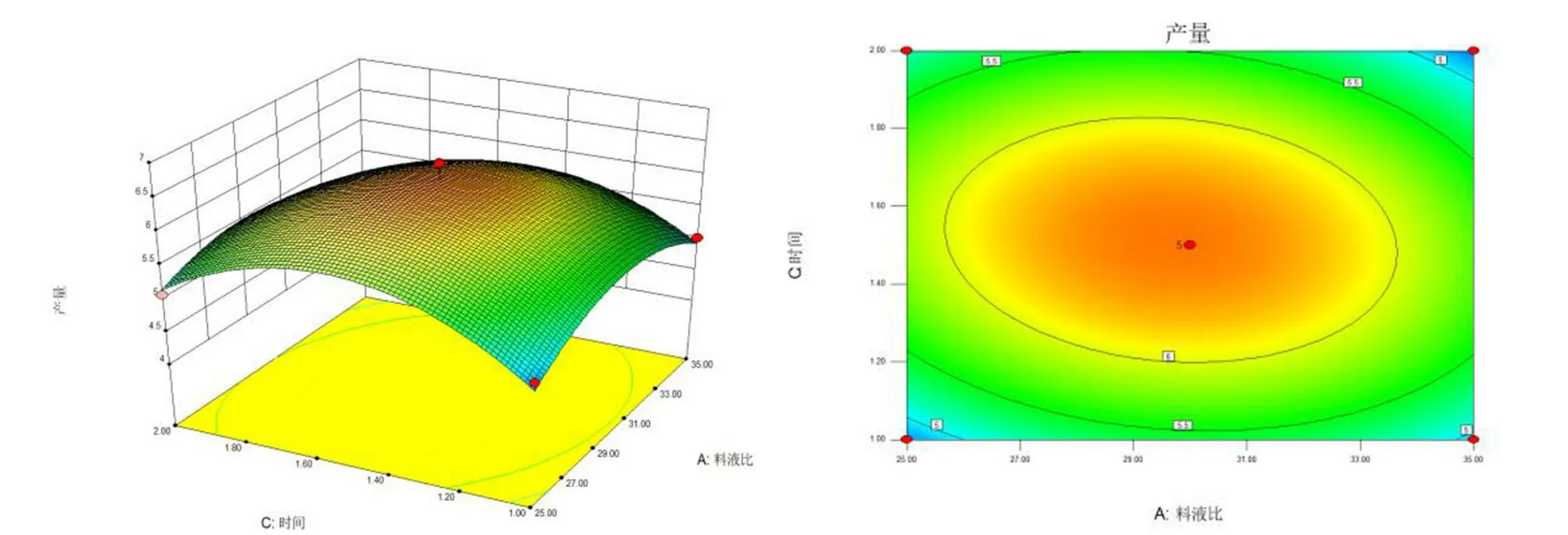
图7 提取温度(B)与提取时间(C)交互作用对多糖提取提取率的影响Fig.7 Interactive effects of extraction temperature(B) and extraction time(C) on the extraction rate of polysaccharide
图7 表明:当提取温度为70 ℃,提取时间为1.5 h,此时波棱瓜花水溶性多糖提取率达到最大,即响应面的最高点. 该响应面的等高图形为椭圆形,结合3D 响应曲面变化较大、陡峭弯曲,说明提取温度与提取时间(BC)的交互作用对水溶性多糖提取率影响十分显著.其中BC(提取温度与提取时间)的交互作用影响最显著.实验结果结合软件建议,确定最佳提取工艺为:料液比1∶30、温度70 ℃、时间1.5 h,在此提取条件下波棱瓜花水溶性多糖提取率理论值为6.59%.
3.4 重复性检测
综上所述,A 料液比、B 提取温度、C 提取时间对波棱瓜花水溶性多糖的提取率均有不同程度的影响,
按照确定的最佳提取工艺:料液比1 ∶30、温度70 ℃、时间1.5 h,重复进行5 次平行试验,结果见表8.

表8 重复性试验结果Table 8 Results of repeatability
根据Box -Behnken8.0.6.1 软件优化后的最佳工艺(料液比1∶30、提取温度70 ℃、提取时间1.5 h)及“响应值与变异因素的多元二次回归方程模型”,波棱瓜花水溶性多糖提取率的最大理论值为6.59%,在此条件下进行5 次平行实验,实际得到水溶性多糖提取率的平均值为6.35%,与理论值基本吻合.
4 讨论与结论
本研究参考孙翠翠等[12,20-22]研究并作技术改进,采用单因素实验结合响应面法(RSM)优化波棱瓜花水溶性多糖的提取工艺,具有经济、简便等特点.研究结果表明:料液比、提取时间和提取温度的二次项、提取温度和提取时间的交互项对波棱瓜花水溶性多糖提取影响比较显著.Box -Behnken8.0.6.1 软件优化后的最佳提取工艺:料液比1∶30、提取温度70 ℃、提取时间1.5 h,波棱瓜花水溶性多糖提取率的最大理论值为6.59%.按照单因素实验提供的最佳提取条件,重复进行5 次平行试验,获得波棱瓜花水溶性多糖实际平均提取率为6.35%,与理论值基本吻合. 因此,响应面法优化的波棱瓜花水溶性多糖提取工艺具有实践意义,为藏药波棱瓜花的深度开发利用提供了科学依据和研究材料.

