胸腺瘤Masaoka 分期与CT 特征相关性分析
王亨强,黄壮士,李荣耀,张文强,杨熙斌
(郑州大学第二附属医院胸外科,河南 郑州 450000)
胸腺瘤是一种起源于胸腺上皮细胞的肿瘤,绝大多数位于前纵隔,少数可位于颈部、胸膜、肺门及肺实质内。长期临床实践证实外科手术是目前治疗该疾病最有效的手段,并提出相应的分期方法指导其治疗。其中Masaoka 结合手术所见和病理,将胸腺瘤分为四期[1],得到普遍的认可。有研究显示对于Ⅲ期患者行术前辅助化疗,可提高其完整切除率[2]。但该分期最大的缺点是不能在术前对肿瘤侵袭情况进行预测。而CT 作为胸腺瘤的最常用诊断方法,可以较好地预示肿瘤的位置、大小、侵袭等情况。既往有学者对胸腺瘤CT 特点与WHO 组织学分型的相关性进行过研究[3-4],但对指导术前治疗的指导意义不大。而探索CT 特征与Masaoka 分期相关性可以在术前了解分期情况,使Ⅲ期胸腺瘤患者在术前辅助化疗中受益。
1 资料与方法
1.1 一般资料
回顾性分析2013 年1 月—2018 年1 月在我院治疗的109 例经病理证实的胸腺瘤患者的基本资料,其中有11 例行穿刺活检,98 例行手术治疗,男59 例,女50 例,中位年龄53(24~84)岁,其中合并有重症肌无力的42 例。
1.2 分期
采用Masaoka 分期方法,Ⅰ期:肉眼可见肿瘤局限在胸腺内,且镜下无包膜浸润;Ⅱ期:①肉眼可见侵犯邻近脂肪组织或纵隔胸膜;②镜下可见包膜侵犯;Ⅲ期:肿瘤侵犯邻近组织或器官,包括心包、肺或大血管;Ⅳa 期:肿瘤广泛侵犯胸膜和(或)心包;Ⅳb期:淋巴转移或血型转移。本研究中Ⅰ期22 例,Ⅱ期31 例,Ⅲ期45 例,Ⅳa 期8 例,Ⅳb 期3 例。
1.3 检查方法
所有研究对象术前均使用西门子双源炫速CT(SOMATOM Definition Flash)进行扫描,扫描方向从头到足位。扫描范围:胸廓入口至膈肌水平;扫描参数:X 线球管的管电压为120 kV、有效管电流为250 mAs。准直器为64 mm×0.6 mm,扫描层厚3 mm,重建间隔3 mm。X 线球管旋转时间0.33 s,螺距0.5,视野260 mm。所有患者均行增强扫描,采用双筒高压注射器经肘静脉注射70 mL 碘帕醇(330 mg/mL),流速为3.0 mL/s,同时以相同的流速注射20 mL 生理盐水,平扫结束约15 s 后行动脉期扫描,再延迟15 s 后行静脉期扫描。所有患者检查前均进行呼吸屏气训练,减少呼吸伪影对测量数据和图像质量的影响。
1.4 图像后处理及数据分析
由两位高年资影像医师采用双盲法进行阅片,所有扫描图像在3D 软件后处理中采用多层面体层重建技术,从不同的方位(矢状、冠状、轴位)进行观察,分析肿瘤如下CT 相关参数:大小(取最大横断面直径)、密度(均匀与否)、形状(圆形或椭圆形视为规则,分叶状及其他视为不规则)、边缘(边缘粗糙,不光整或有毛刺视为不规则),是否有钙化、坏死、淋巴结肿大(短径大于1 cm)、胸膜播散,是否存在侵袭(包括心包、肺和大血管、周围脂肪间隙)以及强化是否均匀等。定义侵袭时通常关注以下几点:如肿瘤与心包的界限不清,或存在心包积液则考虑侵犯心包;肿瘤与大血管界限不清或突入管腔考虑侵袭血管;肿瘤与肺界限不清考虑侵袭肺组织。意见不一致时由两位医师协商达成一致意见。
1.5 分组
通常根据胸腺瘤特征,分为非侵袭性胸腺瘤(Ⅰ期)和侵袭性胸腺瘤(Ⅱ~Ⅳ),但是在指导术前辅助治疗方面,早期胸腺瘤(Ⅰ,Ⅱ)和进展期胸腺瘤(Ⅲ,Ⅳ)的分类方法更实用[5-6],故将所有患者分为早期组和进展期组。
1.6 统计学分析
采用SPSS 21.0 软件进行统计分析。由于肿瘤大小为定量资料,早期组肿瘤大小为(55.00±24.13)mm,进展期组肿瘤大小为(69.43±18.12) mm,取其平均值62 mm 为界,将直径≥62 mm 定义为 “直径较大”。先对两组行χ2检验,选出P<0.05 者进入多因素Logistic 回归分析,最后将有统计学意义的项目进行多变量ROC 曲线分析。
2 结果
本研究中,早期组53 例(图1,2),进展期组56例(图3,4),将两组患者的CT 特点进行对比,结果见表1。其中密度不均、形态不规则、边缘不光滑、强化不均匀、坏死、淋巴结肿大、外侵、直径较大及胸膜播散有统计学差异。
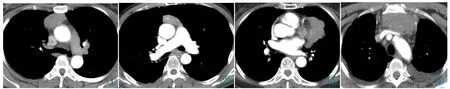
图1 女,40 岁,B2+B3 型,Masaoka Ⅰ期,前上纵隔椭圆形肿块,密度均匀,与纵隔结构分界清晰。图2 男,62 岁,B2 型,Masaoka Ⅱ期,前纵隔块状肿块,内可见点状钙化影,边界欠清。图3 女,61 岁,B3 型,Masaoka Ⅲ期,左侧中纵隔可见不规则肿块,边界模糊,部分层面与心脏紧贴,强化不均。图4 男,50 岁,B2 型,Masaoka Ⅳa 期,前纵隔不规则肿块,边界欠清,密度尚均匀,增强扫描可见轻度强化,心包及双侧胸腔内可见液性密度影,邻近肺组织略受压。Figure 1.Female,40 years old,type B2+B3,Masaoka stage Ⅰ.An oval mass in the anterior superior mediastinum with uniform density and clear margin.Figure 2.Male,62 years old,type B2,Masaoka stage Ⅱ.An anterior mediastinal mass,with punctate calcification and poor borders.Figure 3.Female,61 years old,type B3,Masaoka stage Ⅲ.An irregular mass in the left mediastinum with blurred borders,partial adhesion to the heart,and uneven enhancement.Figure 4.Male,50 years old,type B2,Masaoka stage Ⅳa.An irregular mass in the anterior mediastinum with poorly-defined margin,homogeneous density and slight enhancement.Fluid was shown in pericardium and bilateral pleural cavities with slight compression of adjacent lung tissue.
根据单因素分析结果,剔除钙化,将其余特点作为自变量,采用多因素Logistic 回归分析的方法对影响因变量的因素进行筛选,最终结果见表2。其中密度不均、边缘不光滑、强化不均匀、外侵、直径≥62 mm及胸膜播散有统计学差异(P<0.05)。
最后根据多因素Logistic 回归分析的结果进行ROC 曲线分析,以ROC 曲线下面积>0.5 为阈值,本组显示曲线下面积为0.910(图5)。
3 讨论
胸腺瘤因其形态学异质性,导致良恶性难以界定。WHO 组织学分类虽在揭示肿瘤生物学行为方面有一定的价值,但有研究显示在抽样标本中有近50%的胸腺瘤以混合型的形式存在,故该分类的临床意义被限制[7]。而且胸腺瘤很少出现血行转移和淋巴转移,故TNM 分期系统也不能很好的判断预后。Masaoka 分期被证实为胸腺瘤的预后因素,常用来指导肿瘤的治疗。通常临床上对于Ⅰ期、Ⅱ期的肿瘤标准的治疗为胸腺切除术,对于Ⅲ期胸腺瘤浸润周围结构的病例,手术无法完整切除,需要多学科评估是否应该术前行辅助治疗。有研究显示诱导治疗后行手术治疗可能使最初认为不能完整切除的胸腺瘤患者受益[8-10]。
但是Masaoka 分期是根据术中所见及术后病理结果提出的,其无法在术前预示肿瘤的具体分期,对指导肿瘤术前治疗意义不大。而CT 检查可以通过观察瘤体大小、密度、侵袭情况、与胸廓内器官(大血管、肺、心包、心脏)的关系,对临床分期和治疗方案提供可靠依据。故本研究主要探索CT 表现与Masaoka 分期相关性,以期在术前对肿瘤的分期做初步定性。

表1 两组患者CT 特点对比
本研究通过将两组CT 图像相关特征进行对比发现进展期组胸腺瘤密度不均、形态不规则、边缘不光滑、强化不均匀、坏死、淋巴结肿大、外侵、直径较大及胸膜播散的发生率高于早期组,该结果与较早前的研究结果比较一致[6,11-12]。再对两组存在统计学差异的CT 特点进行多因素Logistic 回归分析发现密度不均、边缘不光滑、强化不均匀、外侵、直径较大及胸膜播散为Ⅲ、Ⅳ期胸腺瘤关键的预测因子。有研究显示钙化在进展期胸腺瘤中较常见[5,13],但在本研究中无明显统计学差异,其原因可能由于本研究病例数量较少,其在两组中的真实差异未体现出来。
既往有研究认为肿瘤形状不规则提示为进展期胸腺瘤[6,12],在本研究中其虽在单因素分析中具有明显的统计学差异,但多因素Logistic 回归分析的结果提示该因素不是关键的预测因子,原因可能在于部分CT 特点内部存在混叠,如肿瘤与邻近组织存在重叠显影。在Masaoka 分期中,淋巴转移被归于Ⅳb期,但通常淋巴转移发生率低,本研究中共16 例(Ⅰ、Ⅱ期组3 例,Ⅲ、Ⅳ期组13 例),故其诊断价值未体现出来。
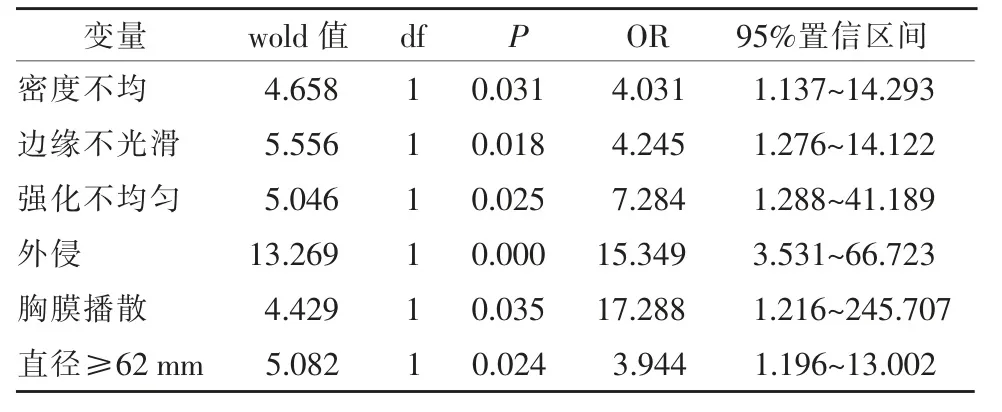
表2 Ⅲ、Ⅳ期预测因素的多因素Logistic 回归分析结果

图5 预测Ⅲ、Ⅳ期胸腺瘤的ROC 曲线,曲线下面积为0.910。Figure 5.The ROC curve of predicting stage Ⅲ,Ⅳthymoma with an area under the curve of 0.910.
通常认为在CT 图像中,如果肿瘤较大、成分叶状或与周围结构间的脂肪组织消失,则分期更接近于Ⅲ、Ⅳ期,但有研究认为肿瘤与周围结构间脂肪组织的消失无法精确的鉴定具体的分期[6,13]。故在本研究中将侵袭定义为:如肿瘤与心包的界限不清,或存在心包积液则考虑侵犯心包;肿瘤与大血管界限不清或突入管腔考虑侵袭血管;肿瘤与肺界限不清考虑侵袭肺组织。通过进一步分析,发现侵袭为Ⅲ、Ⅳ期胸腺瘤重要的预测因子。对此也有学者认为应多关注肿瘤在CT 成像上的浸润部位和浸润程度,使CT 特征与病理结果一致才是鉴定分期的关键[14],并提出肿瘤边缘不光滑,且与胸膜之间界限不清是最具侵袭性的征象,其灵敏度较其他指标高(56.52%),但其阳性预测值(PPV)仅为66.67%。在此基础上,当纵隔胸膜增厚或存在胸腔积液时其诊断特异性提高,分别为80%和90%。如上述3 个特征同时存在(Ⅳ级),特异性和PPV 均达到100%。因此,只要肿瘤与胸膜界限不清且胸膜增厚和/或胸腔积液基本可确定为进展期。
Marom 等[5]的一项多因素Logistic 回归分析显示肿瘤直径大于7 cm 为Ⅲ、Ⅳ期胸腺瘤的预测因子,本研究结果显示肿瘤直径大于62 mm,则更倾向于进展期。也有研究认为肿瘤大小与其分期无关[15],对此仍需大样本的研究去验证。进展期肿瘤由于生长较快,容易发生血运障碍导致肿瘤内部发生缺血坏死,造成密度不均,强化不均匀。Tomiyama 等[16]的研究结果也显示进展期胸腺瘤密度不均的发生率较早期为高。
通过多变量ROC 曲线分析,CT 对Masaoka 分期有较好的预判能力 (ROC 曲线下面积为0.910),但在实际工作中由于影像医师经验的不同,人为误差无法避免,导致CT 鉴别分期有一定的局限性,这就要求影像医师在平时的工作中多关注胸腺瘤大小、形状、密度、侵袭等情况,并尽量准确的进行诊断,与临床医生密切配合,在术前对肿瘤进行一个大体的定位、定性。
本研究采用了多因素Logistic 回归分析,由于病例数量有限,选择性偏移不可避免。所述的CT 特征皆是影像医师主观判断,且在创建模型时也存在不足之处,如侵袭一项设计较为宽泛,未细化,对侵袭部位及范围与分期的相关性未做具体的分析。需要在以后通过大样本的更加系统的研究去证实。
综上所述,胸腺瘤密度不均、边缘不光滑、强化不均匀、外侵、直径较大及胸膜播散等CT 特征与Masaoka 分期Ⅲ、Ⅳ期有较好的相关性,能在术前较好的区分早期和进展期胸腺瘤,使相应的患者在术前辅助治疗中受益。

