利用孤雌激活评估ICSI后未成熟卵母细胞的利用价值
刘成军 涂艳琴 王蔼明 商 微 王伟周 李 敏 沈玉良
1 肇庆西江医院生殖中心(肇庆526000) 2 海军总医院生殖中心(北京100048)
目前,不孕不育已经是世界各国都面临的一个挑战,试管婴儿技术的诞生为不孕不育患者带来的福音。当然,人类辅助生殖技术仍然是一个新的学科,还有很多问题未解决。在进行辅助生殖治疗的过程中,经常会有未成熟的卵母细胞,特别是行卵胞浆内单精子注射(intracytoplasmic sperm injection, ICSI)的患者。将这些卵母细胞直接丢弃很可惜,还有没有利用价值? 本文就ICSI后剩余未成熟卵母细胞的应用做了尝试。
1 材料与方法
1.1 实验对象
2008年—2012年生殖中心进行ICSI的患者,ICSI的原因为男方因素,女方年龄在22~35岁之间,女方卵巢功能正常。收集ICSI后未成熟卵母细胞GV期和MI期,随机分两组,一组先冷冻,解冻后再进行体外成熟培养,一组直接进行体外成熟培养。
1.2 实验试剂及设备
1.2.1 试剂 卵母细胞采用玻璃化冷冻方法冷冻保存,冷冻液分1~3液,1液为M-HTF(sage,USA)添加质量浓度为200 g/L的SPS,2液以1液为基础液添加质量浓度为80 g/L的DMSO和质量浓度为80 g/L的EG(V/V), 3液以1液为基础添加质量浓度为160 g/L的DMSO和质量浓度为160 g/L的EG(V/V)以及0.5 mol/L蔗糖。解冻液以冷冻液1为基础液添加蔗糖,浓度分别为1.0 mol/L、0.5 mol/L、0.25 mol/L、0.125 mol/L。体外成熟培养液以TCM199为基础液,添加质量浓度为100 g/L的SPS、0.075 IU/ML 重组FSH(雪兰诺,SWISS)+0.075 IU/ML 重组LH(雪兰诺,SWISS)、10 ng/mL EGF、0.6 mmol半胱氨酸、0.22 mmol丙酮酸钠,受精液、卵裂液、囊胚培养液为COOK公司生产,其余未注明厂家的用品均为美国Sigma公司生产。
1.2.2 设备 培养箱为美国产COOK桌面培养箱,倒置显微镜及体式显微镜为日本NIKON公司生产。
1.3 实验方法
1.3.1 卵母细胞冷冻方法,将冷冻液恢复到室温后,将未成熟卵母细胞放入冷冻液1中洗涤3次,然后转入冷冻液2中并计时,卵母细胞体积恢复后(6~12min)转入冷冻液3中,40~60s装入冷冻载体并投入液氮。卵母细胞解冻过程,首先将解冻液加热到37 ℃,然后将卵母细胞从液氮取出,快速投入1.0 mol/L蔗糖的解冻液,1分钟后先后转入0.5 mol/L、0.25 mol/L、0.125 mol/L蔗糖的解冻液中,时间分别为3、5、5min,最后转入体外成熟培养液。
体外成熟培养在37 ℃、体积分数为6%的CO2、体积分数为5%的O2的COOK桌面培养箱进行培养24~36 h,观察到卵母细胞排出第一极体为成熟。为了避免不同精子对胚胎发育的影响,本实验采用孤雌激活的方法进行激活卵母细胞。具体过程如下: 成熟后的卵母细胞转入含有10 μmol离子霉素(sigma,USA)的受精液中6min,再转入含2 mmol 6-DMAP(sigma,USA)的受精液中4 h,然后放入卵裂液中培养。
16~18 h后倒置显微镜下观察受精情况,有原核出现即为受精,并计算受精率。将受精后的胚胎转入新鲜的卵裂液中继续培养,第二天观察卵裂情况,记录卵裂胚胎数并计算卵裂率。第三天观察胚胎发育情况,7~9细胞,卵裂球大小基本均匀且碎片≤10%的胚胎为优质胚胎,计算优胚率。在第三天上午,观察胚胎完毕后将胚胎转入囊胚培养液中培养,分别在第5、6天观察囊胚形成情况,并计算囊胚率。
将数据录入SPSS 18.0软件,采用卡方检验分别比较GV、MI卵母细胞冷冻与新鲜组的成熟率、受精率、优胚率、囊胚率有无差异,P<0.05为差异有统计学意义。
2 结 果
GV卵母细胞冷冻后的成熟率、受精率、卵裂率较新鲜组虽然有所下降,但无明显差别(P>0.05),见表1。MI卵母细胞冷冻后的成熟率、受精率、卵裂率、优质胚胎率较新鲜组没有明显变化,见表2。新鲜GV期与MI期卵母细胞成熟率分别为73.91%、94.59%,有差异 (P=0.016);新鲜GV期与MI期卵母细胞成熟卵母细胞的受精率分别为67.65%、85.71%,但无统计学意义(P=0.075),见表3。为不同阶段冷冻卵母细胞的差别,从中可以看到GV、MI期卵母细胞解冻存活率、胚胎卵裂率及优质胚胎率均无差别,但卵母细胞成熟率有差异(P=0.020),而且受精率有差异(P=0.014),见表4。

表1 GV卵母细胞冷冻组与新鲜组的比较 例(%)
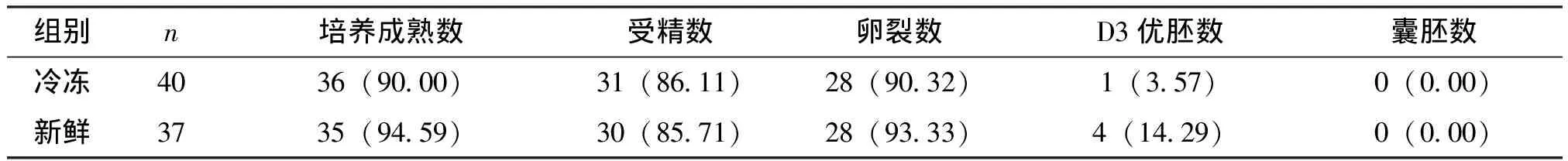
表2 MI 卵母细胞冷冻组与新鲜组的比较 例(%)

表3 新鲜GV与MI卵母细胞比较
注: 同列有字母标示的表示有差异(P<0.05), 成熟率有差异(P=0.016)

表4 冷冻GV与MI卵母细胞的比较
注: 同列有字母标示的表示有差异,成熟率有差异(P=0.020),受精率有差异(P=0.014)
3 讨 论
卵母细胞冷冻根据其的成熟度可以分为成熟卵母细胞和未成熟卵母细胞冷冻。目前卵母细胞冷冻是女性生育力保存的有效方法之一,同时也是比较常用的方法。由于卵母细胞是人类体积最大的细胞,冷冻时容易产生冰晶造成其损失,目前卵母细胞冷冻技术与胚胎冷冻技术相比还欠完善,但相对与卵巢冷冻技术比较简单,冷冻效果也比卵巢冷冻好很多,比较适用于年轻单身女性。自1986年澳洲Dr.Chen首次报告卵母细胞冷冻合并体外受精成功怀孕的例子后[1],约有十年的时间卵母细胞冷冻并没有明显之进展。这几年来在国内外学者的努力研究下,在技术上以及原理上已有长足的进步,MII期卵母细胞冷冻成功率大为提高,也在临床中得到了广泛应用。而玻璃化冷冻是冷冻新方法,在冷冻过程中由于细胞中的水份而容易形成冰晶,从而造成细胞膜及细胞内细胞器的损失,而玻璃化冷冻可以有效的降低这种损伤。玻璃化冷冻技术的基本原理是利用较高浓度的冷冻保护剂溶液,如乙二醇(EG)、二甲基亚砜(DMSO)等置换掉细胞内大部分的水份,同时利用高浓度蔗糖等大分子物质形成高渗溶液,使细胞进一步脱水,然后液氮等低温物质是细胞急速降温快速越过冰晶点温度,形成玻璃状的形态。目前卵母细胞的玻璃化冷冻技术优势明显,玻璃化冷冻的卵母细胞复苏率大大提高了,解冻后的受精率几乎和新鲜卵母细胞一样[2]。Cao等人对成熟卵母细胞慢速冷冻和玻璃化冷冻做了比较研究,结果发现玻璃化冷冻卵母细胞的复苏率、胚胎卵裂率和囊胚率均比慢速冷冻卵母细胞高[3]。
从原理上讲卵母细胞的冷冻损伤的程度和发育阶段有关系,GV期的卵母细胞冷冻后比MⅡ期卵母细胞存活率高[4],而且纺锤体异常率比MⅡ期卵母细胞低[5]。Michael等首次报道了采用慢速冷冻快速解冻方法,为一名28岁女性患者进行未成熟卵母细胞(GV期)冷冻解冻并ICSI受精,移植胚胎后顺利产下一名足月女婴[6]。Chian等人收集未成熟卵母细胞体外成熟并玻璃化冷冻,解冻后ICSI受精,患者产下一健康婴儿[7]。不过以上成功报道均是带有颗粒细胞未成熟卵母细胞的研究,未成熟裸卵的冷冻研究较少。本研究中,未成熟卵母细胞均为去除颗粒细胞的卵母细胞,冷冻解冻存活率大于88%,且冷冻组与新鲜组的体外成熟率、受精率、卵裂率、优质胚胎率及囊胚率均没有明显差异,说明未成熟卵母细胞的玻璃化冷冻未对卵母细胞的早期发育潜力产生明显影响。但不管是冷冻组还是新鲜组均无囊胚形成,说明本研究的体外成熟培养系统不够完善。当然,没有卵丘颗粒细胞也是卵母细胞成熟障碍一个重要因素。
卵母细胞的成熟是受精前的必要准备过程,可以简单的分为胞核成熟和胞质成熟。胞核的成熟机理研究比较早,一般由是否排除第一极体作为判断卵母细胞核成熟的标准,主要由细胞质蛋白、有丝分裂原激活蛋白激素(mitogen-activated protein kinase,MAPK)、成熟促进因子和细胞静止因子(cytological factor,CSF)等物质调节卵母细胞的核成熟。卵母细胞恢复减数分裂排出第一极体,过去一直被作为卵母细胞完全成熟的标志。但随着体外成熟培养及受精技术的开展,研究发现伴随减数分裂过程除细胞核发生相应的变化外,细胞质也发生某些相应的变化即胞质成熟,才能使卵母细胞完全具备受精及胚胎生长发育的能力[8-10]。近年来,有关胞质成熟的研究越来越多,胞质成熟作为卵母细胞成熟的一部分对卵母细胞的受精及胚胎发育都极其重要[11]。 卵丘颗粒细胞通过缝隙链接对卵母细胞的成熟担负运输营养物质、传递信号等作用。在动物试验中发现,GVBD的发生需要蛋白质的合成[12-14],而且从GV到MII期的转变以及排卵前MII期的停滞都需要蛋白质的合成[15-17]。在人类卵母细胞的成熟中,GVBD也需要蛋白质的合成[18-19]。Goud等人研究发现,GV期卵母细胞去除卵丘颗粒细胞在30小时的成熟率及受精后卵裂率明显降低,说明颗粒细胞能促进GV期卵母细胞胞核和胞质的成熟。同时发现添加EGF能显著提高去除颗粒细胞GV卵母细胞成熟率,但对受精率没有明显影响。这说明去除颗粒细胞的低成熟率可能和EGF的缺失有一定关系[20]。2008年Johnson等人对颗粒细胞对卵母细胞成熟的作用做了进一步对比研究,结果发现卵丘颗粒细胞对M I期卵母细胞成熟没有显著影响,但GV期卵母细胞去除颗粒细胞组和对照组相比成熟率显著下降(P<0.05)。试验共收集ICSI周期中239枚未成熟卵母细胞,成熟培养液为HTF添加10%代血清,过夜培养后100枚达到M II期,87枚经ICSI受精,结果正常受精54枚卵母细胞,最终得到7枚可利用囊胚。7枚囊胚均自M1期培养成熟,其中6枚囊胚来自有颗粒细胞组,只有1枚囊胚来自裸卵组。这说明卵丘颗粒细胞对GVBD有一定的作用,对MI期卵母细胞核成熟没有显著影响,但对胞质成熟促进作用[21]。2010年Reichman等人收集ICSI周期中未成熟卵母细胞并进行成熟培养,并与同周期体内成熟的卵母细胞做比较研究。试验共收集41个ICSI周期中去除颗粒细胞后未成熟卵母细胞263枚,成熟卵母细胞为234枚。成熟卵母细胞进行常规ICSI受精,263枚未成熟卵母细胞(GV期185枚,M I期78枚)在IVM-SAGE液中添加75 mIU/mL FSH 和75 mIU/mL LH培养24小时,以排出第一极体为成熟标志,结果GV期成熟63枚(35.1%),M I期成熟61枚(78.2%)。所有体外培养成熟的卵母细胞进行ICSI受精,结果发现受精率和体内成熟的卵母细胞没有显著差异,但胚胎发育能力明显降低,第二天胚胎质量明显降低,表现为4细胞胚胎比例降低,胚胎碎片增多,胞质不均匀胚胎增加。体外成熟卵母细胞共获得可移植胚胎54枚,冷冻30枚,移植24枚但均没有着床[22]。本研究中,GV卵母细胞的成熟率较MI期低,可能和颗粒细胞确实对GVBD造成了一定影响,与这些研究结果一致。同时也证明未成熟卵母细胞特别是MI期卵母细胞除去颗粒细胞后对其核成熟影响不大,但对胞质成熟影响较大。成熟卵母细胞受精后的发育潜力地下,表现为优质胚胎率低且无囊胚形成。2014年Nikiforaki等人研究表明,未成熟卵母细胞冷冻及体外成熟培养都影响卵母细胞受精过程中钙振荡[23]。鉴于此,对于ICSI后未成熟裸卵,利用价值有限,特别是GV期卵母细胞,未成熟卵母细胞特别是未成熟裸卵的体外成熟培养体系需要进一步优化。
综上所述,卵母细胞的冷冻技术和体外培养技术都取得了很大进展,但未成熟卵母细胞冷冻研究较少,仍有很多问题没有解决,卵母细胞体外成熟培养和体内成熟过程时间差异较大,也可能对卵母细胞存在潜在风险,仍需要进一步探讨。

