孟鲁司特钠辅助治疗哮喘-慢性阻塞性肺疾病重叠患者的临床疗效
朱念,金文静,王志华
哮喘指由嗜酸粒细胞、肥大细胞等多种细胞及细胞组分参与并以气道慢性炎性反应为特征的异质性疾病[1]。慢性阻塞性肺疾病(COPD)指以气流阻塞为特征的慢性支气管炎或肺气肿,可进一步发展为肺源性心脏病及呼吸衰竭等[2]。哮喘和COPD属于两种不同疾病,但较易混淆。临床中常发现病程迁延的哮喘患者存在气流受限;而部分COPD患者支气管舒张试验阳性,且使用糖皮质激素能有效提高其临床疗效[3]。因此,2014年初慢性阻塞性肺疾病全球防治创议(GOLD)增加了哮喘-慢性阻塞性肺疾病重叠(ACO)相关内容,并与全球哮喘防治创议(GINA)科学委员会共同制定ACO指南[4]。相关研究表明,ACO患者肺功能下降快,生活质量差,病死率高[5]。临床上以吸入性糖皮质激素联合长效支气管舒张剂作为ACO治疗的主要方式[6]。孟鲁司特钠为高选择性白三烯(LT)受体拮抗剂,可改善气道炎性反应及免疫功能,常用于中、重度哮喘治疗的联合用药[7]。本研究旨在分析孟鲁司特钠辅助治疗ACO患者的临床疗效,现报道如下。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)初次诊断为ACO者;(2)近4周内未接受过长效支气管舒张剂、LT受体拮抗剂或糖皮质激素治疗者。排除标准:(1)由支气管扩张、肺部感染、肺结核、肺栓塞等其他肺部疾病引发的咳嗽、喘息等症状者;(2)合并肺大泡、肺纤维化、气胸、出血倾向等肺功能检查禁忌证者;(3)合并心脏、肝脏等器官严重功能不全者;(4)合并血液、免疫等系统严重疾病或恶性肿瘤者;(5)对本研究所用药物过敏者;(6)妊娠期或哺乳期妇女;(7)治疗依从性差者。
1.2 一般资料 选取2017年10月—2018年10月上海市浦东医院收治的ACO患者92例,均符合《哮喘-慢阻肺重叠综合征指南》中的ACO诊断标准[8]。采用随机数字表法将所有患者分为对照组和试验组,每组46例。对照组患者中男34例,女12例;年龄40~72岁,平均年龄(51.1±8.7)岁;病程2~11年,平均病程(5.6±1.3)年;临床症状:咳嗽40例,咳痰36例,喘息38例,呼吸困难34例,胸闷29例。试验组患者中男33例,女13例;年龄42~71岁,平均年龄(50.2±8.2)岁;病程3~10年,平均病程(5.2±1.0)年;临床症状:咳嗽42例,咳痰33例,喘息36例,呼吸困难32例,胸闷26例。两组患者性别(χ2=0.051)、年龄(t=0.316)、病程(t=0.203)及咳嗽(χ2=0.113)、咳痰(χ2=0.522)、喘息(χ2=0.284)、呼吸困难(χ2=0.214)、胸闷(χ2=0.407)发生率比较,差异无统计学意义(P>0.05),具有可比性。本研究经上海市浦东医院医学伦理委员会审核批准,所有患者及其家属对本研究知情同意。
1.3 治疗方法
1.3.1 对照组 对照组患者给予常规对症治疗,包括减少运动负荷、氧气治疗;盐酸氨溴索片(上海勃林格殷格翰药业有限公司生产,国药准字H20030360)口服,30 mg/次,3次/d;噻托溴铵干粉雾剂(正大天晴药业集团股份有限公司生产,国药准字H20060454)吸入,18 μg/次,1次/d;沙美特罗替卡松粉吸入剂(法国葛兰素威康制药有限公司生产,国药准字H20150324)吸入,50 μg/次,2次/d;布地奈德粉雾剂(上海信谊百路达药业有限公司生产,国药准字H20080316)吸入,200 μg/次,2次/d;多索茶碱注射液(常州兰陵制药有限公司生产,国药准字H20103810)0.2 g+25%葡萄糖溶液40 ml静脉滴注,2次/d,静脉滴注时间应>20 min且两次静脉滴注间隔时间应>12 h。
1.3.2 试验组 试验组患者在对照组基础上给予孟鲁司特钠片(杭州默沙东制药有限公司生产,国药准字J20130047)辅助治疗,10 mg/次,1次/d,睡前口服。4周为1个疗程,两组患者均连续治疗2个疗程。
1.4 观察指标
1.4.1 临床疗效 比较两组患者治疗后临床疗效,临床疗效评价标准[9]:临床症状、体征基本消失,1周内未发生哮喘,肺功能明显改善为显效;临床症状、体征及肺功能明显好转,1周内哮喘发作次数减少1/2为有效;临床症状、体征、肺功能及哮喘发作次数均无变化甚至出现加重为无效。
1.4.2 疾病控制 比较两组患者治疗前后慢性阻塞性肺疾病评估测试(CAT)和哮喘控制测试(ACT)[3]。CAT共8个问题,总分40分,每个问题分为0~5级且对应分数为0~5分,<10分表示轻微影响,10~20分表示中等影响,21~30分表示严重影响,>30分表示非常严重影响。ACT共5个问题,总分25分,<20分表示未得到控制,20~24分表示控制良好但未完全控制,25分表示完全控制。
1.4.3 肺功能指标 由专业人员采用德国SPIROSTIK肺功能仪测量两组患者治疗前后早晨9:00~12:00第一秒用力呼气容积(FEV1)、第一秒用力呼气容积与用力肺活量比值(FEV1/FVC)、一氧化碳弥散量(DLCO)、呼出气一氧化氮浓度(FeNO)。
1.4.4 炎性因子 两组患者分别于治疗前后抽取清晨空腹静脉血10 ml,3 000 r/min离心10 min(离心半径10 cm),分离血清并置于-80 ℃环境保存待测,采用酶联免疫吸附试验(ELISA)检测白介素6(IL-6)和肿瘤坏死因子α(TNF-α),严格按照试剂盒(购自上海广锐生物科技有限公司)说明书进行操作。
1.4.5 不良反应 观察两组患者治疗期间不良反应发生情况。
1.5 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料分析采用χ2检验;等级资料分析采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 试验组患者临床疗效优于对照组,差异有统计学意义(Z=2.424,P=0.015,见表1)。

表1 两组患者临床疗效比较(例)Table 1 Comparison of clinical effect between the two groups
2.2 CAT及ACT评分 治疗前两组患者CAT评分和ACT评分比较,差异无统计学意义(P>0.05);治疗后试验组患者CAT评分低于对照组,ACT评分高于对照组,差异有统计学意义(P<0.05,见表2)。
表2 两组患者治疗前后CAT评分和ACT评分比较(±s,分)Table 2 Comparison of CAT score and ACT score between the two groups before and after treatment
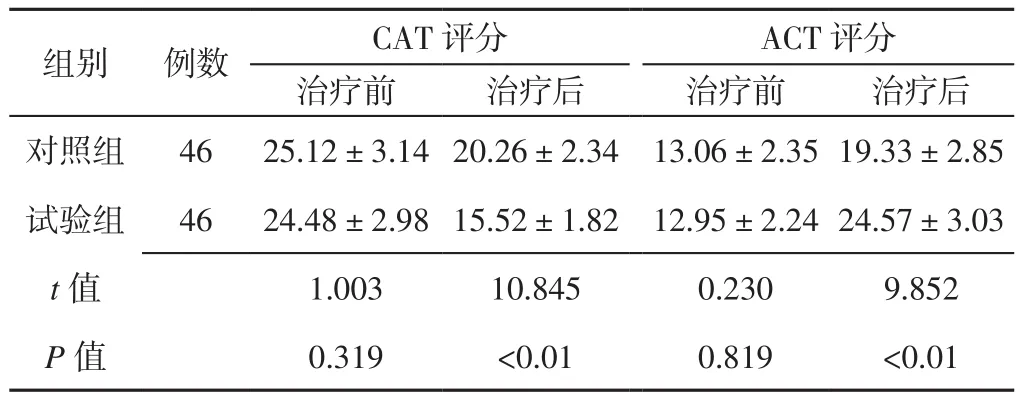
表2 两组患者治疗前后CAT评分和ACT评分比较(±s,分)Table 2 Comparison of CAT score and ACT score between the two groups before and after treatment
注:CAT=慢性阻塞性肺疾病评估测试,ACT=哮喘控制测试
组别 例数 CAT评分 ACT评分治疗前 治疗后 治疗前 治疗后对照组 46 25.12±3.14 20.26±2.34 13.06±2.35 19.33±2.85试验组 46 24.48±2.98 15.52±1.82 12.95±2.24 24.57±3.03 t值 1.003 10.845 0.230 9.852 P值 0.319 <0.01 0.819 <0.01
2.3 肺功能指标 治疗前两组患者FEV1、FEV1/FVC、DLCO、FeNO比较,差异无统计学意义(P>0.05);治疗后试验组患者FEV1、DLCO大于对照组,FEV1/FVC高于对照组,FeNO低于对照组,差异有统计学意义(P<0.05,见表3)。
表3 两组患者治疗前后肺功能指标比较(±s)Table 3 Comparison of index of pulmonary function between the two groups before and after treatment
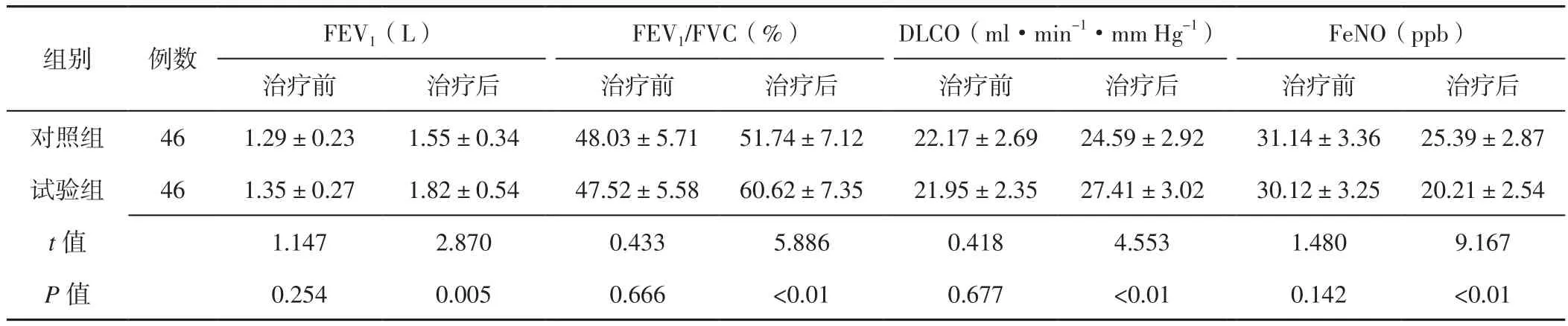
表3 两组患者治疗前后肺功能指标比较(±s)Table 3 Comparison of index of pulmonary function between the two groups before and after treatment
注:FEV1=第一秒用力呼气容积,FEV1/FVC=第一秒用力呼气容积与用力肺活量比值,DLCO=一氧化碳弥散量,FeNO=呼出气一氧化氮浓度
FEV1(L) FEV1/FVC(%) DLCO(ml·min-1·mm Hg-1) FeNO(ppb)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 46 1.29±0.23 1.55±0.34 48.03±5.71 51.74±7.12 22.17±2.69 24.59±2.92 31.14±3.36 25.39±2.87试验组 46 1.35±0.27 1.82±0.54 47.52±5.58 60.62±7.35 21.95±2.35 27.41±3.02 30.12±3.25 20.21±2.54 t值 1.147 2.870 0.433 5.886 0.418 4.553 1.480 9.167 P值 0.254 0.005 0.666 <0.01 0.677 <0.01 0.142 <0.01组别 例数
2.4 炎性因子 治疗前两组患者血清IL-6、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后试验组患者血清IL-6、TNF-α水平低于对照组,差异有统计学意义(P<0.05,见表4)。
表4 两组患者治疗前后炎性因子比较(±s,μg/L)Table 4 Comparison of inflammatory cytokines between the two groups before and after treatment
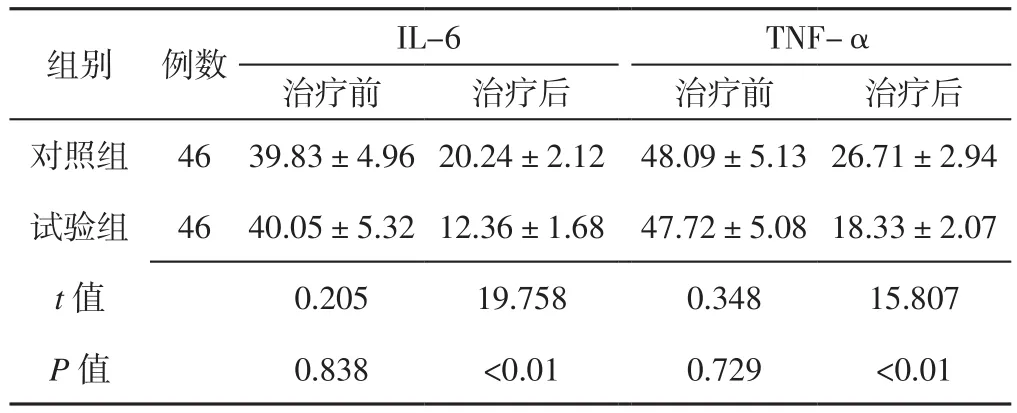
表4 两组患者治疗前后炎性因子比较(±s,μg/L)Table 4 Comparison of inflammatory cytokines between the two groups before and after treatment
注:IL-6=白介素6,TNF-α=肿瘤坏死因子α
组别 例数 IL-6 TNF-α治疗前 治疗后 治疗前 治疗后对照组 46 39.83±4.96 20.24±2.12 48.09±5.13 26.71±2.94试验组 46 40.05±5.32 12.36±1.68 47.72±5.08 18.33±2.07 t值 0.205 19.758 0.348 15.807 P值 0.838 <0.01 0.729 <0.01
2.5 不良反应 治疗期间,对照组患者出现胃肠道不适2例、皮疹1例,不良反应发生率为6.5%;试验组患者出现胃肠道不适1例、皮疹1例,不良反应发生率为4.3%。两组患者治疗期间不良反应发生率比较,差异无统计学意义(χ2=0.000,P>0.05)。患者症状均较轻,给予对症治疗后不良反应均消失。
3 讨论
ACO指以持续性气流受限为主要特征,同时具备部分哮喘和COPD特征的气道慢性炎性疾病[10],其发病机制较复杂且仍未完全明确,但多数学者认为其可能与气道结构破坏和重塑、气道炎性反应或气道高反应性导致肺功能损伤有关,且遗传、吸烟史、年龄等均为ACO主要发病原因[11-12]。
糖皮质激素是临床控制气道炎性反应最有效药物,其作用机制主要如下:糖皮质激素进入机体后与细胞质内的糖皮质激素受体结合成激素-受体复合物,通过影响细胞核内核酸的转录而发挥抗炎作用;此外,有研究发现,胸腺活化调节趋化因子(TARC)在哮喘患者气道上皮细胞呈高表达,而糖皮质激素能够完全抑制TARC在气道上皮细胞的表达,有利于减少药物使用,且安全性较高[13]。长效支气管舒张剂包括β2受体激动剂、抗胆碱药物和磷酸二酯酶抑制剂,其中噻托溴铵属于抗胆碱药物,对M1、M3受体具有高选择性作用,可通过阻止乙酰胆碱与M3受体相结合而抑制乙酰胆碱释放,促进环鸟苷酸水平升高,进而发挥支气管扩张作用[14]。沙美特罗替卡松属于长效β2受体激动剂,具有改善气道阻塞、扩张支气管平滑肌等作用,此外还能降低IL-6、TNF-α等气道炎性因子水平[15]。多索茶碱属于磷酸二酯酶抑制剂,为甲基嘌呤类药物,能够促进内源性肾上腺素和去甲肾上腺素释放,抑制腺嘌呤对呼吸道产生的收缩,同时可通过保护肥大细胞及抑制炎性递质释放而达到扩张支气管、抗炎等效果[16]。近年来,LT受体拮抗剂在哮喘、COPD治疗中逐渐受到临床重视,孟鲁司特钠为其代表性药物之一。本研究采用孟鲁司特钠辅助治疗ACO患者结果显示,试验组患者临床疗效优于对照组,治疗后试验组患者CAT评分、FeNO低于对照组,FEV1、DLCO大于对照组,ACT评分、FEV1/FVC高于对照组,说明孟鲁司特钠辅助治疗ACO患者的临床疗效确切,能有效控制患者疾病,改善患者肺功能,分析其可能为糖皮质激素、长效支气管舒张剂及孟鲁司特钠具有协同效应,可通过不同机制作用于ACO的各病理环节,进而提高患者临床疗效及改善其肺功能。
IL-6由T淋巴细胞、B淋巴细胞或上皮细胞等多种细胞产生,能够刺激并促进参与免疫反应的细胞增殖、分化并提高其功能。TNF-α能够促进中性粒细胞黏附至内皮细胞,刺激机体局部炎性反应。本研究结果显示,治疗后试验组患者血清IL-6、TNF-α水平低于对照组,提示孟鲁司特钠辅助治疗可有效降低ACO患者炎性因子水平,分析其原因可能是孟鲁司特钠能够降低LT诱导的黏附分子MAC-1表达及气道嗜酸粒细胞游走迁移,抑制白三烯D4(LTD4)引发的嗜酸粒细胞增殖、活化,减少气道嗜酸粒细胞浸润,并抑制由EOS浸润、杯状细胞或平滑肌细胞增殖和纤维化引发的气道重塑,进而降低炎性递质释放[17]。本研究结果还显示,两组患者治疗期间不良反应发生率比较无统计学差异,提示孟鲁司特钠未增加ACO患者的不良反应。
综上所述,孟鲁司特钠辅助治疗ACO患者的临床疗效确切,可有效控制患者病情,改善患者肺功能,减轻患者炎性反应,且安全性较高,有一定临床推广应用价值;但本研究为单中心研究、样本量较小,孟鲁司特钠辅助治疗对ACO患者的长期影响及具体作用机制等仍有待大样本量、多中心联合研究进一步证实。

