miR-21-5p对乳腺癌多西他赛耐药细胞株存活的影响及其机制研究
白 洁,英子伟,赵 林,李伟杰,王 聪,谢贤鑫,姜大庆
0 引言
随着化疗药物及靶向治疗药物的研发,乳腺癌患者的总生存率及复发率均有一定程度的提高[1],但是化疗耐药仍然是影响乳腺癌患者复发率及总生存期的最主要因素,最终导致治疗减效、无效及失败[2-3]。多西他赛(Docetaxel,Doc)在乳腺癌、胃癌及非小细胞肺癌等肿瘤中是最主要的化疗药物,为新一代紫杉类抗癌药,是有丝分裂抑制剂[4-8]。多西他赛与希罗达、顺铂及表柔比星等药物联合化疗在晚期乳腺癌化疗中发挥重要的作用[9-11]。多种miRNA在乳腺癌中为高表达,通过作用于靶基因调控多种恶性肿瘤细胞的增殖及凋亡等恶性行为,并与化疗耐药具有相关性[12]。有研究显示,miR-21对乳腺癌细胞增殖具有重要调控作用,Tumor-suppressor genes programmed cell death 4 (PDCD4)是miR-21的靶基因[13-14]。本研究通过Targetscan等靶基因预测分析软件,进一步对miR-21与PDCD4的靶向调控关系进行了预测分析,观察miR-21表达对Doc耐药乳腺癌细胞株存活的影响,并探讨其机制。
1 材料与方法
1.1 材料 人乳腺癌细胞株HCC1937购自中科院上海细胞库,通过Doc剂量阶梯递增方法建立稳转Doc耐药HCC1937/Doc细胞株,在中国医科大学肿瘤医院(辽宁省肿瘤医院)中心实验室培养传代。miR-21-5p mimics、miR-21-5p inhibitor、control mimics及control inhibitor购自英国Cohesion Biosciences公司,PDCD4多克隆抗体购自美国Sigma公司。miRNA提取及分离试剂盒、RT-PCR逆转录试剂盒购自立陶宛Fermentas公司,MTT试剂盒及All-in-OneTMqPCR Mix试剂盒购自美国Abcam公司。大连宝生生物技术有限公司对引物设计及合成,miR-21-5p forward:5′-CGTTGAATGTCACTCTGGTG-3′;reverse:5′-GGTCATTGTGTGCAGCTCAC-3′。GAPDH forward:5′-GGAGTGAGATCGAAGTGGC-3′;reverse:5′-GAGGATGATGATTAGTGGTC-3′。
1.2 转染试验 对数生长期HCC1937及HCC1937/Doc细胞消化为单细胞悬液,以20×104/孔细胞接种于24孔板,依据Lipo2000说明书对达到70%融合度的细胞株转染(miR-21-5p mimics、miR-21-5p inhibitor、control mimics及control inhibitor),转染过程完成后继续培养,48 h后qRT-PCR进行转染效率检测,准备进行下一步实验。
1.3 细胞生存率分析 将转染后的HCC1937/Doc及HCC1937细胞以8×103/孔的浓度加入96孔板,以0.05、0.5、5、50 μmol/L浓度梯度归于Doc处理48 h,以MTT试验分析细胞增殖率。加入5 mg/ml浓度的MTT液2 ml/孔,温育条件下放置4 h后弃上清,加入二甲基亚砜150 μl进行振荡以溶解结晶,以550 nm的波长用酶联免疫检测仪进行吸光度测定,独立实验重复3次,对平均值进行分析。
1.4 qRT-PCR 取拟进行试验的HCC1937/Doc及HCC1937细胞,总RNA提取及纯化依照Trizol试剂操作说明进行,分别以紫外吸收法和变性琼脂糖凝胶电泳法对RNA的质量及完整性进行检测。依次进行合成样品cDNA,采用qRT-PCR测定梯度稀释的标准品包括待测样品的管家基因,然后进行梯度稀释标准曲线的DNA模板绘制,qRT-PCR步骤测定待测基因,配制完成的PCR反应液上RT-PCR,PCR扩增反应。ΔΔCt法分析溶解曲线。
1.5 Western blot 对拟进行实验的HCC1937/Doc及HCC1937细胞预处理,对蛋白的浓度进行定量。对蛋白进行裂解后震荡摇匀,对总蛋白进行抽提操作,取上清液,采用BCA定量试剂盒对蛋白浓度进行定量分析。10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电转移到PVDF膜上。然后用5%脱脂奶粉在室温条件下进行90 min封闭后加Ⅰ抗,孵育12 h后加入Ⅱ抗,ECL进行显色。β-actin是内参照。以软件Quantity One进行灰度值的分析,结果以蛋白相对表达量=灰度值(目标蛋白)/灰度值(内参照蛋白)进行表示及统计。
2 结果
2.1 miR-21-5p调控HCC1937细胞对Doc敏感性 miR-21-5p mimic转染HCC1937/Doc细胞,结果显示,与对照组比较,miR-21-5p在HCC1937细胞中表达为对照组的212倍(P<0.05),Doc的ICD50(1.98±0.16)μmol/L明显高于NC组(0.78±0.06)μmol/L及control mimics组(1.08±0.17)μmol/L(F=77.54,P<0.001),HCC1937细胞培养48 h,细胞存活率呈剂量依赖性下降,但敏感性低于NC组及control mimics组,见图1A、图1C。
miR-21-5p inhibitor转染HCC1937/Doc细胞,结果显示,与对照组比较,miR-21-5p在HCC1937细胞中表达为对照组的0.52倍(P<0.05),Doc的ICD50(46.32±7.85)μmol/L明显低于NC组(110.54±7.92)μmol/L及control inhibitor组(109.41±9.57)μmol/L(F=202.4,P<0.001),HCC1937细胞培养48 h,细胞存活率呈现剂量依赖性下降,敏感性高于NC组及control inhibitor组,见图1B、图1D。
2.2 miR-21-5p调控PDCD4表达 通过靶基因预测软件TargetScan、Genecard等预测,PDCD4与miR-21-5p可能存在靶向调控关系,见图2A。qRT-PCR检测显示,在HCC1937/Doc细胞中PDCD4 mRNA表达明显低于HCC1937细胞(t=6.254,P=0.003),见图2B。Western blot检测显示,在HCC1937/Doc细胞中,PDCD4蛋白表达明显低于HCC1937细胞(t=5.942,P=0.004),见图2C;给予miR-21-5p mimic转染HCC1937/Doc细胞,qRT-PCR检测显示,PDCD4 mRNA表达明显低于NC组HCC1937细胞(t=6.583,P=0.003),见图2D。Western blot检测显示,PDCD4蛋白表达明显低于NC组HCC1937细胞(t=10.57,P=0.001),见图2E。给予miR-21-5p inhibitor转染HCC1937/Doc细胞,qRT-PCR检测显示,PDCD4 mRNA表达明显高于NC组(t=4.242,P=0.013),见图2F。Western blot检测显示,PDCD4蛋白表达明显高于NC组(t=4.611,P=0.009),见图2G。
3 讨论
miRNA作为内源性非编码RNA,对细胞功能具有重要的调控作用,与肿瘤的转移、侵袭、凋亡及增殖等具有相关性,并通过被上游基因调控或对下游基因进行调控,影响肿瘤细胞的化疗及放疗耐药[15-16]。多西他赛作为紫杉醇类化疗药,通过促进微管蛋白的聚合异常,抑制细胞有丝分裂过程中的纺锤体形成,从而影响微管的功能,破坏细胞有丝分裂,使肿瘤细胞停留在分裂期[17-18]。有研究显示,miR-141、miR-125及miR-452等miRNA对乳腺癌细胞Doc耐药均具有调控作用,其表达进行下调可以提高Doc耐药乳腺癌细胞对Doc的敏感性[15-16]。miR-21在乳腺癌中表达上调,PDCD4在乳腺癌中表达下调。Rodrigues等[19]研究显示,在肝细胞癌中,miR-21对PDCD4具有负向调节作用。
本研究显示,给予miR-21-5p mimic转染HCC1937/Doc细胞,HCC1937细胞的Doc敏感性进一步降低,而给予miR-21-5p inhibitor转染HCC1937/Doc细胞,HCC1937细胞的Doc敏感性改善,并具有剂量依赖性。结果表明,上调miR-NA-21表达降低HCC1937细胞对Doc敏感度,下调miRNA-21改善HCC1937细胞对Doc的敏感性。miR-21-5p可能对乳腺癌细胞Doc敏感性具有直接或间接的调控作用。Hu等[20]对Doc耐药的MCF-7乳腺癌细胞给予miR-452拟似剂或抑制剂,结果显示,miR-452通过靶向调控APC4(Adenomatous polyposis coli,结肠腺瘤样息肉)基因影响MCF-7的Doc敏感性。He等[2]认为,miR-944对乳腺癌细胞的化疗耐药也具有重要的调控功能。Zhao等[5]研究显示,miR-638通过调控STARD10信号通路介导乳腺癌细胞的Doc耐药。Zhou等[21]研究认为,miR-125b通过调控Bak1基因表达影响紫杉醇对乳腺癌细胞凋亡的促进作用,诱导乳腺癌细胞的紫杉醇耐药。本研究进一步显示,在HCC1937/Doc细胞中,PDCD4 mRNA及蛋白表达明显低于对照组,给予miR-21-5p mimic转染HCC1937/Doc细胞,PDCD4 mRNA及蛋白表达明显低于对照组,给予miR-21-5p inhibitor转染HCC1937/Doc细胞,PDCD4 mRNA及蛋白表达明显高于对照组。结果表明,miR-21-5p对PDCD4具有负向调控作用,miR-21-5p作为促癌基因,负向调控抑癌基因PDCD4,从而介导HCC1937细胞对Doc的化疗敏感性。Venturutti等[13]研究认为,对乳腺癌细胞中miR-21表达进行上调,可以诱发PDCD4表达水平降低,PDCD4是miR-21调控的下游靶基因。在多种恶性肿瘤中miR-21高表达,是促癌基因,PDCD4是miR-21的靶基因,可能作为恶性肿瘤治疗的靶点[22]。Frankel等[14]研究也显示,在乳腺癌细胞中PDCD4是miR-21重要的下游靶基因,miR-21通过对PDCD4基因表达进行调控,介导乳腺癌细胞的增殖、凋亡及浸润等恶性行为。
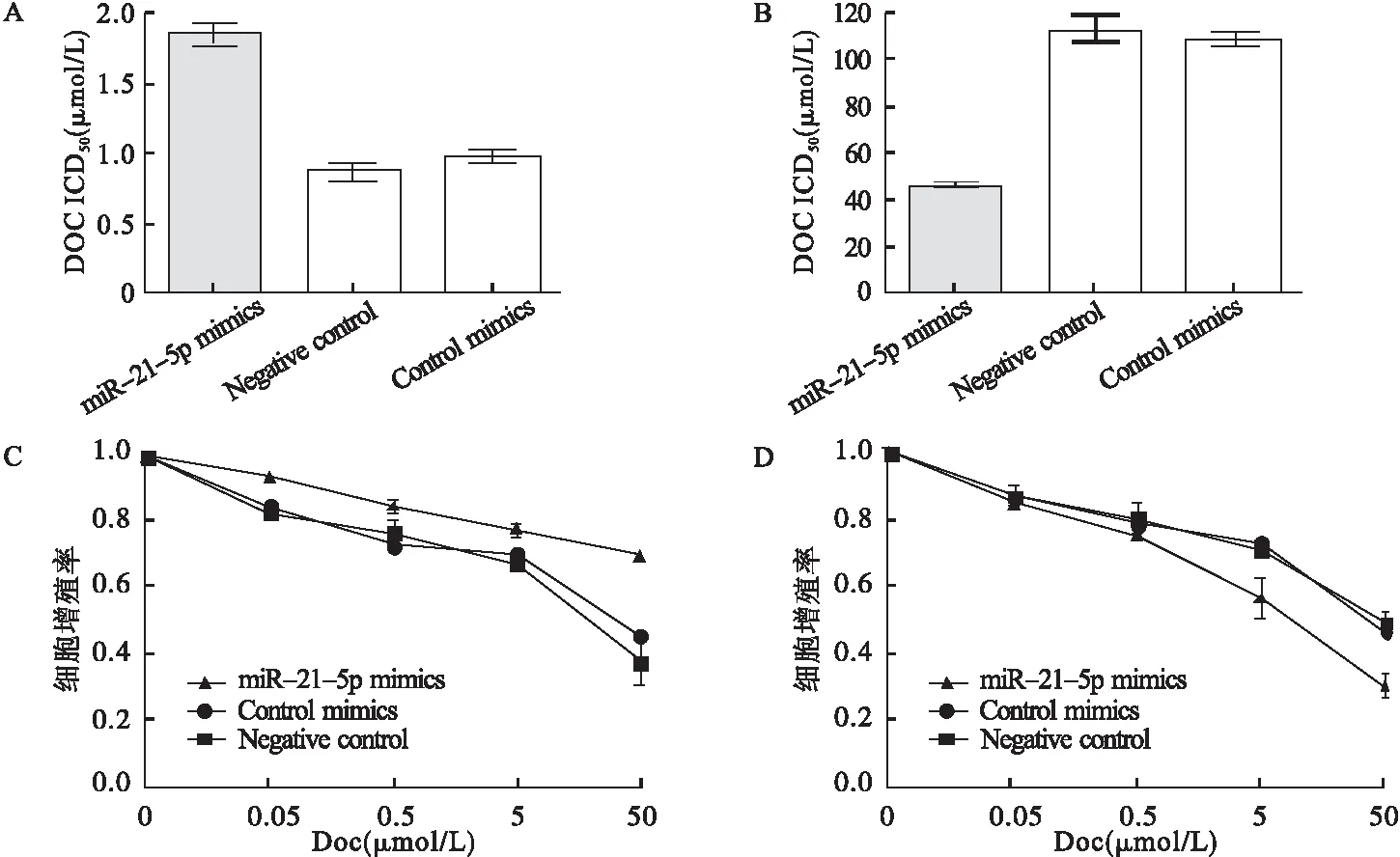
图1 miR-21-5p调控HCC1937细胞对Doc敏感性
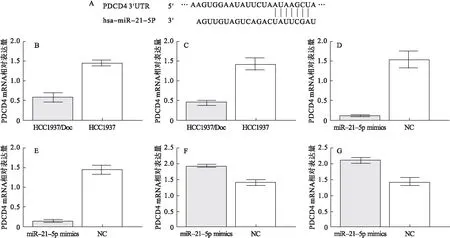
图2 miR-21-5p调控PDCD表达
靶向治疗可能是提高晚期乳腺癌生存期的主要治疗和研究方向[23],本研究通过观察miR-21-5p对乳腺癌HCC1937细胞Doc耐药的影响,结果显示,对miR-21-5p表达进行下调,可能通过上调PDCD4表达改善乳腺癌细胞的Doc敏感性,miR-21可能作为逆转乳腺癌化疗耐药的治疗靶基因。

