辛伐他汀抑制过表达HER2型结直肠癌的肿瘤血管生成
李 刚,郑君华,徐 斌,凌 杰,邱 伟,王永兵
0 引言
结直肠癌(CRC)是世界范围内最常见的恶性肿瘤之一[1],早期诊断发现,大约有25%的CRC患者出现转移,另有50%的患者会发展为转移[2]。虽然新的细胞毒性和分子靶向试剂可以改善CRC患者的整体存活率,但是复发和失败的速率仍然很高。
血管生成不仅为肿瘤的生长提供氧气和营养物质,以促进癌细胞的增殖,其对于转移、肿瘤细胞向附近组织或远处器官的迁移也是必需的[3]。抗血管生成的治疗策略已经成为重要的抗肿瘤(尤其是转移性肿瘤)治疗方法之一。血管内皮生长因子(VEGF)在大多数癌细胞中过度表达,已成为抗血管生成治疗的主要靶点[4]。人表皮生长因子受体-2(HER2)是表皮生长因子受体家族的一员,与VEGF诱导的实体肿瘤血管形成呈正相关[5]。血管生成生长因子HER2-VEGF在许多不同类型的恶性肿瘤中过表达,促进了多种类型细胞的肿瘤血管生成[6-7]。
他汀类药物是3-羟基-3-甲基戊二醛辅酶A(HMG-CoA)还原酶抑制剂,通过阻止HMG-CoA转化为甲戊二酸酯来降低胆固醇合成。他汀类药物主要用于治疗高脂血症,以减少心血管疾病,但近年研究表明,他汀类药物对包括癌症在内的多种疾病都有治疗作用,通过参与血管生成、增殖、凋亡和转移相关途径发挥抗癌作用。有报道,辛伐他汀通过抑制NF-κB调控胃癌血管生成和转移,强化卡培他滨对胃癌的治疗效果[8];通过阻止HIF-1诱导的血管生成因子抑制乳腺癌的血管生成[9]。然而,辛伐他汀是否会影响CRC的血管生成未见相关研究。本研究旨在探讨辛伐他汀对CRC细胞血管生成的影响,并初步探讨其分子机制。
1 材料与方法
1.1 主要材料 CRC细胞株(HCT116、HT-29、LoVo、SW480、Caco-2)以及人类脐带内皮细胞(HUVECs)均购于上海中科院细胞库。HCT-116和HT-29细胞培养于RPMI-1640培养基中;SW480、LoVo和Caco-2细胞在DMEM培养基中培养;HUVECs在内皮细胞生长培养基2中培养。所有细胞株都在37 ℃、5% CO2的恒温箱中培养。
1.2 裸鼠移植瘤模型 本实验方案经上海健康医学院附属上海市浦东新区人民医院批准。将2.0×106HCT-116和LoVo细胞通过皮下注入BALB/c小鼠左后侧。9 d后,将小鼠随机分为2组(每组8只),治疗组小鼠注射辛伐他汀50 mg/(kg·d),对照组每日注射0.1 ml磷酸盐缓冲盐水。每4 d用卡尺监测肿瘤体积,根据下列公式计算:体积=长度×宽度2×0.5。4周后处死小鼠,对肿瘤组织进行免疫组化分析。
1.3 收集肿瘤细胞培养基(TCM) 1.0×106个HCT-116或LoVo细胞接种于6孔板中,采用0.2 μg辛伐他汀或HRG-β1(50 ng/ml)或辛伐他汀+HRG-β1共同预处理72 h。孵育后,肿瘤细胞培养基在2 000 r/min下离心10 min,去除细胞碎片,-80 ℃储存用于实验分析。
1.4 Matrigel小管形成实验 Matrigel基质胶在96孔板上涂覆30 min。将含12 000个HUVECs的无血清培养基或75% TCM加入到各个小室中孵育12 h。采用垂直显微镜记录小管图像,使用ImageJ 2x软件测量血管网络的长度。
1.5 MTT实验 HUVECs接种于含有200 μl TCM的96孔小室中。过夜孵育后,每个小室加入20 μl MTT试剂。4 h后移除培养基,并加入150 μl二甲基亚砜,使紫色沉淀物完全溶解。轻轻摇动10 min后,使用微板读出器测定每个孔490 nm处的光学密度值。
1.6 迁移和侵袭实验 采用伤口愈合试验来评估细胞迁移。当细胞达到90%汇合时,用无菌移液管尖端在细胞单层上建立一个伤口。细胞洗2次后,用含有50 μg辛伐他汀的无血清培养基,或者含有50 ng/ml HRG-β1的无血清培养基,或者含有辛伐他汀和HRG-β1的无血清培养基重新培养,预处理12 h。最后用光学显微镜观察伤口闭合情况并拍照。
Transwell实验检测细胞侵袭能力。稀释Matrigel基质胶添加到小室中孵化。然后将悬浮在150 μl无血清培养基中的细胞添加到上室中,将含50 μm辛伐他汀的无血清培养基,或50 ng/ml HRG-β1的无血清培养基,或其混合物添加到下室。24 h后,用棉签刮掉上室中的非侵入细胞。侵入细胞用4%的聚氧甲基苯乙烯固定15 min,然后用晶体紫色染色10 min。最后,6个随机区域的染色细胞在显微镜下计数并拍照。
1.7 Western blot 肿瘤组织或细胞在液氮中粉碎,RIPA裂解液裂解蛋白提取上清液。提取蛋白质并使用BCA法进行蛋白质定量。进行SDS-PAGE并转膜后孵育抗体,ECL化学发光检测抗体。
1.8 免疫组织化学分析 将肿瘤标本嵌在石蜡中,随后切成4 μm厚的切片,用内皮细胞标记物CD31对肿瘤切片进行免疫标记,观察肿瘤组织中的血管形成情况。
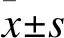
2 结果
2.1 HER2和VEGF蛋白在CRC细胞株中的表达 Western blot结果显示,p-HER2、VEGF在LoVo、SW480、HCT116细胞中表达升高,在HT-29和Caco-2细胞中表达降低。见图1。结果表明,致癌因子HER2表达与VEGF表达呈正相关,提示HER2参与CRC血管生成可能与VEGF相关。
2.2 辛伐他汀抑制CRC血管生成 TCM中培养的HUVECs比在无血清培养基培养具有更长的管状结构(图2A)。然而,辛伐他汀预处理的TCM培养的HUVECs小管的长度较未处理的小管产生明显减少,但比在无血清培养基中产生的小管稍长。HUVEC的增殖是血管生成的一个关键因素,通过MTT法检测HUVEs活力,结果显示,辛伐他汀能够显著阻断CRC细胞培养基,促进HUVECs增殖(图2B)。结果提示,辛伐他汀可能抑制HER2+CRC细胞中血管生成信号的分泌。
2.3 辛伐他汀对肿瘤血管生成和HER2活性的抑制作用 与对照组相比,辛伐他汀治疗组中CD31染色明显降低(图3A)。辛伐他汀治疗可以抑制肿瘤的血管生成,降低微血管密度。辛伐他汀明显降低p-HER2在肿瘤组织中表达水平(图3B)。Western blot结果进一步证实辛伐他汀能够降低p-HER2在细胞中蛋白表达(图3C)。然而,HER2 mRNA分子水平没有受到影响(图3D)。此外,辛伐他汀治疗后,肿瘤重量和肿瘤体积明显低于对照组(图3E、图3F)。结果表明,HER2参与了辛伐他汀抑制肿瘤生长和血管生成过程。
2.4 辛伐他汀体外阻断HRG-β1/HER2-诱导的血管生成 辛伐他汀显著抑制HUVECs迁移、侵袭、血管生成和增殖能力,而HRG-β1处理HCT-116细胞培养基诱导HUVECs迁移、侵袭、血管生成和增殖能力。辛伐他汀明显阻止了HRG-β1对细胞迁移、侵袭、血管生成和增殖能力的影响。结果表明,辛伐他汀能够阻断HRG-β1/HER2-诱导的体外血管生成。见图4。
2.5 VEGF抑制剂参与辛伐他汀诱导减少血管生成过程 图5A、图5B结果显示,VEGF在辛伐他汀处理组的表达较对照组明显降低;VEGF在HRG-β1处理组的表达较对照组升高,而辛伐他汀降低了HRG-β1诱导的VEGF表达。贝伐单抗(BEV)、HRG-β1或者两者共同处理CRC细胞,其细胞培养基培养HUVECs,即使HG-β1存在,BEV也能够显著抑制HUVECs增殖(图5C)。此外,辛伐他汀可以阻断VEGF诱导的HUVECs增殖(图5D)。
3 讨论
近年来,有学者认为,他汀类药物是潜在的癌症治疗药物。多项研究表明,他汀类药物的抗癌活性是通过抑制内皮细胞的增殖和迁移以及诱导细胞凋亡来实现的。例如,洛伐他汀降低胰腺癌的肿瘤生长以及抑制胃癌细胞增殖[10-11];甲伐他汀抑制黑色素瘤细胞的增殖和侵袭[12];辛伐他汀抑制甲状腺癌细胞增殖和迁移[13]。辛伐他汀通过上调PEA3、降低HER2表达而诱导HER2阳性乳腺癌细胞凋亡[14]。辛伐他汀可能通过激活HIF-1缺氧的上游调控者,促进或抑制血管生成,其还会干扰炎症下游的血管生成信号[15]。
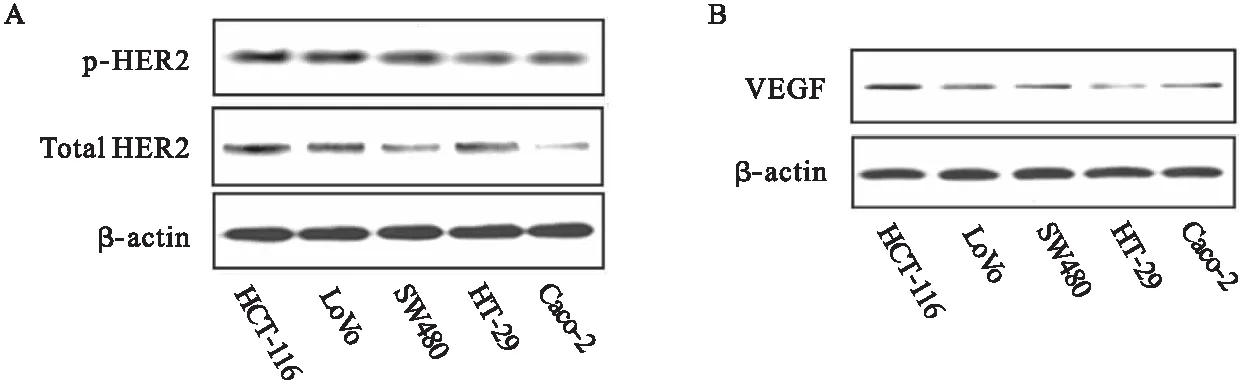
图1 HER2和VEGF蛋白在CRC细胞中的表达
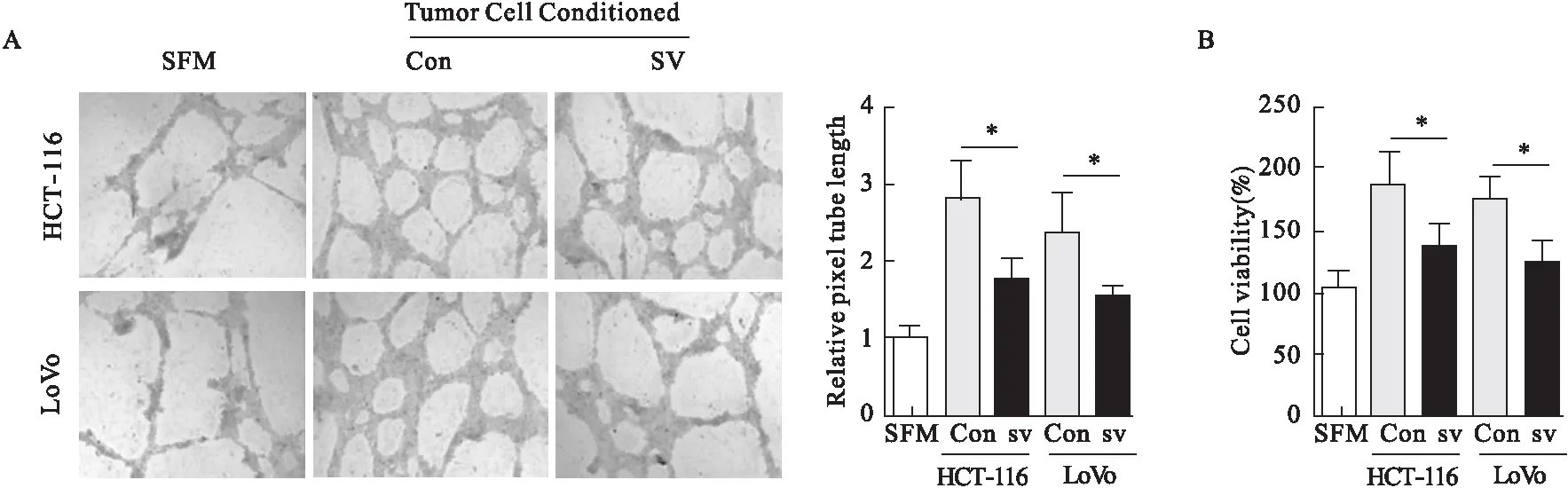
图2 辛伐他汀抑制CRC血管生成
图3 辛伐他汀对肿瘤血管生成及HER2活性的影响
注:A.免疫组化染色CD31+在肿瘤组织中表达,定量肿瘤切片微血管密度;B、C.p-HER2在肿瘤组织(B)和肿瘤细胞(C)中蛋白表达;D.检测p-HER2 mRNA在肿瘤组织中表达;E.肿瘤重量;F.肿瘤体积
HER2属于EGFR家族的一员,在CRC细胞系中表达上调,与肿瘤内VEGF相关的血管形成呈正相关。VEGF是一种生理和病理上的新血管化的关键调节剂,参与HER2引起的肿瘤细胞血管生成[16]。在本研究中,我们首先检测了HER2和VEGF在CRC细胞系中的表达,发现HER2和VEGF在这些细胞中表达均上调,特别是在HCT-116和LoVo细胞中。此外,本研究显示辛伐他汀在体内和体外抑制HER2信号通路以及肿瘤血管生成。结果表明,辛伐他汀抑制血管生成可能是通过抑制HER2的表达而发生。
HRG-β1是表皮生长因子家族中的一员,由间充质细胞分泌,并能通过转运和磷酸化促进HER3或HER4形成异二聚体来间接激活HER2[17]。HER2过表达通过降低配体分离率大大增强了HRG与受体的结合亲和力,而HER2降低则减弱了配体结合亲和力与HER2信号。本研究发现,辛伐他汀通过抑制高水平p-HER2肿瘤细胞的血管生成细胞因子的分泌,显著损害了HRG-β1诱发的血管生成。即使在低HER2水平下,HRG-β1也可以通过上调VEGF表达促进肿瘤血管生成。此外,在HRG-β1的孵育下,BEV可以显著抑制CRC细胞培养基诱导的HUVEC细胞增殖。在肿瘤细胞培养基中加入辛伐他汀,可以阻断VEGF对细胞增殖的抑制作用。研究表明,VEGF参与了HER2诱导的CRC细胞血管生成过程,这可能使其成为辛伐他汀抑制肿瘤血管生成的重要靶点。
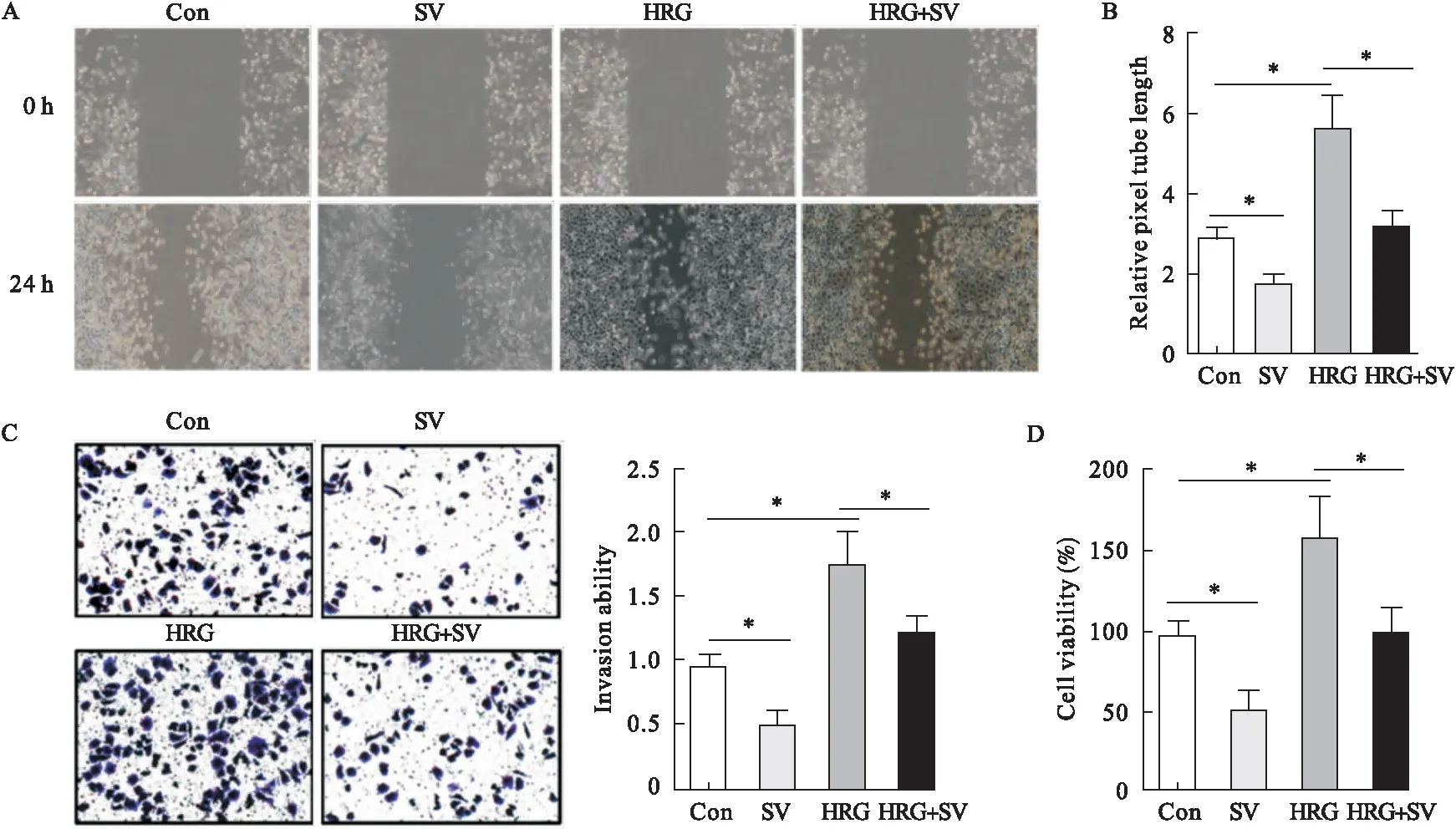
图4 辛伐他汀体外阻断HRG-β1/HER2-诱导的血管生成
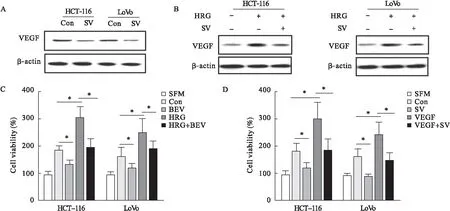
图5 VEGF抑制剂参与辛伐他汀诱导减少血管生成过程
总之,本研究结果表明,辛伐他汀通过调节HER2/VEGF轴来抑制肿瘤的血管再生。抗血管生成可以通过阻碍血管生成过程以及使肿瘤血管正常化而使肿瘤细胞对化疗药物敏感,提示辛伐他汀对异常肿瘤血管的重塑可增强许多现有治疗方法的效果。

