酶解-超声辅助联用提取塔尔米多糖
敬思群 张俊艳 王德萍
(韶关学院英东食品科学与工程学院1,韶关 512005) (新疆大学生命科学与技术学院2,乌鲁木齐 830046)
塔尔米(PanicummiliaceumL.)是新疆哈萨克族人们喜爱的一种传统食品,形状类似于俗称的小米, 色泽金黄、颗粒饱满[1],《本草纲目》中称黏者为黍,不黏者为稷;民间又将黏者称黍子(脱壳后俗称为黄米),不黏者称糜子,塔尔米即属于不黏的一类。新疆塔尔米主要分布在塔城、伊犁等地,具有超强的抗逆性,其优良的耐干旱能力、较短的生长周期、较高的产量(亩产200 kg)。塔尔米蛋白质质量分数12%左右, 最高可达14%以上;淀粉质量分数70%左右,糖分含量低,适合糖尿病患者食用,可降血脂、降血压,营养价值高[2]。赵正梅等人研究发现塔尔米30%乙醇提取物的抗氧化性最强[3],尚未见对其水提物的研究报道。
多糖传统的提取方法为水提醇沉,具有能耗高、提取率低等缺点[4],目前,关于多糖提取方法已有较多报道,有超声辅助提取[5]、酶解提取[6]、超临界流体提取[7]等。超声破碎是利用超声波振动传递能量,改变物质组织结构、状态、功能或加速这些改变过程,从而提高多糖得率,缩短提取时间,降低提取液黏度[8,9]。酶解提取反应条件温和,近年来已经广泛应用于天然药用植物有效成分提取[10-11],由于塔尔米淀粉含量高达70%以上,传统的水提醇沉提取塔尔米多糖时,由于大量淀粉的糊化而使水提过滤困难,采用α-淀粉酶可以解决此问题。
由于超声波所产生的的空化等特殊作用,可以将植物中所含化学成分快速高效地提取出来,通过单因素实验和U10(106)均匀设计确定了超声辅助提取塔尔米多糖的最适超声参数;另一方面,鉴于塔尔米高的淀粉含量而影响多糖的提取效果,考察pH值、酶解温度及酶解时间对多糖提取率和纯度的影响,采用L9(34)正交实验确定了酶解和超声辅助联用提取塔尔米多糖的最优工艺。
1 材料与方法
1.1 材料、试剂与仪器
生塔尔米全粉:自制(磨粉,过60目筛);α-淀粉酶、 1, 1-二苯基-2-三硝基苯肼(DPPH·,纯度>97%)、2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+·,纯度>98%)、抗坏血酸(VC,纯度>99.8%);其他试剂均为分析纯。
RE-52AA旋转蒸发器;Anke TDL-5-A离心机;SIM真空冷冻干燥设备;512GD紫外-可见光分光光度计;RHA-1000A型中草药粉碎机。
1.2 塔尔米多糖提取工艺流程
传统水提醇沉提取塔尔米多糖工艺流程:
塔尔米→干燥→粉碎→加水混匀→热水浸提→多次抽滤→脱蛋白→离心→浓缩→醇析→沉淀→洗涤→干燥→塔尔米粗多糖→含量测定
超声提取塔尔米多糖工艺流程:
塔尔米→干燥→粉碎→加水混匀→超声波处理→热水浸提→多次抽滤→脱蛋白→离心→浓缩→醇析→沉淀→洗涤→干燥→塔尔米粗多糖→含量测定
酶解-超声辅助联用提取塔尔米多糖工艺流程:
塔尔米→干燥→粉碎→加水混匀→调pH值(6.5)→加酶→灭酶→超声波处理→热水浸提→多次抽滤→脱蛋白→离心→浓缩→醇析→沉淀→洗涤→干燥→塔尔米粗多糖→含量测定
操作要点:将塔尔米放入烘箱中干燥后磨成细粉,过60目筛,加水混匀调pH值至6.5,按液料比20 ∶1加入α-淀粉酶,酶解pH 6.5,在50 ℃水浴锅中加热30 min后在90 ℃下灭酶5 min,冷却至室温;然后以水做溶剂,采用超声辅助提取(超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,回流提取时间3 h),重复提取3次,合并上清液,上清液用Savege 法去蛋白,V( 三氯甲烷)∶V( 正丁醇)= 5 ∶ 1[12],将除去蛋白的多糖溶液浓缩至 1 /3,浓缩后的溶液加入3倍体积的95%的乙醇进行醇沉[13],沉淀用无水乙醇洗涤3次。将得到的多糖进行冷冻干燥并称重。
1.3 多糖提取率、纯度的计算
多糖提取得率=粗多糖样品质量/塔尔米质量×100%
多糖纯度=多糖质量/粗多糖质量×100%
1.4 超声辅助提取塔尔米多糖单因素实验
超声时间对塔尔米多糖提取率的影响:料液比1 ∶20,在40 ℃、120 W条件下分别经超声处理10、15、20、25、30 min,然后回流提取(90 ℃),提取时间2 h,以塔尔米多糖提取率为指标,确定最适超声处理时间。
超声温度对塔尔米多糖提取率的影响:料液比1 ∶20,分别在温度为30、40、50、60、70 ℃条件下超声处理25 min(超声功率为120 W),然后回流提取2 h,以塔尔米多糖提取率为指标,确定最适超声温度。
超声功率对塔尔米多糖提取率的影响:料液比1 ∶20,在60 ℃条件下分别经60、80、100、120、160 W超声处理25 min,然后回流提取2 h,以塔尔米多糖提取率为指标,确定最适超声功率。
液料比对塔尔米多糖提取率的影响:料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30,超声处理(60 ℃、140 W)25 min,然后回流提取2 h,以塔尔米多糖提取率为指标,确定最适料液比。
水浴提取温度对塔尔米多糖提取率的影响:料液比1∶20,超声处理(60 ℃、140 W) 25 min,然后分别经60、70、80、90、100 ℃水浴回流提取2 h,以塔尔米多糖提取率为指标,确定最适提取温度。超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,提取时间3 h,液料比20∶1。
水浴提取时间对塔尔米多糖提取率的影响:料液比1∶20,超声波处理(60 ℃,140 W) 25 min,然后分别经90 ℃回流提取2、3、4、5、6 h,以塔尔米多糖提取率为指标,确定最适提取时间。
1.5 酶解-超声辅助联用提取塔尔米多糖最优工艺的确定
以下实验塔尔米粉皆先经酶解,然后再采用超声辅助提取的最优工艺条件(液料比20∶1,超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,回流提取时间3 h)提取得到塔尔米多糖,以多糖提取率和纯度为指标,考查pH值、酶解时间、酶解温度对酶解-超声辅助联用提取工艺提取效果的影响。
1.5.1 单因素实验
pH值对塔尔米多糖提取率和纯度影响:塔尔米粉与α-淀粉酶比例为1∶0.1,料液比1∶20,室温下搅拌充分接触溶解,然后分别调节pH值为5.5、6.0、6.5、7.0、7.5,恒温水浴温度为55 ℃,酶解30 min,再将其置于 90 ℃ 的水浴锅中5 min使酶失活后,按超声辅助提取的最优工艺条件提取塔尔米多糖,以塔尔米多糖提取率和纯度为指标,确定最适的酶解pH值。
酶解时间对塔尔米多糖提取率的影响:塔尔米粉与α-淀粉酶比例为1∶0.1,料液比1∶20,室温下搅拌充分接触溶解,然后调节pH值为6.5,恒温水浴温度为55 ℃,酶解时间分别为15、20、25、30、35 min,其余操作同上,确定最适的酶解时间。
酶解温度对塔尔米多糖提取率的影响:塔尔米粉与α-淀粉酶比例为1∶0.1,料液比1∶20,室温下搅拌充分接触溶解,然后调节pH值为6.5,分别在50、55、60、65、70 ℃下恒温水浴30 min进行酶解,其余操作同上。
1.5.2 L9(34)正交优化实验
在单因素实验基础上,选取影响塔尔米多糖提取效果各因素中有意义的水平做正交实验,并进行方差分析,以确定最佳的酶解条件。采用 L9(34)正交实验优化酶解工艺,以pH值、酶解时间、酶解温度作为3个考察因素,选取3个水平进行实验。
1.6 塔尔米多糖抗氧化性分析
总抗氧化能力测定:参照Pulgarín[15]方法。吸取不同浓度样液1 mL,加入磷酸盐缓冲液(pH6.6)和1% K3Fe(CN)6溶液各2.5 mL,混合后于50 ℃放置20 min,加入10%TCA溶液2.5 mL混匀,吸取2.5 mL,加入蒸馏水和0.1%FeCl3溶液各2.5 mL,混匀,室温下静置10 min,于700 nm处测定吸光度(A),根据公式计算清除率。
WA=A-A0
式中:WA为总抗氧化能力;A为样品吸光度;A0为空白对照。
清除DPPH·自由基能力测定:参照宋烨威等[16]的方法。用无水乙醇将DPPH·试剂配制成2×10-4mol/L的溶液。准确吸取样品待测溶液、DPPH·溶液各2 mL,混匀后室温下放置30 min,于波长517 nm处测定吸光度。按公式计算各待测样品对DPPH·自由基的清除率。

式中:Ai为2 mL样品溶液+2 mL DPPH·乙醇混合液的吸光度;Aj为2 mL样品溶液+2 mL无水乙醇混合液的吸光度;Ac为2 mL DPPH·溶液+2 mL无水乙醇混合液的吸光度。
ABTS·+自由基清除能力测定:参照Cano等人[17]的方法。将2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS·+) 用蒸馏水配制成7.4 mmol/L溶液。取0.2 mL溶液与0.2 mL 2.6 mmol/L K2S2O8溶液混合均匀,避光放置12~16 h后,稀释40~50倍,用磷酸盐缓冲液将ABTS·+溶液稀释至吸光度为0.70±0.02得到工作液。将塔尔米多糖用95%乙醇稀释为5个不同浓度溶液。取0.2 mL塔尔米多糖溶液加入1.9 mL ABTS·+工作液混匀,震荡10 s,静置6 min后,于波长734 nm处测定吸光度。按公式计算各待测样品对ABTS·+自由基的清除率。以95%乙醇作为空白对照,测吸光度A0。
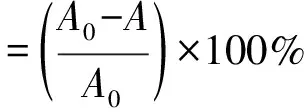
式中:A为样品吸光度;A0为空白对照。
2 结果与分析
2.1 超声辅助提取塔尔米多糖单因素实验
由图1可知,随着超声时间的延长塔尔米多糖提取率增大,在25 min达到最大值后变化不大,考虑到实际生产的效益,超声时间选25 min较为合适;随着超声温度的升高塔尔米多糖提取率增大,在60 ℃时达到最大值,随后稍有下降。由于超声过程中介质吸收超声波后,将其转化成热能,从而导致物料内部温度升高较快,对塔尔米多糖有一定的破坏作用。综上得知,超声温度选60 ℃较为合适;可看出塔尔米多糖提取率在140 W时达到最大,随后稍有下降。这是由于随着超声波功率的增强,所产生的空化作用和机械振动效应增强等,促使更多活性物质释放扩散到溶剂中,影响了塔尔米多糖的溶出。综上得知,超声功率选140 W较为合适;塔尔米多糖提取率随着液料比的增大而增大,在液料比为1∶25时达到最高,随后稍有下降。这可能是由于塔尔米多糖在溶液中具有一定的溶解度,在塔尔米多糖溶解达到饱和时,过量的塔尔米不再溶解,提取率不再提高。综上得知,液料比选25∶1较为合适;塔尔米多糖提取率随着提取温度的升高而增大,在90 ℃时达到最大值,随后稍有下降。可见较高的提取温度有利于多糖的溶出,但过高的温度会使粗多糖降解,反而不利于提高提取率。综上得知,提取温度选90 ℃较为合适;随着提取时间的延长塔尔米多糖提取率增加,当提取时间超过3 h时,提取率随着时间的延长缓慢下降。是因为塔尔米多糖充分溶出之后,再增加提取时间会导致溶液中的多糖降解,从而使提取率下降。纯度也呈类似的变化,只是在F图中显示当时间为4h时时纯度最大,考虑能耗问题,提取时间选3 h较为合适。
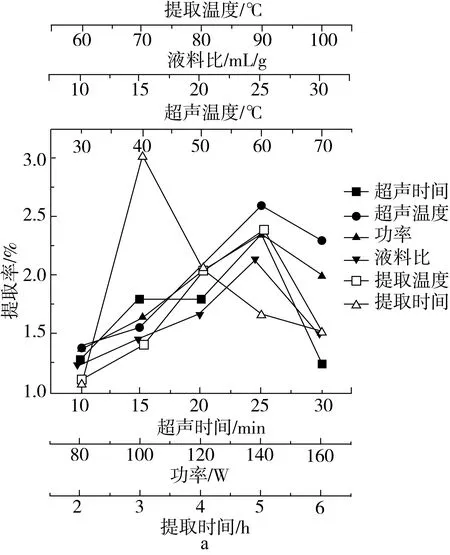
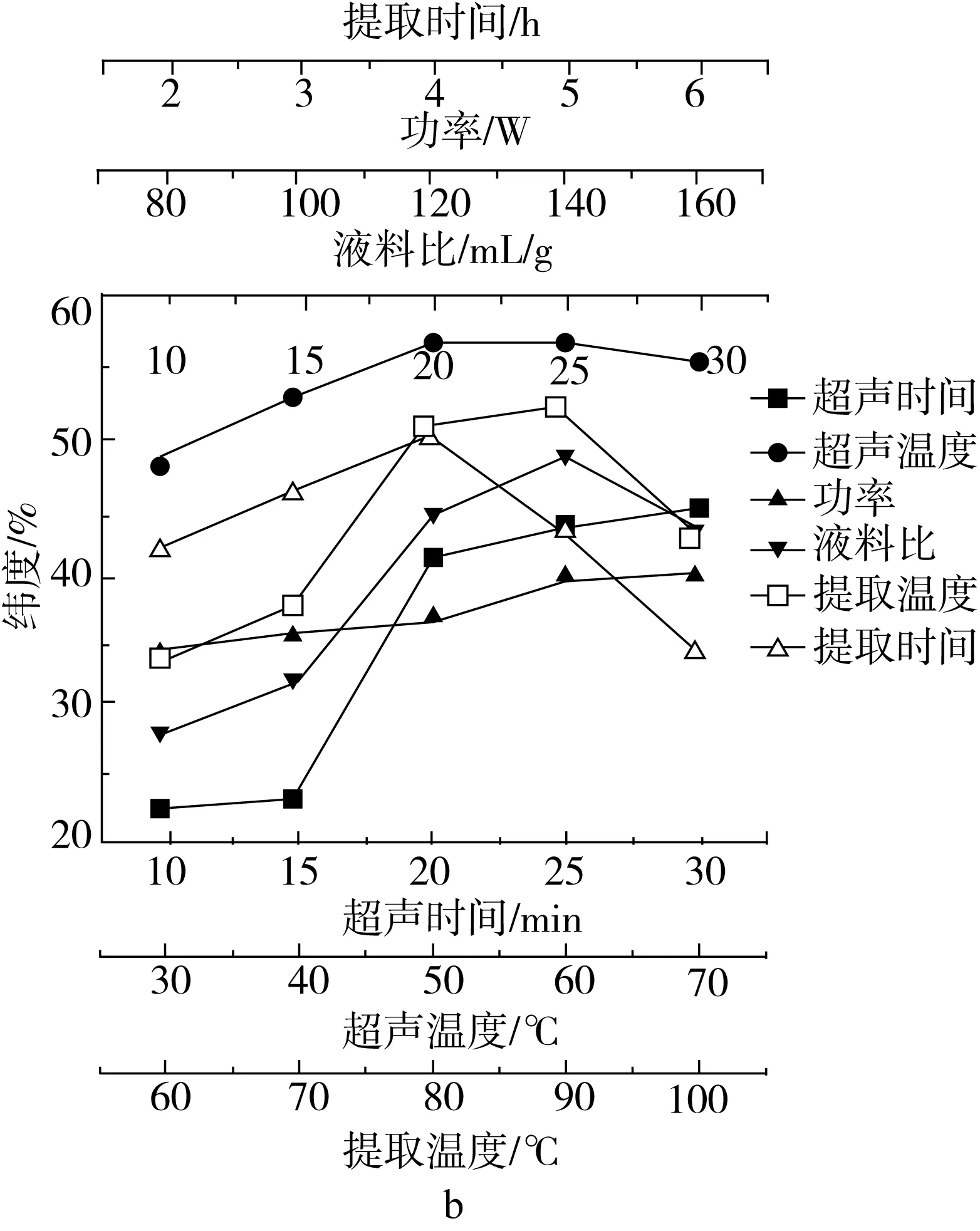
图1 超声辅助提取塔尔米多糖单因素实验
2.2 超声辅助提取塔尔米多糖均匀设计优化实验结果
超声辅助法提取塔尔米多糖涉及的工艺参数较多,包括液料比、超声温度、超声时间、超声功率、提取温度、提取时间六个因素,且每个因素水平范围较大,故采用U10(106)均匀设计[14]实验对其优化。结果如表1所示。

表1 U10(106)均匀设计实验结果表
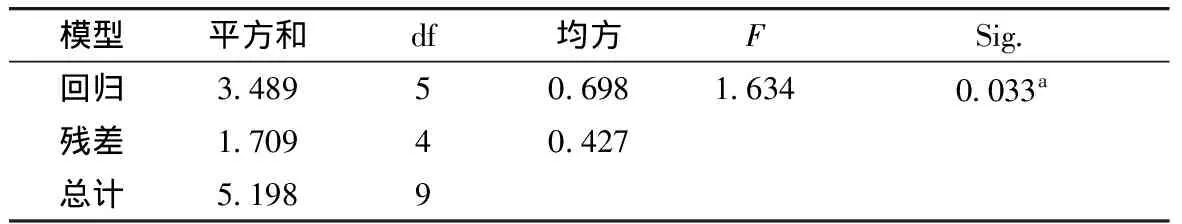
表2 提取率模型回归方程方差分析
注:a.预测变量: (常量),液料比、提取温度、提取时间、超声时间、超声功率;b. 因变量:提取率;*表示P<0.05,影响显著。余同。

表3 提取率回归模型系数及显著性检验结果

表4 纯度模型回归方程方差分析

表5 纯度回归模型系数及显著性检验结果
将实验结果经SPSS17.0软件数据处理系统进行回归分析,并对该模型进行显著性检验,结果见表3、表5,分别得回归方程:
Y(提取率)=-0.774+0.007X2+0.027X3-0.0027X4+0.103X5+0.038X6
Y(纯度)=73.739-0.609X2+0.270X3+0.307X4-2.443X5+0.015X6
方程的应变量与全体自变量之间的回归效果显著,可用于对实验进行分析和预测。根据实际经验和结果可得到最终工艺参数为:液料比20∶1,超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,回流提取时间3 h,塔尔米多糖提取率为2.68%,纯度为48.22%。
2.3 酶解工艺对塔尔米多糖提取率的影响
在确定了超声辅助提取塔尔米多糖工艺条件基础上,考察温度、pH值、时间等酶解工艺对塔尔米多糖提取的影响。采用L9(34)正交实验优化酶解工艺。
2.3.1 酶解-超声辅助联用提取塔尔米多糖单因素实验
由图2可知,在pH值为6.5处提取率和纯度达最大值,此为该α-淀粉酶的最适pH值,低于或高于最适pH值,酶的活力都会下降,因此酶解最适pH值为6.5;随着酶解时间延长塔尔米提取率增大,在30 min达到最大,随后曲线下降,这说明在一定时间内酶解反应最充分,使多糖提取率达到最大,之后没有更多的酶解底物了,因而提取率下降,故最适酶解时间为30 min;随着温度的提高塔尔米多糖提取率增大,在55 ℃达到最大,随后曲线下降。这表明温度是酶解反应的影响条件之一,一定温度下酶解反应最为充分,温度过高或过低都会导致酶活性失活,故55 ℃为最适酶解温度。


图2 酶解-超声辅助联用提取塔尔米多糖单因素实验
2.3.2 酶解-超声辅助联用提取塔尔米多糖正交优化实验
由表6知,以提取率为指标时,因素主次顺序为A>B>C,由表7方差分析可知,A对塔尔米多糖提取率效果影响差异显著(P<0.5),根据方差分析可知,C的改变对结果几乎没有影响,酶解-超声辅助联用提取工艺的最优组合为A1B2C2,即为酶解pH6.5,酶解时间30 min,酶解温度50 ℃,超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,提取时间3 h,液料比20∶1。在此条件下,验证实验得,塔尔米多糖提取率为5.24%、纯度为64.32%。而未采用酶解处理的塔尔米多糖提取率为2.68%、纯度为48.22%,酶解处理显著提高了塔尔米多糖的提取效果(提取率提高2.56%,纯度提高16.1%),这是由于塔尔米淀粉含量高达70%以上,若不酶解淀粉,则在水提多糖时由于淀粉的糊化作用而影响多糖的提取。

表6 正交优化实验结果表

表7 方差分析表
2.4 塔尔米提取物抗氧化活性
由图3a可知,VC和塔尔米提取物的总抗氧化能力都随着浓度的增大吸光度也逐渐增大,在0.2~1.0 mg/mL范围,总抗氧化能力随着浓度增加呈线性增长趋势,总体来看塔尔米提取物的总抗氧化能力弱于VC的总抗氧化能力,其中其塔尔米多糖总抗氧化能力略低于李恃圻等[18]报道的薏苡多糖;由图3b可知,塔尔米水提物、塔尔米醇提物及抗坏血酸对DPPH·清除能力分别是(8.037±0.017 71)、(0.624 2±0.038 8)、(0.015 74±0.033 85) mg/mL,且呈一定的量效关系。塔尔米多糖清除DPPH·自由基能力与小米[19]的清除能力相当(20%~60%);塔尔米多糖、塔尔米醇提物、塔尔米提取物及维生素E对ABTS+·清除能力分别是(3.314±0.966 0)、(1.055±0.052 1)、(0.6430±0.039 1) mg/mL,且呈一定的量效关系。塔尔米多糖有一定的抗氧化能力。
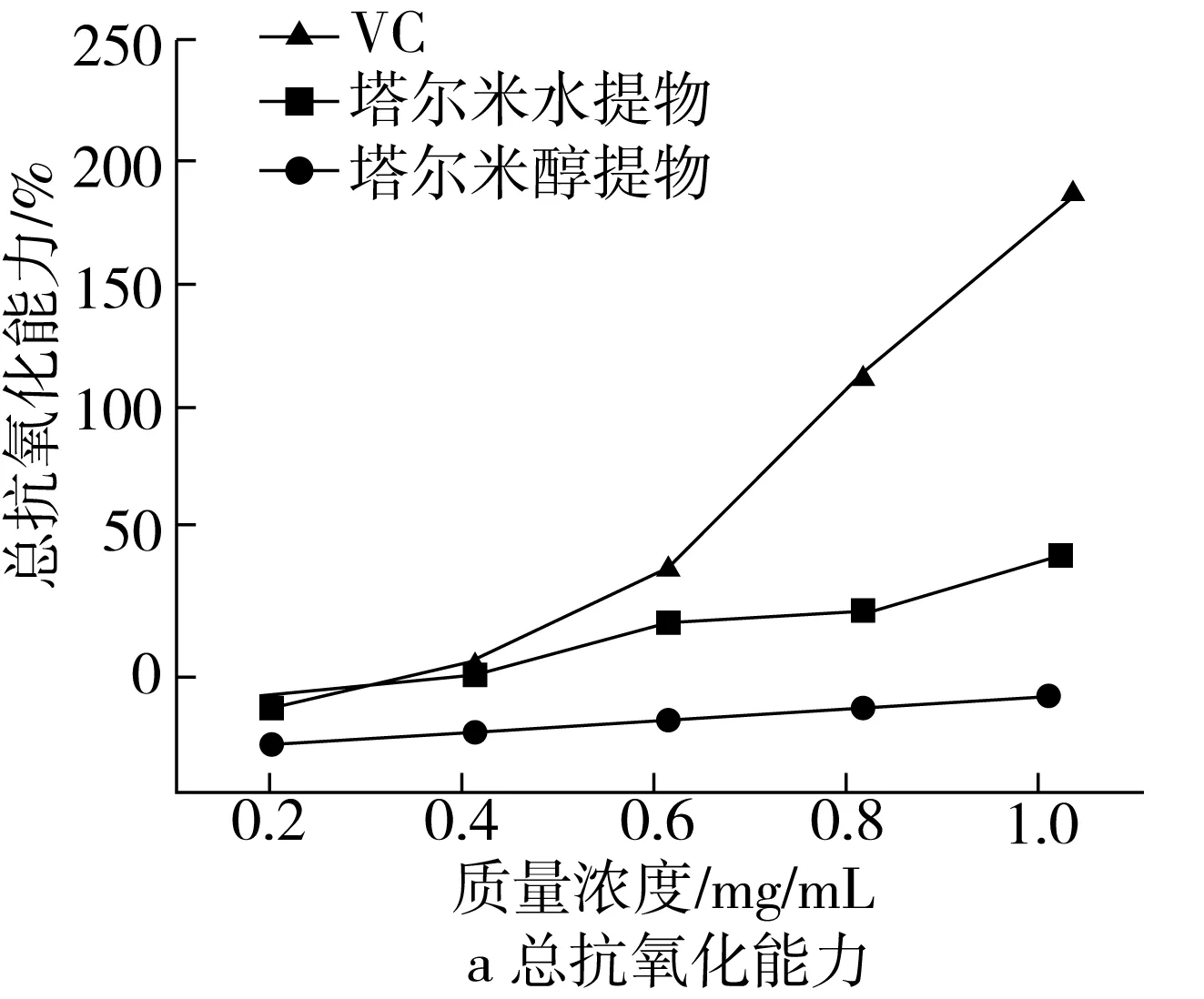

注:塔尔米水提物为塔尔米多糖。图3 塔尔米提取物抗氧化活性
3 结论
酶解-超声辅助联用提取塔尔米多糖的最优工艺为:塔尔米粉与α-淀粉酶混合,料液比1∶20,于室温下搅拌使其充分接触溶解,调节pH值为6.5, 50 ℃下恒温水浴30 min,再将其置于 90 ℃ 的水浴锅中5 min使酶失活后,在超声温度40 ℃,超声时间20 min,超声功率160 W,提取温度90 ℃,回流提取时间3 h,减压浓缩,冷冻干燥。在此条件下,塔尔米多糖提取率为5.24%,纯度为64.32%(而超声辅助提取法的提取率为2.68%,纯度为48.22%),酶解工艺提高了多糖提取率;塔尔米多糖有一定的抗氧化活性。

