鞍区肿瘤合并鞍区动脉瘤临床分析
蒋长露 王晓澍 杨刚 刘自力 郑履平 霍钢○☆
鞍区动脉瘤(sellar aneurysm)指动脉瘤瘤体位于鞍区,有文献定义为脑基底动脉环前半部动脉的局限性扩张[1-2]。鞍区肿瘤合并鞍区动脉瘤少见,在处理上存在一定的特殊性。国内外关于鞍区肿瘤合并鞍区动脉瘤文献多为个案报道,本研究分析重庆医科大学附属第一医院神经外科2014年3月至2017年10月收治的鞍区肿瘤833例患者资料,以探讨鞍区肿瘤合并鞍区动脉瘤诊疗策略,为神经外科医师提供参考。
1 对象与方法
1.1 研究对象入组标准:①确诊鞍区肿瘤患者;②术前行头颅CTA、MRA或DSA等检查的患者;③可耐受气管全麻手术的患者。排除标准:①术后其他原因致死亡的患者,②存在其他神经系统疾病的患者。按照入组标准及排除标准,收集了鞍区肿瘤833例患者临床资料,男400例,女433例,年龄 5~85 岁,平均(49±14)岁。 根据有无合并鞍区动脉瘤分为单纯鞍区肿瘤 (sellar region tumors,SRT)组(757 例)和合并鞍区动脉瘤(sellar region tumors associated with sellar aneurysm,SRTAA)组(76例)。SRTCA组7例患者行动脉瘤处理及肿瘤切除。
1.2 资料收集收集整理所有入组患者的基本资料,包括年龄、性别、肿瘤类型、侵袭性等,以及临床表现、鞍区MRI、颅内血管影像学资料。
1.3 统计学方法采用SPSS 23.0软件进行数据分析,年龄、鞍区肿瘤直径大小等正态分布计量资料采用t检验;性别、高血压、饮酒、吸烟、肿瘤种类等计数资料采用χ2检验或Fisher’s确切检验,检验水准 α=0.05。
2 结果
2.1 基本资料比较SRT组757例,男375例,女382 例,年龄(48±14)岁;SRTAA 组 76 例,男 25例,女 51 例,年龄(54±13)岁;两组间年龄、性别差异有统计学意义(P<0.05);比较两组高血压、吸烟差异有统计学意义(P<0.05);两组患者在饮酒、肿瘤大小等因素上差异无统计学意义 (P>0.05);肿瘤对血管侵袭 (侵袭性肿瘤:垂体瘤,Knosp≥2级;其他肿瘤,部分或全包绕血管)差异无统计学意义(P>0.05),见表 1。
2.2 临床表现的分析SRT组与SRTAA组主要临床表现差异无统计学意义(P>0.05),合并动脉瘤患者的临床表现常为鞍区肿瘤所致(表2)。
2.3 肿瘤类型分析SRT组与SRTAA组中鞍区肿瘤类型差异无统计学意义(P>0.05),鞍区肿瘤类型不是鞍区动脉瘤形成的因素(表3)。
2.4 治疗方式SRT组中鞍区肿瘤主要治疗方式
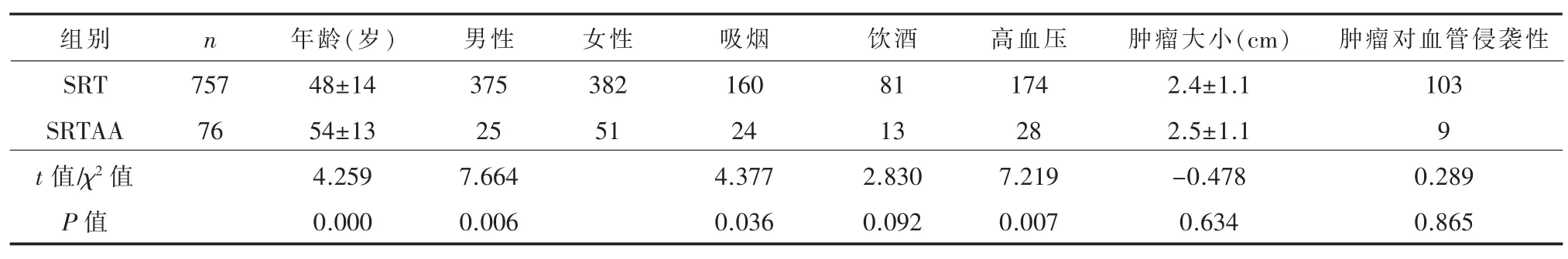
表1 SRT组与SRTC A组基本资料

表2两组患者临床表现

表3两组鞍区肿瘤类型
主要为经蝶肿瘤切除543例 (transspheno-idal surgery,TSS)、开颅肿瘤切除109例、保守治疗105例。SRTAA组中7例处理动脉瘤,其动脉瘤瘤径均大于5 mm,需手术干预;其中2例(包括1例鞍旁脑膜瘤,1例垂体瘤)肿瘤需开颅切除,且与动脉瘤毗邻,术中同时行鞍区肿瘤切除及动脉瘤成功夹闭(图1);2例为垂体瘤合并鞍区动脉瘤先行介入治疗动脉瘤后行经蝶垂体瘤切除术(图2);3例为垂体瘤卒中且无法同时治疗动脉瘤,故肿瘤切除 (1例为开颅,另外2例行经蝶垂体瘤切除术)后介入栓塞动脉瘤;余69例合并动脉瘤患者,动脉瘤暂无手术指征,予以切除鞍区肿瘤,并随访观察动脉瘤变化。
2.5 随访情况随访 3~18个月,69例合并动脉瘤患者失访26例,随访过程中未见肿瘤患者复发,动脉瘤无明显变化,是否动脉瘤增大仍在继续随访中;7例处理动脉瘤患者失访1人,6例随访头颅MRI及CTA、MRA或DSA提示肿瘤及动脉瘤治愈,未见复发,预后较好。
3 讨论
鞍区肿瘤合并鞍区动脉瘤发生率低,多以个案形式报道[1,3-8],以往报道中颅内肿瘤合并颅内动脉瘤发生率为0.7%~9.6%[4,9]。本组病例中鞍区肿瘤合并鞍区动脉瘤发生率为9.1%。
鞍区肿瘤合并鞍区动脉瘤发生机制尚无统一看法,既往提出可能机制为激素分泌异常,如生长激素,可促进动脉硬化以及血管壁变性,最终导致动脉瘤形成[7,9],但OH等在800例垂体瘤患者样本研究分析中否认垂体瘤类型对动脉瘤形成有相关性[10];另外,有研究提出肿瘤的生长导致局部血流状态的改变,局部血管内压力改变致动脉瘤形成,PARK与KIM认为脑膜瘤血供丰富,可诱导相应的滋养动脉形成,考虑脑膜瘤合并动脉瘤更常见[11-12];也有学者认为肿瘤分泌一些细胞因子如:血管内皮生长因子等物质成分诱导动脉瘤形成[13]。本组研究中合并鞍区动脉瘤形成与单纯动脉瘤危险因素相同,鞍区肿瘤类型、大小以及侵袭性与鞍区动脉瘤形成无关,故考虑鞍区肿瘤合并鞍区动脉瘤的发生可能属于偶然。
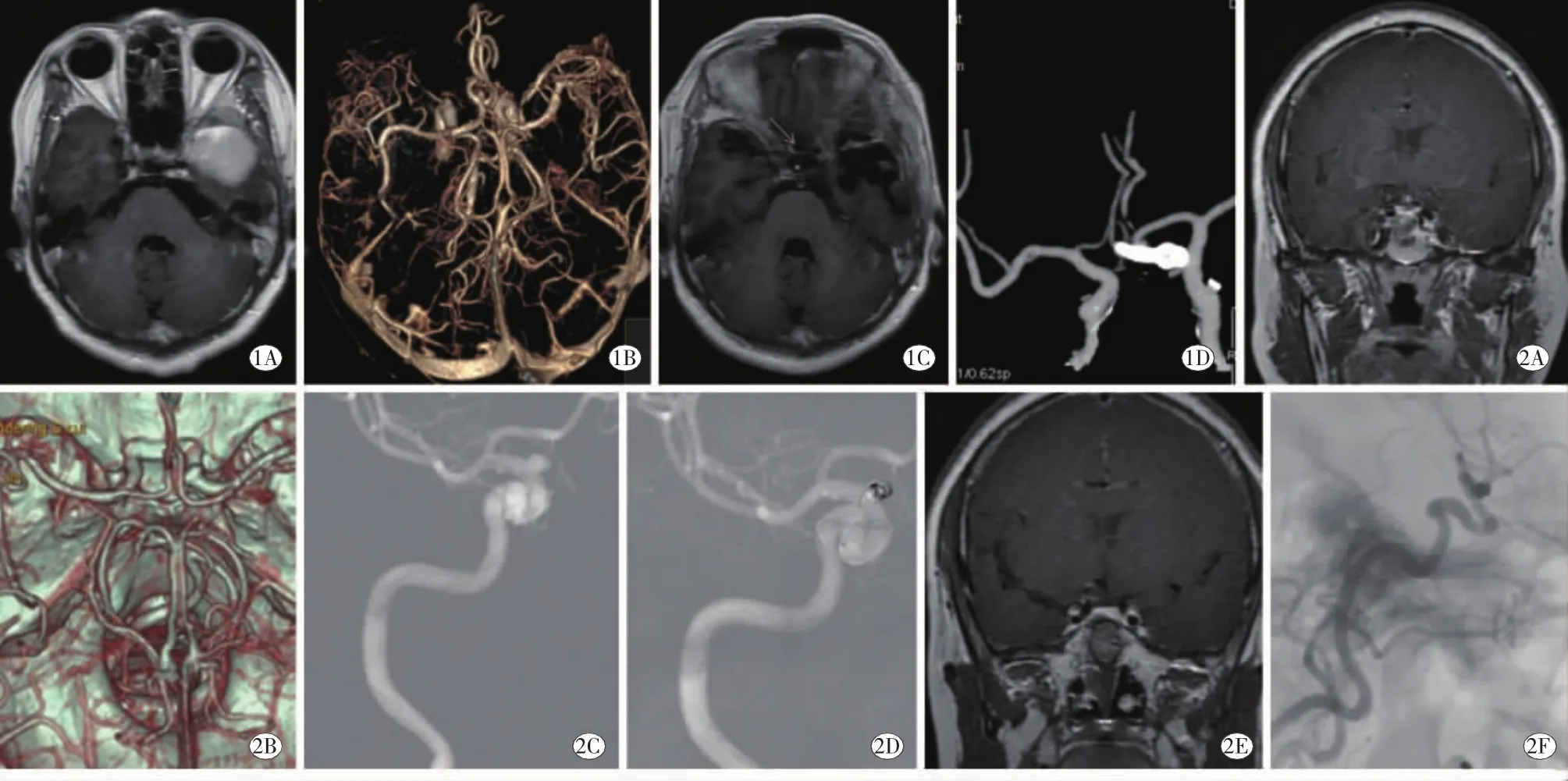
图1A:术前MRI提示鞍旁脑膜瘤;B:术前CTA提示前交通动脉瘤;C:开颅肿瘤切除及动脉瘤夹闭术后,可见瘤腔及鞍上瘤夹影;D:术后随访CTA提示动脉瘤成功夹闭图2A:术前MRI提示垂体瘤;B:术前CTA提示右侧床突段动脉瘤;C、D:造影及栓塞动脉瘤;E:MRI提示垂体瘤完整切除,可见栓塞后低信号影;F:随访造影提示动脉瘤栓塞完全
鞍区肿瘤合并鞍区动脉瘤使病情复杂化,处理更棘手,现无规范的治疗策略,需根据具体的情况综合考虑而制定手术治疗方案,包括鞍区肿瘤类型及鞍区动脉瘤的大小、相互毗邻情况以及临床表现。根据本组病例以及既往文献,总结以下原则:①动脉瘤瘤体直径>5 mm、动脉瘤破裂或既往破裂者具有处理指征,需行手术治疗[4,11];②鞍区肿瘤与动脉瘤位置上毗邻,可考虑选择开颅同时行动脉瘤夹闭及肿瘤切除[7];③鞍区肿瘤与动脉瘤位置上不毗邻,同一手术入路无法同时处理,且肿瘤所致临床症状较轻,首选优先介入治疗动脉瘤[3,9];④鞍区肿瘤占位效应明显伴脑积水,甚至颅内高压或肿瘤卒中,同一手术入路无法同期处理时,应先处理肿瘤,术中注意保护动脉瘤,待病情稳定后再考虑处理动脉瘤[14]。本组病例中处理7例鞍区动脉瘤,2例为一期处理动脉瘤再行经蝶垂体瘤切除术,2例为同期行开颅肿瘤切除及动脉瘤夹闭,3例为肿瘤卒中因无法同时处理动脉瘤而选择二期处理动脉瘤,结局均较好。
在处理合并鞍区动脉瘤者需根据影像学评估动脉瘤是否有处理指征,遵循动脉瘤优先原则,可选择先行动脉瘤夹闭或介入栓塞术后再行鞍区肿瘤切除术,或者同时行手术切除鞍区肿瘤以及动脉瘤夹闭[8]。考虑先行手术治疗鞍区肿瘤主要是针对存在肿瘤卒中、脑积水等紧急情况的患者,由于位置不毗邻或其他因素无法同期处理动脉瘤者,无论是行经蝶手术(transsphenoidal surgery,TSS)还是开颅手术,术中操作时尽量避免或减轻对动脉瘤周围组织牵拉。术中打开硬膜前可将平均动脉压降至稍低于基线水平,且应足够缓慢释放脑脊液,尽可能将硬膜内外以及动脉瘤周压力差变化减至最小。肿瘤切除时采用肿瘤分块切除,目的是使肿瘤周围组织塌陷,肿瘤与血管之间间隙更加明显,明确动脉瘤与肿瘤位置关系,减少对载瘤血管或动脉瘤周围组织牵拉,缓慢分离肿瘤与血管。肿瘤质地韧可考虑术中合理使用超声刀分块切除肿瘤以减少对血管牵拉,从而减少分离时对动脉瘤的应切力,不应过分要求全切,若残留少许肿瘤组织,术后可行放射治疗。另外TSS也是鞍区肿瘤手术常用术式,主要包括垂体瘤、颅咽管瘤以及鞍结节脑膜瘤等,术中可行超声多普勒探查术区动脉瘤,以便在鞍区探查以及切除肿瘤时尽量轻柔,尽量避开载瘤血管和动脉瘤。两组病例中行TSS达596例,其中合并鞍区动脉瘤为53例,术中均行超声多普勒探查,以避免术中误伤动脉瘤而致其破裂。对未处理鞍区动脉瘤病例在肿瘤切除术后随访头颅CTA,对比术前CTA有未见明显变化,若随访发现出现动脉瘤明显增大或破裂,需立即手术干预。本组数据中在随访时间内均未发现动脉瘤变化。
本组数据研究存在不足之处。第一,治疗方式选择偏移,本研究为回顾性研究,为不同时期的患者资料,治疗方式不断改变与进步,如介入发展迅猛。第二,随访偏移。
综上所述,本组资料中鞍区肿瘤类型、大小以及侵袭性不是鞍区肿瘤合并鞍区动脉瘤的形成因素,鞍区肿瘤合并鞍区动脉瘤组临床表现常为鞍区肿瘤所致。鞍区动脉瘤无处理指征则注意术中保护动脉瘤;有处理指征(瘤体直径>5 mm、破裂或既往破裂)则根据其与鞍区肿瘤毗邻关系优先或同期处理动脉瘤,若存在鞍区肿瘤卒中等紧急情况则同期或二期处理动脉瘤。对于未行手术切除肿瘤与仅行手术切除肿瘤的患者相比是否鞍区动脉瘤更易增大需继续随访研究。

