补肾强督方对骨髓间充质干细胞成骨过程Wnt通路中因子表达的影响
李艳萍 ,杨文雪 ,夏启胜 ,阎小萍 ,陶庆文 ,陈志华 ,赵淑欣 ,孔维萍 ⋆
(1.北京中医药大学,北京 100029;2.天津市中医药研究院肾病科,天津 300120;3.中日友好临床医学研究所,北京100029;4.中日友好医院 中医风湿病科,北京 100029;5.免疫炎性疾病北京市重点实验室,北京 100029)
强直性脊柱炎(ankylosing spondylitis,AS)是一种原因不明的慢性、炎性、自身免疫性疾病。主要累及骶髂、脊柱及外周关节,并可伴发关节外表现。附着点炎症、骨侵蚀、韧带骨赘形成被认为是AS的主要病理过程。其中病理性新骨形成是其独特标志[1]。新骨形成导致的不可逆结构损伤在疾病后期严重影响了脊柱活动,使关节活动降低[2]。晚期可出现脊柱活动受限、僵硬、融合,关节屈曲挛缩、畸形,造成患者不同程度残疾,严重影响了疾病预后。
目前较为统一的观点认为骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)原生质膜的受体上结合 Wnt蛋白,诱导其向成骨细胞分化,成骨细胞产生骨基质沉积而成骨[3]。现已证实经典Wnt信号通路(β-catenin依赖性通路)在BMSCs成骨过程发挥了重要作用[4],该通路的激活促进成骨细胞分化和成熟,并与AS的新骨形成相关[5]。本实验拟观察补肾强督方含药血清对Wnt信号通路中因子表达的影响,探讨补肾强督方抑制新骨形成的可能作用机制。阳性对照药物选择非甾体抗炎药塞来昔布。有研究报道连续使用其可减低AS放射学进展[6]。在细胞实验方面有研究发现在炎症条件下,大剂量塞来昔布的治疗可以抑制BMSCs的成骨[7]。但目前关于塞来昔布对于AS的Wnt通路影响研究还未见报道。
1 材料与方法
1.1 制备药物补肾强督方和西药对照溶液
补肾强督方组成:熟地、金狗脊、鹿角、骨碎补、补骨脂 、桂枝、赤芍 、白芍 、知母 、秦艽 、羌活等。中日友好医院药剂室煎制,药物经水煎、过滤、浓缩至终浓度分别为0.75、1.5、3g/ml的补肾强督方低、中、高剂量组各140ml,装瓶,封盖,灭菌,4℃冰箱保存备用。西药对照药:塞来昔布胶囊(西乐葆),厂家:上海辉瑞制药有限公司,批号:R55875,规格:0.2g/片。换算为大鼠等效剂量,用水溶解,4℃冰箱保存备用。
1.2 大鼠含药血清制备
实验动物选用 Wistar雄性大鼠(来源于维通利华)20只,随机分为5组(每组4只):中药高、中、低剂量组、西药对照组以及空白组,分别进行灌胃给药,连续给药 7d,灌胃剂量参照《药理试验中动物间和动物与人体间的等效剂量换算》。末次给药 2次,间隔 1h,末次给药前 12h,禁食不禁水,末次给药后 1h大鼠称重,平均220g/只,10%水合氯醛(中日医院提供)麻醉,每只1.2ml,剖腹,腹主动脉取血,离心取血清,56℃灭活30min,0.22μm微孔滤膜过滤除菌,-20℃冰箱保存。
1.3 细胞传代扩增培养
人BMSCs购自ATCC,在MSCM基础培养基(含1%青霉素链霉素双抗、5%胎牛血清、1%间充质干细胞生长因子,均购自ATCC)内培养,细胞密度为3×105/ml,接种于 2μg/cm2多聚赖氨酸(购自Sciencell)包被后的 T-25培养瓶中,置 37℃温箱静置培养,次日更换培养液继续培养,观察生长情况。待细胞铺满培养瓶 60%~70%时,用0.25%胰酶(购自Gibco)进行消化,收集细胞后离心并台盼蓝计数,后将细胞种于3个2μg/cm2多聚赖氨酸包被后T-25培养瓶中,置37℃温箱静置培养,次日更换培养液继续培养,观察生长情况,传代扩增至第5代的细胞用于实验。
1.4 细胞成骨分化培养干预
用多聚赖氨酸包被好六孔板后,对第5代人BMSCs进行台盼蓝计数,调整细胞密度,接种于包被好的六孔板中,使得每孔中含约1×105个人BMSCs细胞,补足培养液至每孔2.5ml。置37℃温箱静置培养,次日更换培养液继续培养,观察生长情况,直至细胞铺满六孔板,分为中药高、中、低剂量组、西药对照、空白组。各分化组吸弃各孔中的培养基,分别更换为加入对应含药血清的MODM(含1%青霉素链霉素双抗、5%胎牛血清、1%间充质干细胞成骨分化因子、20%含药血清)2.5ml,进行药物干预成骨分化,4~5d更换1次培养液,培养14d。
1.5 检测指标
实时荧光定量PCR测定BMSCs膜内成骨中GSK3β、wnt5a和SOST mRNA 表达:BMSCs诱导成骨分化 14d,Trizol(购自Invitrogen)提取成骨细胞总RNA。取1μg总RNA,用逆转录试剂盒(购自BIO-RAD)合成20μl cDNA,再取1μl cDNA进行实时荧光定量PCR反应。GSK3βmRNA上游引物为:5'-CACGGTCTCCAGTATTAGCATCT-3',下游:5'-GGCTACCATCCTTATTCCTCC-3';Wnt5a mRNA上游引物为:5'-TGGTGGTCGCTAGGTATGAATAAC-3',下游:5'-TCCTGATACAAGTGGCACAGTTTCT-3',SOST mRNA上游引物为:5'-CGGTCCCGAAGTCCTTGAGCT-3',下游:5'-GGCAAGTGGTGGCGACCTAGT-3'。引物均由捷瑞生物工程有限公司合成,以cDNA为模板按FastStartUniversalSYBRGreenMaster(ROX)试剂盒(购自 Roche)说明书配制 25μl的PCR反应体系,按以下条件在AB7500(Thermo公司)进行扩增:预变性,1个循环,95℃ 2min;热循环,40个循环,95℃ 15s,60℃ 1 min;溶解曲线。每种样品做3个复孔,计算时取平均值。
1.6 检测方法
免疫印迹法分析BMSCs中 GSK3β、wnt5a和SOST蛋白含量:BMSCs诱导成骨分化14d后用RIPA法提取蛋白质,BCA法测定蛋白浓度,蛋白质免疫印迹(Western blot,WB)检测细胞中的目标蛋白质含量。样品加入上样缓冲液后100℃加热 5min。每孔各上 15~20μg样品蛋白。电泳后,蛋白转印至PVDF膜上,5%的脱脂奶粉封闭,37℃,2h,孵育一抗(GSK3β、SOST、Wnt5a,均购自 AB-cam),均为1∶1000稀释,4℃ 孵育过夜后用TBST充分洗涤。孵育二抗(KPL公司,货号:074-1516),室温孵育 2h,ECL发光试剂盒(购自Millipore)显影,以β-actin为内对照,拍照,对杂交带进行密度扫描分析,比较蛋白的相对表达。
1.7 统计学方法
采用SAS9.2统计学软件,对各组数据进行正态分布检验和方差齐性检验,符合正态分布且方差齐采用方差分析,方差不齐的资料采用Wilcoxon秩和检验。
2 结果
2.1 补肾强督方干预BMSCs成骨的结果
如图1(见封二)所示,空白组骨髓间充质干细胞成骨分化培养14d后可见明显矿化结节形成,补肾强督方高、中、低剂量组及西药对照组均未见明显矿化结节,各组间无明显差别。提示补肾强督方和塞来昔布均可抑制骨髓间充质干细胞成骨分化。
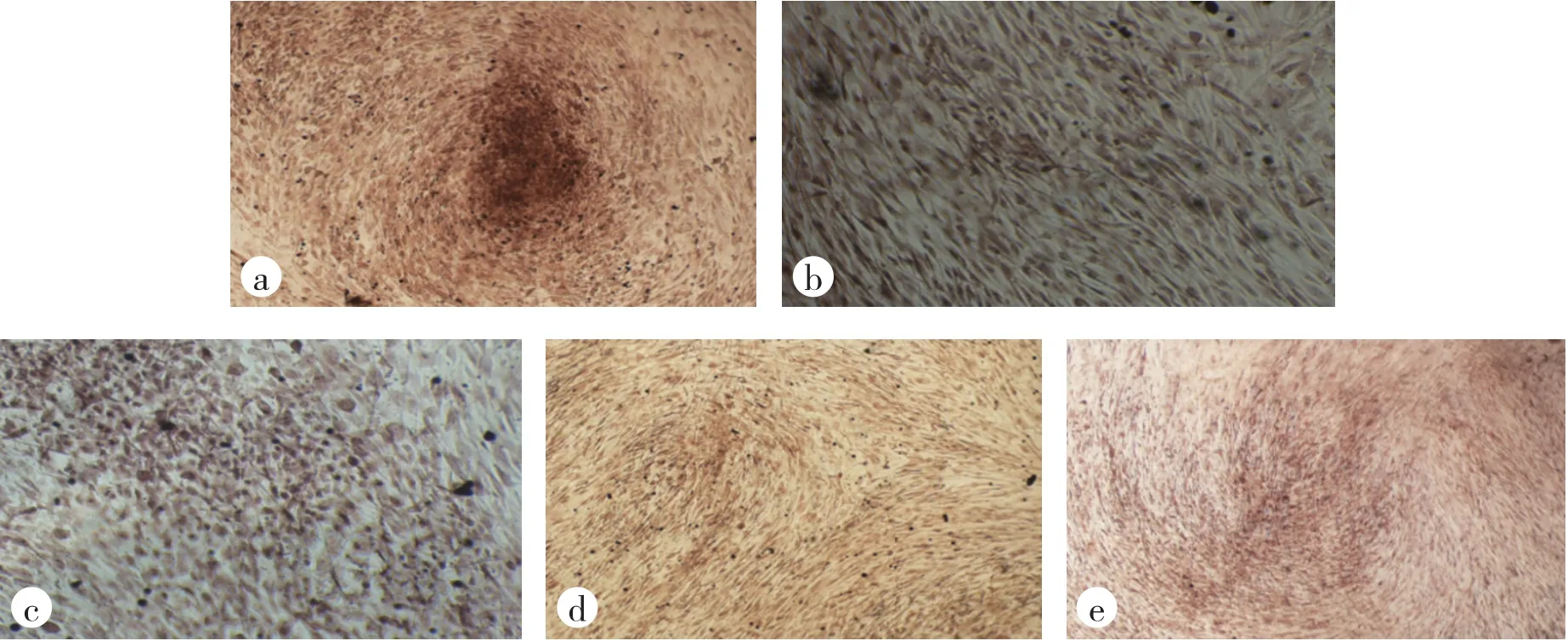
图1 各组骨髓间充质干细胞成骨诱导结果(茜红素染色×10)
2.2 含药血清对BMSCs成骨分化 SOST、Wnt5a、GSK3βmRNA表达的影响
如图2所示,①各组细胞SOST mRNA表达:与空白对照组比较,中药各剂量组和西药组SOST mRNA表达水平显著增高(P<0.05);与西药组比较,中药高、中剂量组表达升高(P<0.05);与中药低剂量组比较,中药高、中剂量组表达升高(P<0.05);与中药中剂量组比较,中药高剂量组表达升高(P<0.05)。②各组细胞 wnt5a mRNA 表达:与空白对照组比较,中药高中低剂量组wnt5a mRNA表达水平显著降低(P<0.05);与西药对照组比较,中药中高剂量组wnt5a mRNA表达水平显著降低(P<0.05);与中药低剂量组比较,中药高剂量组wnt5a mRNA表达水平显著降低(P<0.05)。③各组细胞GSK3β mRNA表达:与空白对照组比较,中药各剂量组GSK3β mRNA表达水平显著增高(P<0.05);与西药对照组比较,中药中、高剂量组 GSK3β mRNA 表达水平显著增高(P<0.05);与中药中、低剂量组比较,中药高剂量组GSK3β mRNA 表达水平显著增高(P<0.05)。
2.3 含药血清对BMSCs成骨分化中SOST、Wnt5a、GSK3β蛋白表达的影响
如图3所示:①与空白对照组比较,中药各剂量组、西药对照组SOST蛋白质产生量显著增高(P<0.05),与西药对照组、中药低剂量组比较,中药高剂量SOST蛋白质产生量显著增高(P<0.05)。②与空白对照组比较,中药高剂量组、西药组Wnt5a 蛋白质产生量显著降低(P<0.05),与西药对照组比较,中药高剂量Wnt5a蛋白质产生量显著增高(P<0.05)。③与空白对照组比较,中药高剂量组GSK3β蛋白质产生量显著增高(P<0.05),与西药对照组、中药低剂量组比较,中药高剂量GSK3β蛋白质产生量显著增高(P<0.05)。
3 讨论
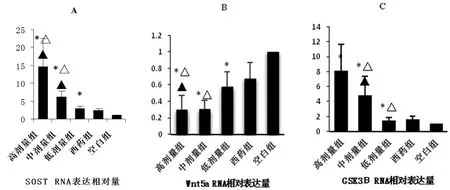
图2 补肾强督方对 BMSCs成骨分化中SOST mRNA、Wnt5a mRNA及GSK3β mRNA表达的影响
新骨形成是AS目前研究的热点,AS新骨形成部位多在连接骨的肌腱、韧带处[8],可在疾病后期导致强直,严重影响脊柱活动度,甚至造成残疾,是影响本病预后的主要原因。近年来,Wnt信号通路在AS新骨形成中的作用引起广泛关注,该通路的激活促进成骨细胞分化和成熟,与AS的新骨形成相关[5]。
SOST是Wnt通路的抑制剂,当Wnt蛋白与卷曲受体和LRP5/6受体结合时,激活一系列信号级联反应,发生经典的Wnt/β-catenin信号通路,而SOST可竞争性结合LRP5/6共同受体,从而抑制Wnt信号通路[11]。AS患者血清SOST水平较正常人对照组显著降低[16~19],AS患者关节免疫组化染色SOST的表达显著降低于健康对照组[21]。Wnt5a是一种既参与经典Wnt信号通路,又参与非经典Wnt信号通路的Wnt蛋白,不仅具有调节成骨细胞的功能[12~14],还能促进BMSCs表达ALP,促进其骨化进展[20]。抑制Wnt5a可减少成骨细胞矿化[22]。另外,在经典 Wnt通路中,APC、GSK3β、Axin组成了β-catenin降解复合物,使细胞内βcatenin水平降低,抑制了经典的Wnt/β-catenin信号通路[15]。很多研究表明抑制GSK3β可促进骨形成。有研究表明通过基因敲除或药物抑制GSK3β可增加骨密度[9]。在本实验中,结果显示,与空白对照组比较,补肾强督方含药血清可以促进 BMSCs中 SOST、GSK3β蛋白的表达,抑制wnt5a蛋白的表达(P<0.05)。实时荧光定量PCR检测各组mRNA表达显示,与空白对照组比较,补肾强督方含药血清可以促进BMSCs中SOST、GSK3β mRNA的表达,抑制wnt5a mRNA的表达(P<0.05)。
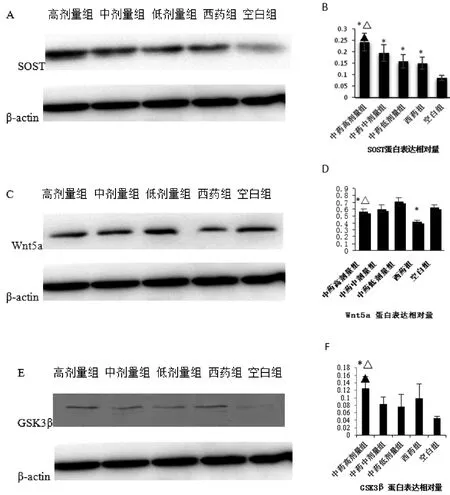
图3 补肾强督方对 BMSCs成骨分化中SOST、Wnt5a及GSK3β蛋白表达的影响
我们认为AS(大偻)主要病因病机是因肾督亏虚、阳气不足,风寒湿邪(尤其是寒湿偏重者)深侵肾督,阳失布化,阴失营荣,骨损筋挛,脊柱僵曲所致[10]。认为附着点、滑膜关节、软骨结合处的新骨生成是AS筋骨的生长发育逆乱的一种外在表现,其本质是由于邪气深侵入肾督,精血亏虚,筋骨失养而导致的。据此提出AS治疗原则应以补肾强督为大法,辅以祛寒除湿、散风活瘀、强壮筋骨,通利关节等治疗原则,研制出经验处方补肾强督方,主治强直性脊柱炎(大偻)肾虚督寒证。方药由熟地、金狗脊、鹿角、骨碎补、补骨脂、桂枝、赤芍、白芍、知母、秦艽、羌活等组成,通过补肾精,养肝血,充骨髓,荣筋脉,促进筋、骨恢复正常生长发育。
前期我们对补肾强督方能否抑制AS的新骨形成进行了探索性研究,结果证实:补肾强督方能够抑制AS附着点、滑膜关节、软骨结合处的新骨形成,应用本方治疗2年后AS患者新骨形成放射学评分(mSASSS)较治疗前无显著增加。此外我们发现本方含药血清能促进BMSCs成骨分化中DKK1蛋白和mRNA表达,抑制β-catenin蛋白和mRNA表达,且呈剂量依赖性,提示补肾强督方能调节BMSCs细胞成骨分化中Wnt通路[23]。我们还发现本方能够抑制自发性AS模型DBA/1小鼠成骨分化中Wnt通路的激活,上调DKK-1水平,下调wnt5a水平,而临床研究亦提示该方能上调AS患者血清中DKK-1水平,这些均提示该方可能通过Wnt通路抑制AS异位骨化[24]。
本研究是对系列研究的进一步补充,结果提示,补肾强督方能够抑制BMSCs成骨分化中Wnt通路的激活,上调SOST、GSK3β水平,下调Wnt5a水平,这些均提示该方可能通过Wnt通路抑制AS骨化过程中BMSCs的成骨过程起到调节作用,是否通过该通路发挥作用,还需进一步的实验证明。

