联萘偶氮苯环状手性剂的制备及其光异构化过程
周梦怡, 陆红波, 谢学文, 杨 乐, 徐 苗, 朱 俊, 张国兵, 邱龙臻
(特种显示技术国家工程实验室 现代显示技术省部共建国家重点实验室培育基地,合肥工业大学 光电技术研究院,安徽合肥230009)
1 引 言
胆甾相液晶,又称为手性向列相液晶[1],通过自组装所形成的螺旋超分子结构,使其具有许多独特的光学性质,如选择性反射、圆二色性、旋光性等。当入射光的波长(λ0)与胆甾相液晶的螺距 (p)相匹配时,即λ0=n×p(n为胆甾相液晶的平均折射率常数),则光被反射,反射光为圆偏振光[2]。胆甾相液晶的螺距可在光、温度、电磁场或机械应力等外界刺激下进行调节。其中,光作为一种绿色无污染的外界刺激源,使光敏型胆甾相液晶具有容易调控、响应速率快、可以在空间上实现远距离的调控、并且对周围环境要求不高等优点。因此,长期以来对于光敏型胆甾相液晶的研究占据了主导地位[3-6]。光敏型胆甾相液晶通常是由向列相液晶和光敏手性材料配制而成,其螺距由手性材料的扭曲力常数(HTP,β)和含量(c)决定,β= (p×c)-1,通过光照可以实现对胆甾相液晶螺距的动态调控。目前,光敏型胆甾相液晶已被广泛应用于彩色显示、滤波器及信息存储等领域[7]。
偶氮苯是一种典型的光致变色化合物,具有光致顺反异构特性,且在光致异构化过程中,偶氮苯的形状尺寸及偶极矩也会发生明显变化,因而受到了广泛关注[8]。长期以来,科学家们对提高手性向列液晶(CLCs)中偶氮苯类手性剂的螺旋扭曲力(β)和螺旋扭曲力变化(β)给予了极大的关注[9-12],其目的是将手性剂以较小的浓度掺入,防止发生相分离、染色以及所需的物理性质改变,并且扩大波长的调节范围。近几年,科学家们发现环状偶氮苯类手性剂分子具有较高的光稳定性,且可以通过控制环的大小对环张力进行控制进而对分子的光异构化速率进行调控[13]。Tamaoki课题[14]组制备了一类含有萘基与偶氮苯基团的环状分子,研究发现这种分子与向列相液晶进行掺杂后可以诱导形成胆甾相液晶,但其与液晶分子的相容性较差。为了解决相容性差问题,Munju课题组[15]系统地研究了联萘类手性剂的螺旋扭曲能力,发现四取代的联萘类手性剂具有较高的β值,其中通过在联萘基团的6,6′位点处引入与液晶分子结构相似的刚性取代基BPO6,可将β值提高至757 μm-1,且与液晶分子间有较好的相容性,从而有利于将手性剂的手性传递至液晶主体中。
因此,在实验室已有的Azo-o-Bi环状光敏手性分子[16]的基础上,我们通过在其联萘基团的6,6′位点处引入刚性取代基BPO5并制备BPO5BA手性分子,探究了其在溶液以及液晶中的光异构化过程,并通过计算Teas溶解度参数研究了手性剂分子与液晶主体间的相容性。
2 实 验
2.1 试剂与仪器
(R)-6,6′二溴-1,1′-联-2-萘酚,分析纯,购买自上海阿拉丁生化科技股份有限公司;2-(2-氯乙氧基)乙醇、四三苯基膦钯及2,2′-二羟基偶氮苯,均为分析纯,购买自百灵威科技有限公司;其他化学试剂均为分析纯,购买自国药化学试剂公司;Azo-o-Bi分子是由实验室自己制备。
核磁共振图谱采用美国安捷伦科技公司的VNMRS600超导核磁共振波谱仪获得:600 MHz, CDCl3做溶剂,TMS为内标;紫外吸收光谱通过UV2550紫外-可见分光光度计表征,试样在不同光照条件下进行照射:365 nm (2.6 mW cm-2)和440 nm(4 mW·cm-2);POM偏光图像表征在Leica DM2500M 型金相显微镜上获得。
2.2 联萘偶氮苯环状手性分子的合成
联萘偶氮苯环状手性分子(BPO5BA)的合成路线如图1所示,详细合成步骤如下:
依次将 (R)-6,6′二溴-1,1′-联-2-萘酚(1.0 g,2.3 mmol)、碳酸钾(1.1 g,7.9 mmol)、碘化钾(0.1 g,0.7 mmol)及N,N-二甲基甲酰胺(10 mL)加入50 mL的单口瓶中,于100 ℃下搅拌反应20 min后,将2-(2-氯乙氧基)乙醇(1.0 g,7.9 mmol)加入其中,并于100 ℃下继续反应24 h。反应结束后冷却至室温后,经乙酸乙酯和饱和食盐水反复萃取3次、无水硫酸钠干燥及硅胶柱层析(正己烷∶乙酸乙酯=2∶1)后,得黄色油状物M1(1 g),产率:72%。取中间体M1(1 g,1.6 mmol)和4-戊氧基联苯硼酸(1.1 g, 3.84 mmol),溶于1,4-二氧六环(20 mL)和碳酸钾水溶液中,在氮气保护下,再快速加入四三苯基膦钯(0.5 g, 0.4 mmol)后,于100 ℃下回流反应24 h。反应结束后冷却至室温,经二氯甲烷和饱和食盐水反复萃取、无水硫酸镁干燥及硅胶柱层析(正己烷:乙酸乙酯=2∶1)后,得淡黄色固体M2(0.2 g),产率:55%。将中间体M2(0.2 g, 0.2 mmol)完全溶解于二氯甲烷(8 mL)后,分别加入干燥的三乙胺(0.12 mL,0.8 mmol)、4-二甲氨基吡啶(0.33 mg,0.01 mmol),在冰浴条件下,加入对甲苯磺酰氯(0.12 g,0.6 mmol),室温反应24 h。待反应结束后,将反应液移至分液漏斗中,经水和饱和食盐水萃取、无水硫酸镁干燥及硅胶柱层析(正己烷∶乙酸乙酯=3∶1)后,得淡黄色油状物M3(0.2 g,80 %)。在氮气氛围下,取上述中间体M3(0.2 g,0.16 mmol),2,2′-二羟基偶氮苯(0.03 g,0.15 mmol),二苯并-18-冠醚-6(0.017 g,0.045 mmol)和碳酸铯(0.15 g,0.45 mmol),溶于干燥的N,N-二甲基甲酰胺(30 mL)中,于75 ℃下反应48 h。反应结束后,冷却至室温,并经水、二氯甲烷和饱和食盐水反复萃取3次、无水硫酸镁干燥及硅胶柱层析(正己烷:乙酸乙酯=3∶1)后,得黄色固体BPO5BA(0.1 g),产率:56%。
1H-NMR (600 MHZ, CDCl3, 25 ℃)δ: 8.04(s,2H),7.80(d,J=12 Hz,2H),7.72(d,J= 6 Hz,4H),7.64(d,J= 6 Hz,4H),7.57(d,J= 6 Hz,4H),7.51(t,J= 9 Hz,4H),7.43(t,J= 6 Hz,2H),7.21(d,J= 6 Hz,4H),7.10(m,2H),7.05(d,J= 6 Hz,4H),6.98(d,J=12 Hz,4H),4.15(s,2H),4.00(t,J= 6 Hz,8H),3.93(s,2H),3.60(s,2H),3.53(s,2H),3.48(s,2H),3.41(s,2H),1.81(m,4H),1.46(m,4H),1.40(m,4H),0.94(t,J= 6 Hz,6H)。
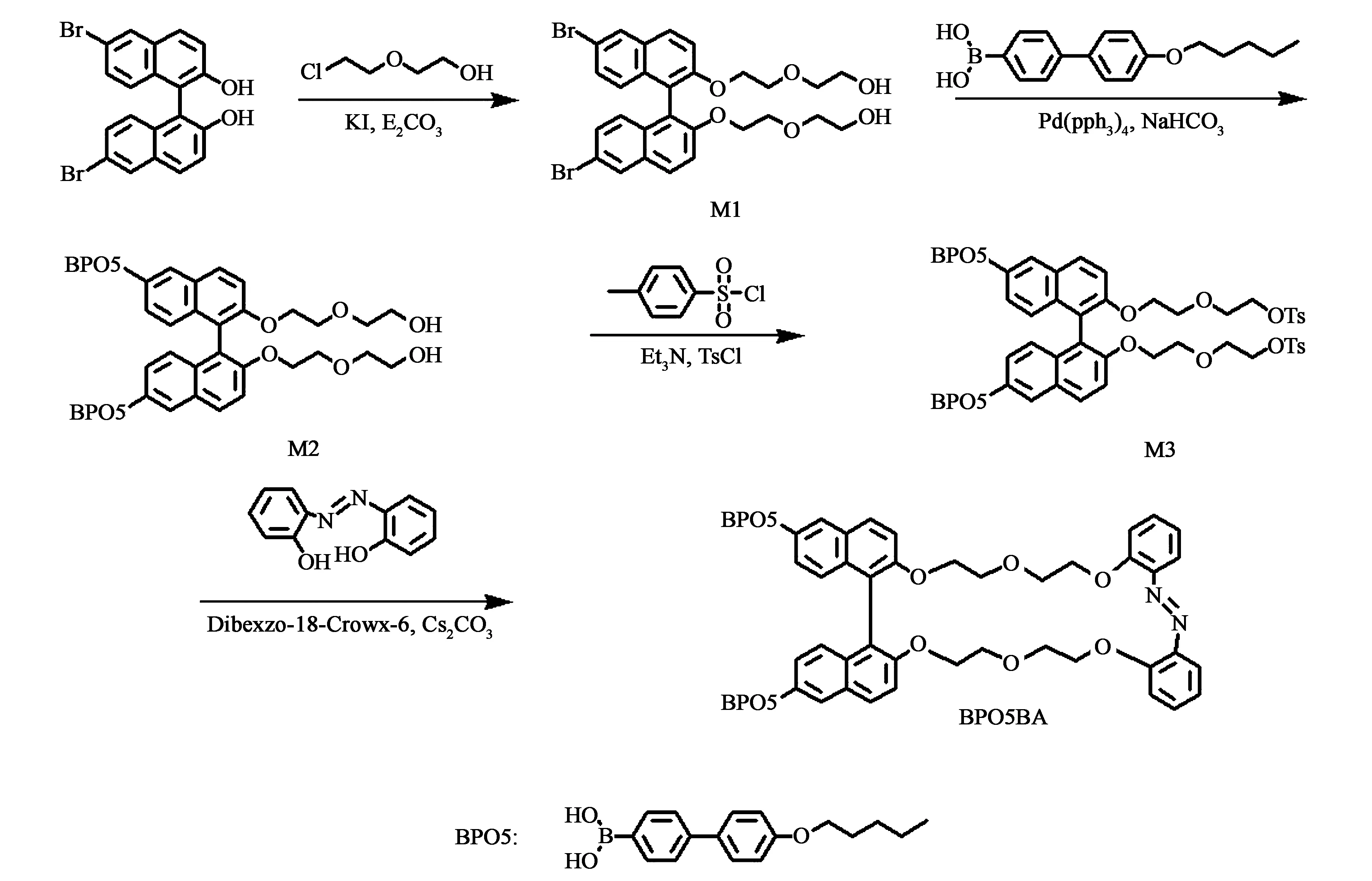
图1 手性剂分子BPO5BA的合成路线Fig.1 Synthetic route of chiral molecule BPO5BA
2.3 胆甾相液晶器件的制备
将质量分数为0.2%的手性剂分子BPO5BA与向列相主体液晶E7混合,并加入少量二氯甲烷使其完全溶解,然后于磁力搅拌器上加热搅拌至溶剂完全挥发,冷却至室温后,即得到了胆甾相液晶材料。将其缓慢灌入楔形盒(tanθ= 0.01)中,待其放置一段时间后会形成均匀的卡诺线。通过偏光显微镜可观察到盒中干涉条纹卡诺线的宽度(a),根据公式p= 2atanθ,计算出胆甾相液晶的螺距p[17]。
3 结果与讨论
3.1 手性剂分子在溶剂中的光异构化过程
为研究BPO5BA分子的光敏性,将BPO5BA 配成浓度为5×10-6mol/L的乙腈溶液,分别在紫外光(365 nm,2.6 mW·cm-2)和可见光(440 nm,4 mW·cm-2)的下进行照射,通过紫外-可见分光光度计测定其在溶液中的吸光度曲线,如图2所示。
图2(a)和(b)分别对应于BPO5BA分子在紫外光和可见光照射条件下的吸光度曲线。在300 nm处对应于联萘基团的1Bb跃迁吸收峰;在320~400 nm区域内对应于联萘基团的1La和1Lb跃迁和偶氮苯基团的π-π*跃迁吸收峰;在420 nm处对应于偶氮苯基团的n-π* 跃迁吸收峰。从图2(a)中可以看出,在365 nm的紫外光照射下,吸光度曲线在 320~400 nm区域内发生下降,在大于400 nm处有上升,这表明偶氮苯基团在紫外光照射下发生了从反式到顺式结构的转变[18],曝光80 s达到紫外光光稳态(PSSUV);在440 nm的可见光照射下,吸收光谱从PSSUV状态发生回复,且在曝光240 s内达到可见光光稳态(PSSVis)。
为进一步探究BPO5BA分子在溶剂中的异构化程度,分别测定了BPO5BA分子于CDCl3溶液中在初始状态、PSSUV及PSSVis3种状态下的1H-NMR谱图。如图3所示,通过对偶氮苯基团中的苯环所对应H原子的位置进行标记,并对不同光照状态下产生的顺式异构体的位置进行记录,由此通过计算可得到不同状态下反式异构体(E)与顺式异构体(Z)间的比例。从初始状态至PSSUV状态,E-Z的转化率仅为28%,而在可见光光照下,Z-E的转化率仅为25%,而Azo-o-Bi分子在PSSUV和PSSVis状态的异构化转化率分别为58%和66%,异构化程度较高。由此说明,在环状手性剂分子中刚性取代基的引入,会通过环张力及分子刚性限制偶氮基团的转动,从而导致该分子在溶液中的光致异构化程度较低。
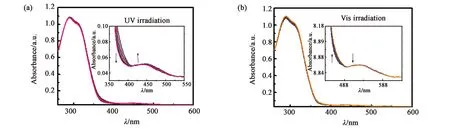
图2 BPO5BA分子在乙腈溶液(5 μmol/L)中经紫外光照(365 nm,2.6 mW·cm-2)(a)和可见光光照(440 nm,4 mW·cm-2)(b)下的吸收光谱图。Fig.2 Absorption spectra changes of BPO5BA in acetonitrile (5 μmol/L) upon irradiations with UV (365 nm, 2.6 mW·cm-2) (a) and visible (440 nm, 4 mW·cm-2) (b)
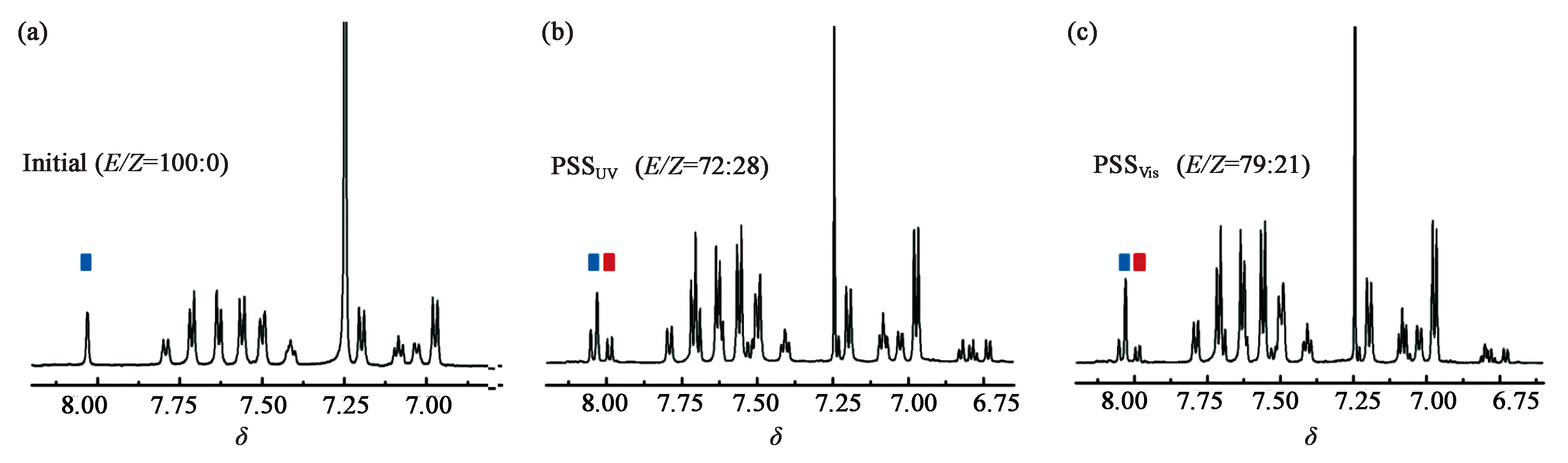
图3 BPO5BA分子在CDCl3溶液中分别在初始状态(a)、紫外光光稳态(b)以及可见光光稳态(c)下的1H-NMR谱图。Fig.3 1H-NMR changes of BPO5BA in CDCl3 at initial (a), PSSUV(b), and PSSVis (c) states, respectively.
3.2 胆甾相液晶手性方向判断
对手性剂 BPO5BA 分子所掺杂的胆甾相液晶的螺旋方向可以通过液晶接触性实验进行测定[19]。已知S811和E7形成的是左旋的胆甾相液晶,相反地,R811和E7形成的是右旋的胆甾相液晶。将这两种胆甾相相液晶材料作为标准液晶与BPO5BA分子掺杂形成的液晶材料分别从20 μm的液晶盒两端灌入,通过偏光显微镜观察两种胆甾相液晶接触处的POM图,判断待测液晶的螺旋方向。若混合区域连续,则待测和标准液晶的旋向一致;若出现不连续区域,则待测与标准液晶的旋向相反。
从图4(a)可看出,含有BPO5BA的胆甾相液晶与右旋标准的胆甾相液晶相接触时,无明显边界,呈连续界面;而与左旋标准的胆甾相液晶相接触时,如图4(b)所示,出现了明显的不连续区域。由此说明含有BPO5BA的胆甾相液晶的螺旋方向与右旋标准胆甾相液晶相同,即螺旋方向为右旋。
图4 含有 BPO5BA 的胆甾相液晶分别与含有 R811 (右旋)(a)或者 S811(左旋)(b)的胆甾相液晶进行的液晶接触性实验测试Fig.4 Content tests between the CLC including BPO5BA and R811 (right-handed screw) (a) or S811 (left-handed screw) (b) in the same LC host E7, respectively.
3.3 手性剂与向列相液晶间的相容性
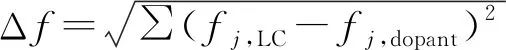
如图5所示, Azo-o-Bi和BPO5BA分子与E7分子间的Δf值分别为0.170和0.152,由此说明棒状基团的引入有利于提高手性剂分子与液晶分子间的相容性。
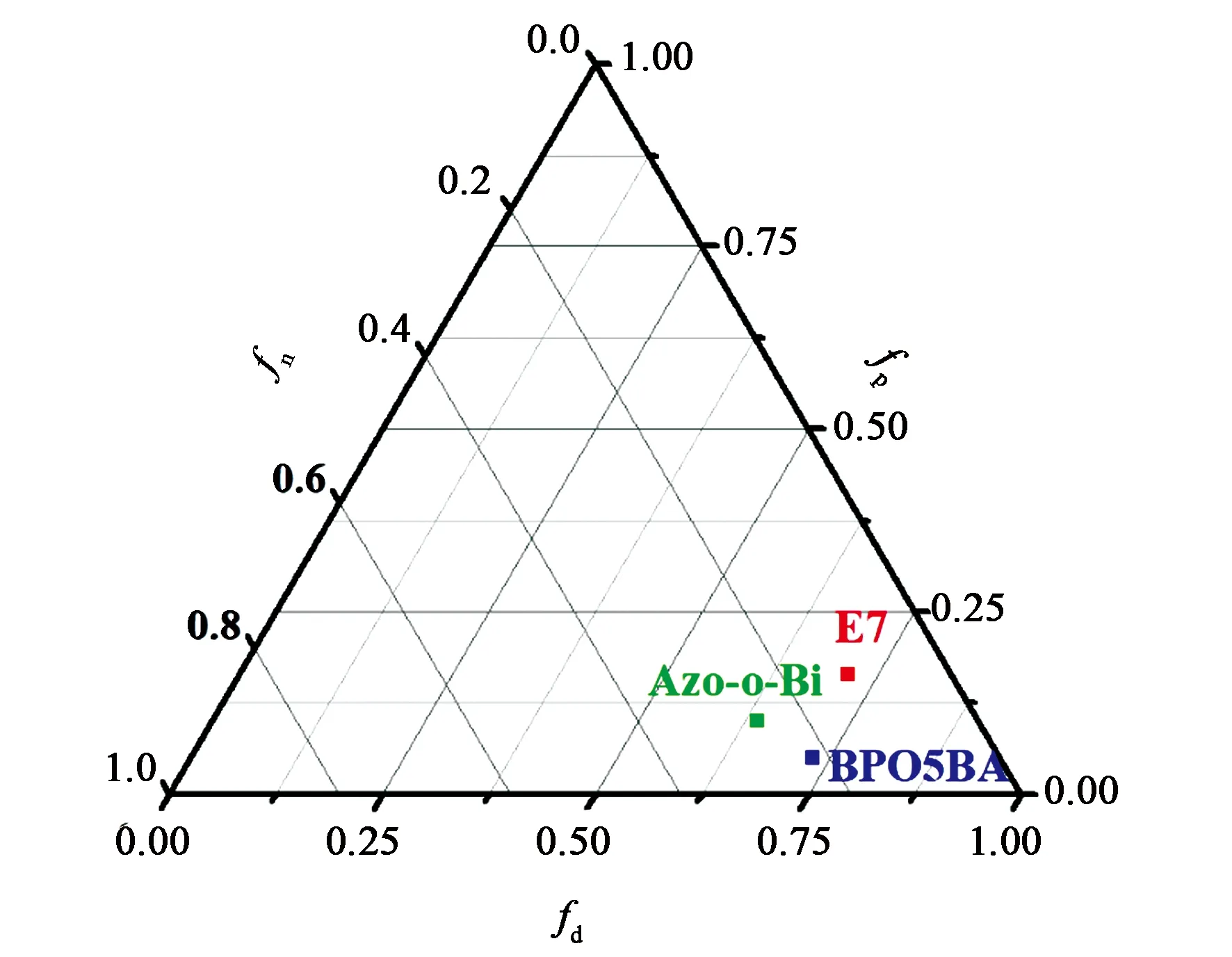
图5 手性剂与E7间的Teas溶解度参数三元图Fig.5 Teas plot of calculated solubility parameters of dopants and E7
3.4 手性剂分子在胆甾相液晶中的光异构化过程
为探究BPO5BA手性分子在胆甾相液晶中的光异构化过程,分别对其所诱导的胆甾相液晶的螺旋扭曲力(β)以及不同光照条件下的β值的变化(β)进行了测定。β值可由公式β= (p×c)-1计算,其中P为胆甾型液晶的螺距。将含有0.2 %(质量分数)的BPO5BA与E7的混合物缓慢灌入楔形盒中,在偏光显微镜下可观察到分布均匀且规则的卡诺线。
如图6所示,在紫外光(365 nm,14 mW cm-2)照射下,相邻两条卡诺线的间距(a)逐渐增大,在光照8 min后达到稳定状态PSSUV,其对应的β值从+28.5 μm-1减小到+24.1 μm-1。可见光(440 nm, 6.5 mW·cm-2)照射后,顺式异构体会逐渐转变为反式异构体,经9 min后达到稳定状态PSSVis,间距a由1 037.3 μm回复至972.8 μm,但与初始状态的β值相比,仅回复了36%。如表1所示,与Azo-o-Bi分子相比,BPO5BA分子在初始状态具有较高的β值,这是由于取代基的引入有利于将手性剂的手性传递至周围的液晶分子中。更重要的是,其螺旋扭曲的方向与Azo-o-Bi分子相反,这可能与分子结构中联萘基团的二面角有关。通过利用GaussView 09软件中B3YP/6-31G机组对两种分子进行理论模拟计算,研究分子结构中联萘基团的二面角(θ)与β/β值间关系。如表1所示,在初始状态下,分子对应的θ值小于90°,而BPO5BA分子对应的θ大于90°,因此两者所具有的螺旋方向不同,Azo-o-Bi分子具有左手螺旋(—),而BPO5BA分子具有右手螺旋(+),因此两者对应的β值的符号相反。从理论计算的结果来看,在初始状态Azo-o-Bi分子的β值应较大,而实验表明,BPO5BA分子具有较大的β值。这表明在联萘基团的6,6′位点处引入侧基BPO5,在提高手性剂分子与液晶主体相容性的同时,能够有效地提高β值,有利于手性剂分子的手性传递。此外,在光异构化过程中BPO5BA分子β较小,仅变化了1.6 μm-1,对应的θ值也应较小,但与理论计算的结果相反,这是由于BPO5BA分子在异构化过程中,偶氮基团的转动受到分子环张力和刚性的限制,从而限制了联萘基团的空间运动,致使θ值较小。
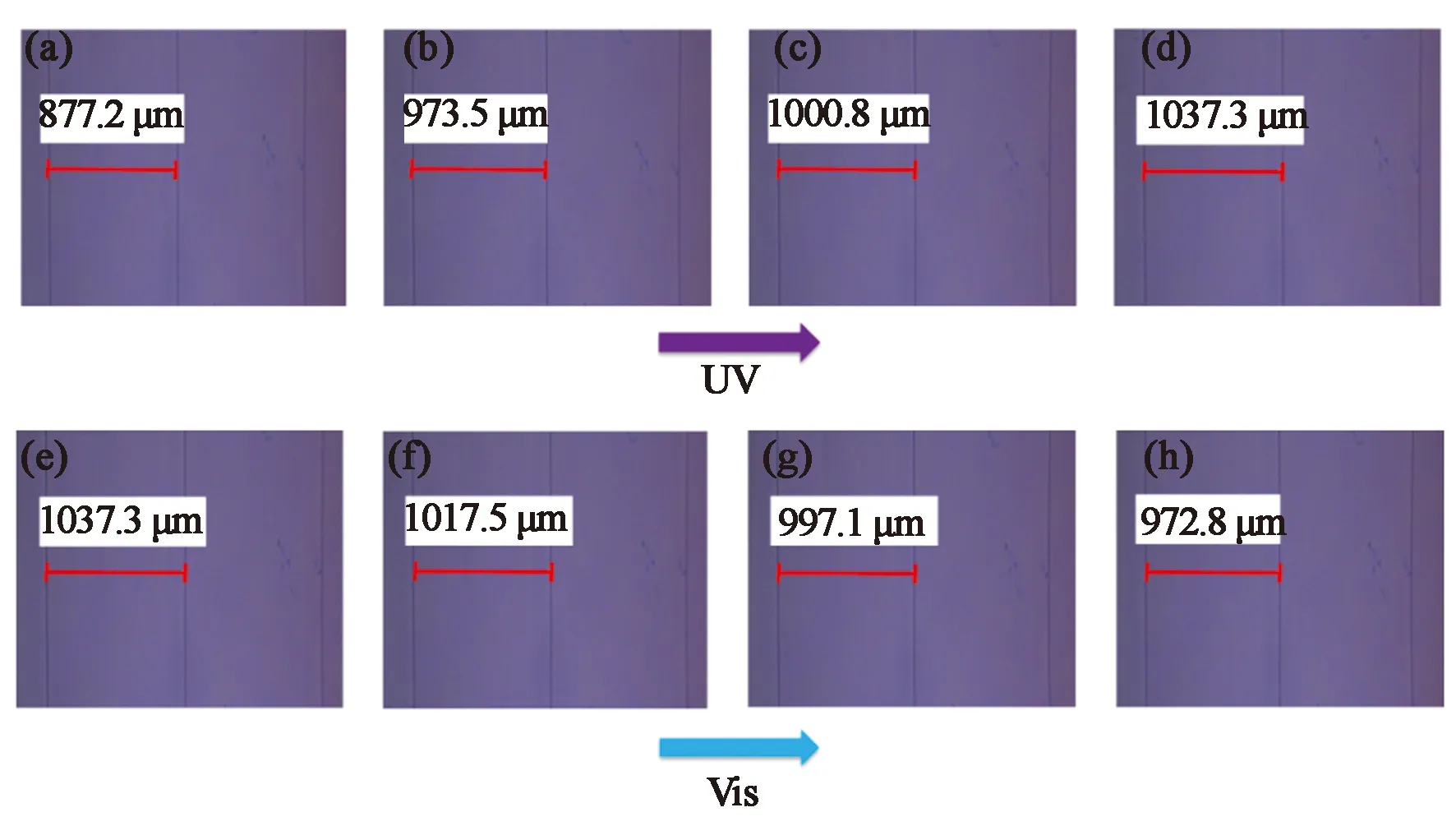
图6 质量分数为0.2%的BPO5BA分子在E7中分别经紫外光光照0 min(a),2 min(b),5 min(c),8 min (d)时的POM图;以及在可见光光照0 min(e),3 min(f),6 min(g),9 min(h)时的POM图。Fig.6 POM images of dopant BPO5BA (0.2%) in E7 upon UV light irradiation at 0 min (a), 2 min (b), 5 min (c), 8 min (d); and then visible light irradiation at 0 min (e), 3 min (f), 6 min (g), 9 min (h).
表1 手性剂的β值及其发生异构化后βTab. 1 β and β induced by the photoisomerization of dopants

表1 手性剂的β值及其发生异构化后βTab. 1 β and β induced by the photoisomerization of dopants
Dopantθ/degβ/μm-1反式顺式初始PSSUVPSSVis│Δβ│/μm-1Azo-o-Bi79.172.9-24.7-35.1-25.29.9BPO5BA97.291.6+28.5+24.1+25.71.6
4 结 论
本文通过在联萘基团的6,6′位点处引入棒状刚性取代基,制备BPO5BA联萘偶氮苯环状手性分子,探究其在溶液和液晶中的光异构化过程,并通过Teas溶解度参数对手性剂分子与液晶分子间的相容性进行研究。通过研究发现,BPO5BA分子中由于刚性共轭基团的引入,会使偶氮苯基团的转动受到环张力和刚性的限制,由此导致该分子在溶剂和液晶中的光异构化程度较低,其中在液晶中的β仅为1.6 μm-1。与Azo-o-Bi分子相比,BPO5BA分子因其反式结构中的θ> 90°而具有相反的右旋扭曲方向,并且具有较大的β值为+28.5 μm-1,这是由于BPO5侧基的引入,降低了手性剂分子与液晶分子间的Δf值,有效提高了手性剂分子与液晶分子间的相容性,从而更有利于将手性传递至液晶分子中。

