Li2Mn0.35Ti0.65O3的高温固相合成与交换性能
江津河,马欣欣,刘方旺,江冠禹
(1.潍坊学院 化学化工与环境工程学院,山东 潍坊 261061;2.青岛科技大学 化工学院,山东 青岛 266042;3.山东外事翻译职业学院 国际商学院,山东 威海 264504)
0 引 言
伴随着锂电池产业的不断发展,尤其是一些轻便式电子设备中锂离子电池的广泛应用,锂电池行业对锂的需求迅速增大[1]。锂资源在陆地上的储存十分有限;卤水与海洋中虽然总量大,但浓度很低,难以直接提取。本文使用高温固相反应法合成具有离子记忆交换能力的复合氧化物Li2Mn0.35Ti0.65O3,实现了从海水中提取锂离子的可能[2-12]。离子交换剂Li2Mn0.35-Ti0.65O3具有制备方法较简单、耐高温、使用方便、价格低廉,较高的离子选择性等优点,在能源、医疗、化学工业和石油化工等方面也表现出良好的特性[13-18]。同时,本文对该交换剂的交换能力也进行了分析。
1 实验部分
1.1 主要试剂和仪器
碳酸锂(A.R.)、乙酸锰(A.R.)、二氧化钛(A.R.);纯乙醇;850型离子色谱仪;DYX型X射线衍射仪;QM-3SP2行星式球磨机;iCE 3300 AAS原子吸收光谱仪;管式加热炉。
1.2 Li2Mn0.35Ti0.65O3的合成与分析
将纯乙醇倒入n(Li)∶n(Mn)∶n(Ti)=2∶0.35∶0.65的装有碳酸锂、乙酸锰和二氧化钛粉末的QM-3SP2球磨罐内。在一定的转速下搅拌8 h,得到研磨较细的混合物并进行压片,放入陶瓷坩埚。810 ℃条件下,将压片进行热处理5 h,从而得到Li-Mn-Ti复合金属氧化物。将该样品标记为LiMnTi-810。根据混合配比,其实际组成为Li2Mn0.35Ti0.65O3。通过XRD检测该物质的结构组成[9-11]。
样品组成分析:称量0.4g LiMnTi-810样品溶于酸性溶液中,用iCE 3300 AAS仪器测定样品成分中Li、Mn和Ti的比例。
1.3 Li-Mn-Ti复合金属氧化物的阳离子抽出及酸改型
将4份0.200 g (LiMnTi-810)金属氧化物样品组分分别浸入50 mL的0.01、0.1、1、10 mol/L的HNO3溶液,均在25 ℃的恒温水中振荡浸取。3 d后,测定4份溶液中上清液的阳离子浓度,从而确定该物质的抗酸能力和Li+、Mn4+、Ti4+的抽出性能。
将7.0 g (LiMnTi-810)样品组分浸入500 mL,1 mol/L的HNO3溶液,在25 ℃的恒温水中间歇振荡。7 d后,可以看到溶液分层,把上层溶液分离出,再倒入新的HNO3溶液。将这一步骤重复2或3次,然后再去离子水洗涤,干燥。在810 ℃下热处理和用酸性物质改性的方法制得的样品记为LiMnTi-810(H)。
1.4 饱和交换能力
称量5份1.000 g的LiMnTi-810(H)样品组分,每份样品被浸入有Li+、Na+、K+、Rb+、Cs+的10 mL,0.1 mol/L的溶液中,均稀释至100 mL并在25℃水中振荡。当交换完成后(文献中提到约9~10 d[10-11]),用微型孔径筛将溶液过滤,检测出溶液中阳离子浓度。同时,再做一个不做任何处理的对照实验组。无机离子交换剂对碱金属离子的饱和交换能力可通过滤液中碱金属离子的减少量计算得出。
1.5 分配系数(Kd)
将5份0.200 g的LiMnTi-810(H)样品组分分别浸入含有Rb+、Na+、Li+、K+、Cs+的0.200 mL,0.05 mol/L的混合溶液(每份混合溶液中,Cl-/OH-均不同,C(Cl-)+C(OH-)=0.100 mol/L,C= Li+,Na+,K+,Rb+和Cs+)。向溶液中加入一定量的去离子水,此时溶液中阳离子总浓度为1.0 mmol/L。将LiMnTi-810(H)样品在25 ℃恒温水中持续振荡7 d后,过滤之后得到每个样品的离子浓度。
2 结果与讨论
2.1 Li2Mn0.35Ti0.65O3的合成与分析
图1是Li2Mn0.35Ti0.65O3晶体的X射线衍射图。通过XRD图比较可得,在810 ℃下,用固相反应法制得的Li2Mn0.35Ti0.65O3晶体具有较好的晶体结构。
经分析可知,样品组分LiMnTi-810的结构组成为Li2.02Mn0.34Ti0.65O2.99,该物质与尖晶石型金属物质的结构大致相同。

图1 Li2.02Mn0.34Ti0.65O2.99晶体的X射线衍射图
2.2 Li-Mn-Ti复合氧化物的阳离子抽出及酸改型
当硝酸溶液浓度不同时,LiMnTi-810中阳离子的抽出率也是不同的。如图2所示,Li+、Mn4+、Ti4+的抽出率分别为43%~89%、4.2%~13.9%、2.4%~8.5%。由图可知,当交换剂浸于1mol/L的HNO3中时,其Li+的抽出率大于Mn4+和Ti4+(在1mol/L的HNO3溶液中,Li+、Mn4+及Ti4+的抽出率分别为78%、9.8%、6.3%)。
实验分析表明,LiMnTi-810(H)的结构组成为H1.79Li0.21Mn0.31Ti0.61O2.98,与酸处理前的Li2.02Mn0.34-Ti0.65O2.99组分相比较,在H1.79Li0.21Mn0.31Ti0.61O2.98组分中,有82%左右的Li+转变为H+。交换剂中约82%的Li+被抽出,并与合成复合金属氧化物有相同的结构组成。

图2 LiMnTi-810在硝酸中的阳离子抽出率
2.3 饱和交换能力
由图3可知,LiMnTi-810(H)对Li+的饱和能力值为6.5 mmol/g,表明合成的物质对Li+的饱和交换能力和记忆性要比其他阳离子更好。主要影响因素:① 溶液中有太多Li+时,溶液中就会发生交换反应,应该先把溶液中原本的Li+去除;② 在稀溶液中,LiMnTi-810(H)对Li+的交换能力值大于其他阳离子,表明反应更容易发生在裸离子之间;③ 反应过程中,H+不仅取代Li+,而且Li+表面发生反应,表明LiMnTi-810(H)对Li+有高的交换能力。

图3 LiMnTi-810(H)对碱金属离子的离子半径与碱金属饱和离子交换能力之间的关系
2.4 分配系数
通常离子交换选择能力的强弱用分配系数Kd进行表征。如图4所示,当pH值增大时,LiMnTi-810(H)对Li+、Na+、K+、Rb+、Cs+的分配系数值也逐渐上升。选择性顺序大小如下所示:
Li+>Cs+>Rb+>K+>Na+
这表明LiMnTi-810(H)对Li+的离子选择性最好。离子交换反应是一种可逆反应。存在的H+与溶液中存在的阳离子的反应如下所示(以Rb+举例说明):
E-H+Rb+⟺E-Rb+H+
2.5 重复离子交换后容量下降情况
由图5可知,当酸浸离子交换次数增加,LiMnTi-810(H)的饱和交换容量呈下降趋势,主要是酸浸次数增多,原来的尖晶石结构受到的破坏程度越大,从而导致对锂离子的交换能力下降。

图4 LiMnTi-810(H)对碱金属离子的分配系数
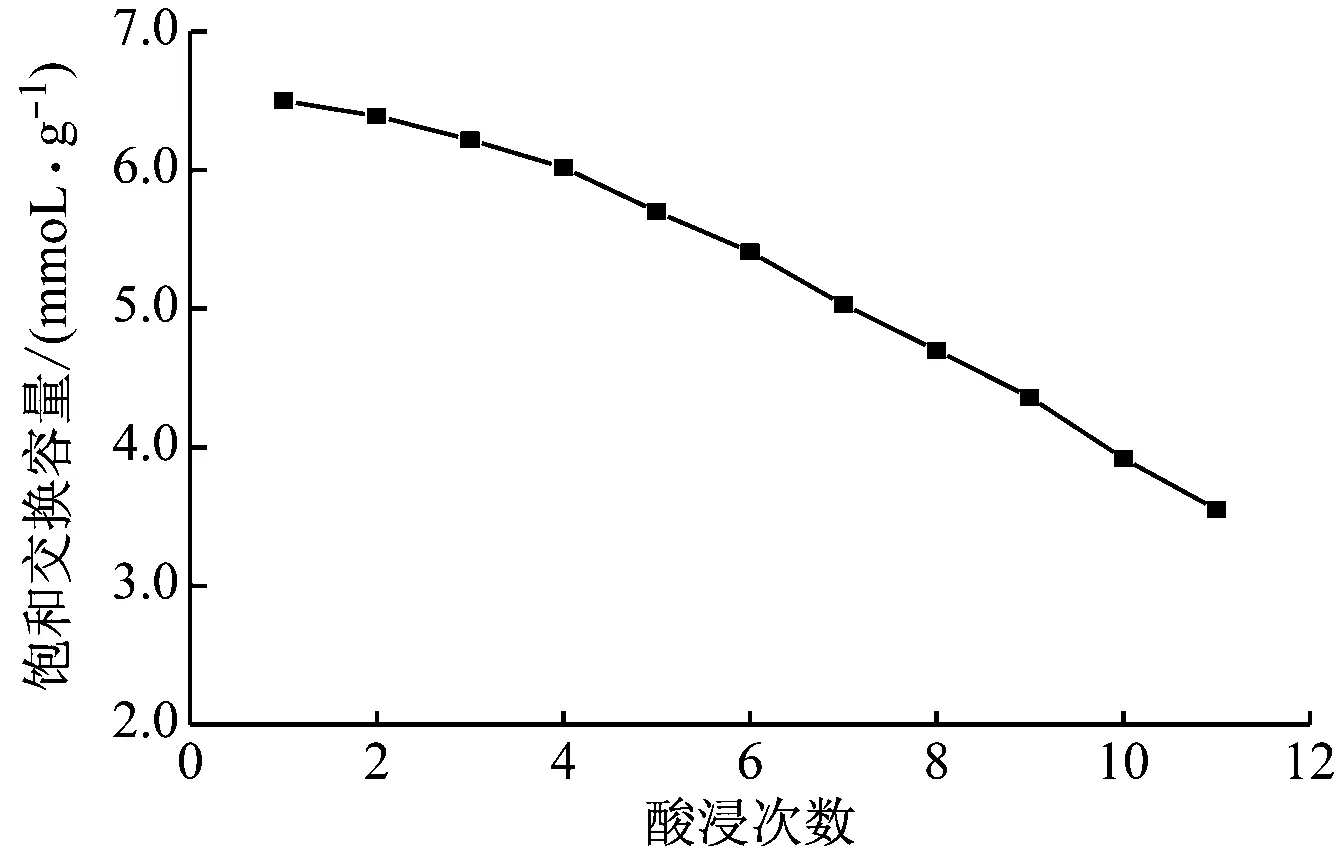
图5 LiMnTi-810(H)酸浸离子交换次数的影响
3 结 语
通过XRD测定该物质结构,810 ℃下固相反应热结晶方法制得的Li2Mn0.35Ti0.65O3具有更好的晶体结构,酸浸出大部分锂离子后其结构组成保持不变,对其他参数值的测定,可知随着碱金属离子半径的的增大,其饱和交换能力减小,表明无机离子交换剂Li2Mn0.35-Ti0.65O3具有较好的Li+记忆性和选择性,溶液中锂离子以进入交换剂空腔的形式为主,吸附为辅,其对Li+的交换能力高达6.5 mmol/g。Li2Mn0.35Ti0.65O3是具有非常好前景的锂离子筛交换剂,但随着酸浸交换次数的增多,交换剂结构受到一定的破坏,导致离子交换容量的下降,需要在酸度及造粒上做进一步改进。

