水产品中嗜水气单胞菌耐药性研究进展
任亚林,李耘,韩刚,朱锋,刘畅,宋金龙
1 中国农业科学院 农业质量标准与检测技术研究所,北京 100081
2 中国水产科学研究院,北京 100141
1 嗜水气单胞菌耐药性现状
嗜水气单胞菌Aeromonas hydrophila是引起水产养殖病害的最常见致病菌之一,广泛存在于水体、土壤及水生动物体内,是一种典型的人-畜-水生动物共患病的条件致病菌,可大规模引起淡水鱼类皮肤溃疡和急性出血性败血症[1-5]。近年来,人类因嗜水气单胞菌感染而发生急性霍乱及伤口化脓的病例也时有报道[6]。由于抗菌药物的不合理使用以及耐药菌株和耐药基因的传播,导致嗜水气单胞菌耐药问题突出[7-9],给水产动物嗜水气单胞菌病的防治带来困难,同时严重影响水产动物源食品的质量安全。
嗜水气单孢菌耐药菌株表现出耐药谱广、耐药率高的特点[10-11]。目前,从水生动物中分离出的嗜水气单胞菌多耐药现象普遍,表1以韩国地区为例综述了2018年不同水生动物源分离株对多种抗生素的耐药率,结果显示,菌株对β-内酰胺类、氨基糖苷类、喹诺酮类等多种抗生素均有不同程度耐药。虽然不同地区用药方式的区别导致菌株耐受情况不同,但表1仍在一定程度反映了当前嗜水气单胞菌耐药现状。
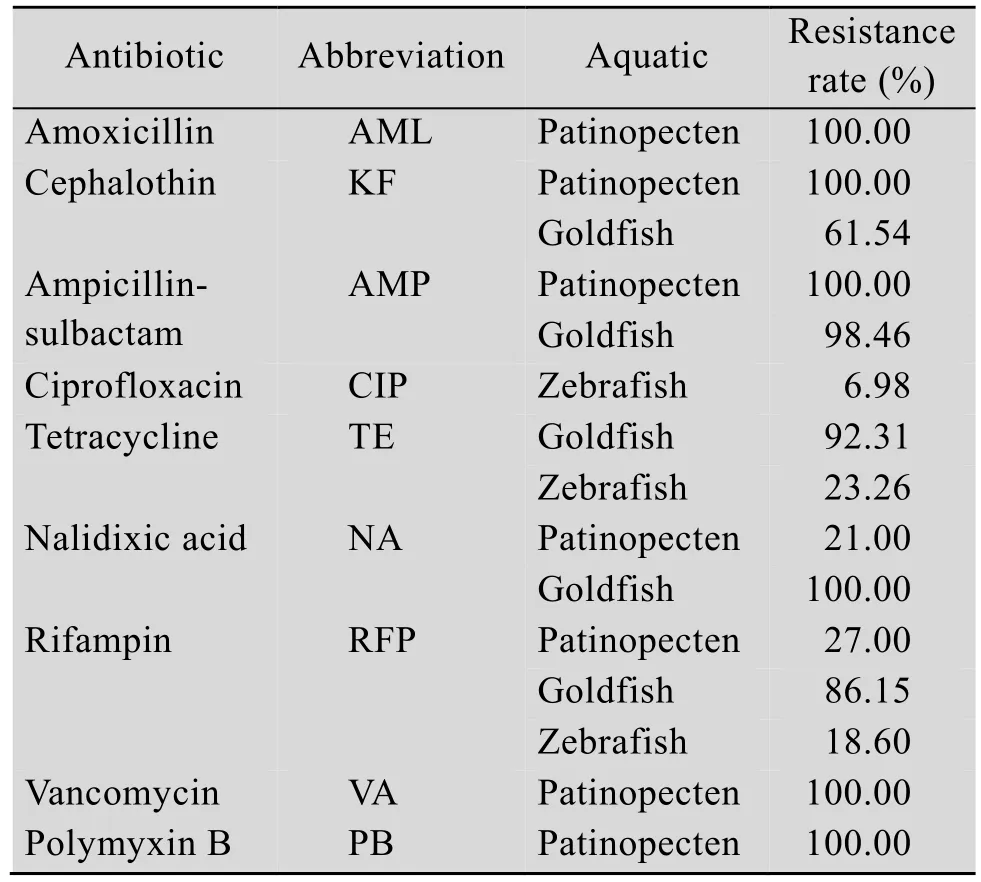
表1 2018年韩国地区水产源嗜水气单胞菌对常见抗生素的耐药率[12-14]Table 1 Antimicrobial resistance rate of Aeromonas hydrophila in in South Korea in 2018[12-14]
2 嗜水气单胞菌耐药机制
2.1 获得性耐药
细菌耐药机制包括固有耐药性和获得耐药性。固有耐药性由细菌染色体上耐药基因引起,细菌对某些抗生素不敏感,具有典型的种属特异性,研究报道[15]气单胞菌对青霉素具有固有抗性,其细胞壁最外层由疏水性脂多糖形成,阻止一些未修饰青霉素的扩散,此耐药性为细菌所固有,与抗菌药物的使用无关。
获得性耐药指通过质粒、转座子及整合子等介导的基因水平转移以及染色体突变方式而使细菌获得新的基因,从而具有耐药性,获得性耐药是细菌耐药主要因素。多项研究[16-17]表明,水环境可充当抗生素抗性基因储库,细菌通过质粒等可移动元件介导的基因水平转移从环境中其他耐药菌获得抗药基因,导致复杂表型出现,甚至多重耐药 (Multi-drug resistance,MDR) 发生。并且,近期Collignon等[18]研究显示耐药菌株和耐药基因的传播可能是耐药性扩散的主要因素。Fu等[19]研究发现在水族箱中引入携带自我转移质粒编码抗生素抗性基因 (ARG) 的供体后,斑马鱼内脏中15%的菌群通过RP4介导的接合转移获得ARG。Hossain等[20]通过PCR检测抗菌药物耐药基因发现,在质粒介导的耐喹诺酮类菌株中耐药基因qnrS最常见,占比73.85%。Alcaide等[21]通过PCR检测喹诺酮耐药决定区 (QRDR) 靶位突变情况,发现33株气单胞菌对喹诺酮类药物的耐药性与QRDR区DNA促旋酶gyrA和DNA拓扑异构酶parC基因突变有关。
2.2 主动外排泵作用
由细菌中膜定位泵蛋白组成的外排系统负责排出各种外源和内源性物质,与细菌抗生素耐药密切相关。Hernould等[22]首次报道了嗜水气单胞菌存在引起内源性多重耐药的外排泵机制。Chenia等[23]研究发现,在诱导嗜水气单胞菌的药敏试验中添加外排泵抑制剂PAβN后,萘啶酸耐药性减少2倍,证实外排泵在嗜水气单胞菌耐药中起到重要作用。同样,Pu等[24]利用体内荧光成像和高通量测序技术研究发现,在β-内酰胺类抗生素处理下,TolC等多种药外排基因表达量显著增加,由于外排活性增强,细菌内药物积累量降低而产生耐药性;试验结果证明,外排抑制剂和抗生素共同作用可有效减少耐药性形成。
另外,有研究发现[25-26]活性氧自由基 (ROS)在细菌耐药及抗生素杀菌方面发挥重要作用。非致死浓度的抗生素作用下产生的ROS 会通过影响MarR (Multiple antibiotic resistance repressor)-MarA (Multiple antibiotic resistance activator) 激活药物外排泵,通过SoxR (Superoxide response transcriptional regulator)-SoxS (Superoxide response transcription factor) 途径启动细菌应激保护机制以及通过促进SOS DNA 损伤修复系统诱导耐药突变,从而产生耐药性。而致死浓度的抗生素作用产生的ROS则会参与抗生素杀菌并减少耐药菌产生。
2.3 细胞膜渗透性改变
革兰氏阴性菌耐药菌株难以防控主要是因为其具有不对称双层外膜,疏水抗生素如氨基糖苷类和大环内酯类通过新陈代谢的功能依赖性扩散穿过细胞膜[27]。然而,目前识别小分子渗透性的方法较为欠缺,严重限制了对抗生素通过外膜渗透相关分子机制的认识,这也是革兰氏阴性菌耐药性机制研究需要填补的空白。Joris等[28]研究发现,暴露于H2O2条件下,细菌通过周质中蛋白质内纽带 (外膜和内膜之间的空隙) 结构的变化来打开或关闭特定间隙,并改变对活性氧物质及β-内酰胺类抗生素摄取的敏感性。同时还证实通过改变外膜孔蛋白通道调节细菌膜渗透性可影响细菌毒力特征及抗生素耐受性。另外嗜水气单胞菌有S层,由蛋白或糖蛋白亚单位组成,规则排列于细胞表面,耐药菌合成此类物质过多,分子间距变小同样可能是药物受阻和表面结构变化的原因之一。
2.4 抗生素原位降解和酶修饰
嗜水气单胞菌可降解或修饰抗生素,以产生耐药性。Vilacosta等[29]通过监测ARG、营养素、磺胺类抗生素及其降解产物浓度以研究水生系统中细菌对磺胺类抗生素的主要耐受机制。研究结果显示,在试验前4周,磺胺类抗生素被生物膜很好地降解;添加高浓度抗生素后,生物膜中ARG丰度急剧下降,但用低浓度抗生素处理时未观察到此现象;在污染水域添加高浓度磺胺类抗生素 (较低ARG丰度),其降解速度更快,这表明抗生素原位降解和ARG是微生物群体采用的两种互补抗性策略,原位降解在高浓度抗生素添加中发挥作用,而ARG扩散在相对较低的抗生素浓度下更为重要。
细菌还可通过酶将化学基团添加到抗生素分子上的易受攻击部位,使之产生位阻使抗生素不能与靶蛋白结合,从而产生抗生素耐药性。过去的研究[30]表明,C类β-内酰胺酶可使嗜水气单胞菌对头孢类抗生素产生耐药性;另外,氨基糖苷类抗生素具有很多暴露的羟基和酰胺基团,易被修饰,氨基糖苷类钝化酶使得细菌对所修饰的抗生素具有高水平耐药性。常见的氨基糖苷类钝化酶有乙酰转移酶、磷酸转移酶和腺苷酸转移酶,分子动力学研究表明这3种酶均可与氨基糖苷类药物结合,因为其活性位点模拟了核糖体结合分裂的目标环境[31]。
3 耐药性防控措施
细菌耐药性的传播和加剧使其对人类的生存健康和生产生活造成极大危害。世界卫生组织(WHO)、欧盟食品安全局(EFSA)以及美国疾病预防中心 (CDC)、美国食品药品监督管理局(FDA)、美国农业部 (USDA) 等均强调削减和预防微生物耐药性传播为当今疾病预防和公共安全的重点研究内容。目前,在使用抗生素或抗菌药物的基础上寻求新的方法以控制细菌耐药性是未来的严峻挑战。
3.1 天然活性替代药物使用
目前,益生菌、生物肽、噬菌体、溶菌酶等广泛用于传统抗生素替代品以控制耐药菌产生。世界卫生组织 (WHO) 定义益生菌是一定数量可对宿主健康产生有益作用、活的微生物。在水产养殖中,益生菌主要通过促进消化酶、抑制致病微生物、促生长因子和增强宿主免疫等途径维持水产品健康。Yi等[32]研究发现益生菌BacillusvelezensisJW对嗜水气单胞菌等各种鱼类致病细菌具有抗菌活性,且JW菌株喂养的鱼在嗜水气单胞菌感染后存活率显著提高。Bustillo等[33]研究发现,完整的Hipposin生物肽中含有parasin和buforinⅡ(BF2) 序列,这两种已知的抗菌肽通过不同的抗菌机制起作用。其中parasin通过诱导膜透化杀死细菌,且此作用与其N-末端结构域的存在有关;而buforinⅡ通过进入细胞后与细胞内核酸互作损伤细菌。Le等[34]研究发现噬菌体可有效抑制气单胞菌的生长,对抗多重耐抗生素的气单胞菌株也具有广泛活性,证明使用噬菌体可作为有效的生物治疗方法来控制水产养殖中气单胞菌败血症 (MAS) 的发生。
中药具有抗病菌、抗病毒及提高免疫力等作用,具备抗生素作用的同时又克服了化学药的缺陷。Dong等[35]研究发现中药活性成分厚朴酚可通过抑制气单胞菌溶素编码基因aerA在低浓度下的转录,抑制嗜水气单胞菌的溶血活性;活性试验结果表明,厚朴酚可显著降低通道鲶鱼因嗜水气单胞菌感染引起的死亡率。植物化学物质也具有杀菌、抑菌活性,且在浓度低于抑制细菌生长的浓度下也能够抑制毒力因子。Syahidah等[36]通过薄层色谱-生物自显影方法测定蒌叶提取物的抑菌作用,结果显示羟基沙蒿素和丁子香酚具有显著的抗菌活性,蒌叶的提取物或其化合物可以作为用于水产养殖疾病管理的有效天然抗菌剂的替代来源。另外,β-葡聚糖也可作为抗生素替代物防止水产品细菌性感染疾病的发生,Jung-Schroers等[37]研究发现以添加β-葡聚糖的饲料喂养感染嗜水气单胞菌的鲤鱼,其杯状细胞上填充的粘蛋白减少,粘液明显从杯状细胞释放,这可以保护性抵抗致病菌,防止鲤鱼肠道感染。另外,Yildirim-Aksoy等[38]研究报道,壳聚糖 (CS) 及其衍生物壳聚糖寡糖乳酸 (COL) 均可按照侵袭过程对嗜水气单胞菌表现出抗菌活性,即从阻碍细菌吸附开始,导致细胞内成分的泄漏至最终细胞凋亡。总之,绿色养殖是未来发展趋势,也是我国大力推进的重要方向。
3.2 联合用药延缓耐药性发生和提升药敏性
某种药物的抗性菌株通常对其他药物表现出抗性或易感性,称为交叉耐药或超敏感性现象[39-40],抗生素之间的超敏感现象为联合用药提供思路。有研究表明[41-42],对氨基糖苷类如阿米卡星 (AMK) 等具有抗性的大肠杆菌菌株对其他类型的药物表现出更高敏感性,包括DNA复制抑制剂喹诺酮类、细胞壁合成抑制剂β-内酰胺类等;相反,对这些抗生素具有抗性的菌株也显示出对氨基糖苷类的高度易感性。转录组分析结果显示,抗生素抗性之间的权衡机制是由质子动力(PMF) 在细胞膜上的变化所引起,氨基糖苷类抗性菌株中PMF降低可导致多药外排泵AcrAB活性降低,进而对其他药物更敏感;另一方面,在对喹诺酮类和氯霉素等各种药物具有抗性的菌株中,抗性是由AcrAB的活性增加引起,AcrAB活化电子传输系统 (ETS) 以维持跨质膜的质子平衡,ETS的激活导致对氨基糖苷类药物的高度易感性。同时使用这些药物组合可以抑制耐药性的发展。由此,抑制电子转移系统或干扰质子动力形成的化学物可能会抑制耐药性的出现及发展。
中药单体与抗生素联合,既可提高治疗效果、降低耐药菌的产生,又可保护环境、减少药物残留,弥补了中药和抗生素单味用药的不足。Bandeira等[43]研究了5种植物化学物质 (香芹酚、柠檬醛、丁子香酚、芳樟醇和百里酚) 单独使用及与氟苯尼考或土霉素组合对银鲶分离细菌的抗菌活性。棋盘分析 (Checkerboard assay) 结果显示,芳樟醇与氟苯尼考或土霉素联用对嗜水气单胞菌的抵抗作用呈现协同效应,且这些植物化学物质均可抑制由细菌引起的生物膜形成和溶血。卢静等[44]的研究也表明,没食子酸和槲皮素对嗜水气单胞菌及温和气单胞菌具有显著的抑制作用,二者与恩诺沙星、诺氟沙星、氟苯尼考等抗生素联合应用具有相加或协同作用,有助于降低抗生素的用量及残留。上述研究成果均为控制嗜水气单胞菌在水产养殖中的危害提供新的思路和方向,也是未来水产动物健康养殖的主要趋势。
3.3 改善养殖的水域环境
水生环境是水产品耐药性出现和传播的重要背景。越来越多的证据表明,水生系统可作为耐药菌株和基因的潜在储存库,可重新进入临床或人体,即使在抗生素不存在的情况下也会导致复杂表型的出现;此外,水生系统充当了孵化器,为耐药菌和基因传播提供适宜条件。改善养殖环境水质、建立一个环境友好的水产养殖系统是防控耐药性发生的重要手段。Borgia等[45]研究表明鱼类长期暴露于0.004%、0.007%、0.01%和0.013%的电子工业废水中,其非特异性及特异性免疫应答能力均呈剂量依赖模式显著降低。Ying等[46]在中国台湾西南部建立了一个基于陆地、农场规模的多营养水产养殖 (IMTA) 系统,将鱼类、贝类与海藻共培养。试验结果表明,IMTA系统中抗磺胺类药物表型菌株与初始海水中的数量相当,而传统农业系统中表现出更高的磺胺抗性。此外,IMTA系统可更好地维持细菌群落结构的完整性,代表一种维持海洋环境可持续性、具有潜在价值的水产养殖系统。采用最佳饲养条件,如控制饲料率、水溶氧、养殖密度和温度等可有效预防鱼类细菌性疾病的发生;另外,鱼类饮食也至关重要,保证蛋白质的充足供应以最大限度促进生长,并辅加维生素和微量元素用于控制疾病和调节鱼类的抗御能力,抵抗感染。
4 总结及展望
抑制耐药菌的产生及传播已成为全球性关注的热点问题。当前,缓解耐药性的方法主要聚焦于使用噬菌体、新型绿色天然药物研发、限制抗生素使用或优化联合用药方案等以增强现有抗生素杀菌效果。然而,目前新型抗菌药物的研制速度远比不上耐药菌产生速度,且持续开发新型药物极具挑战和难度;另外,替代药物的开发应用仍停留在实验研究阶段,且价格昂贵的替代药物不适宜推广应用。同时,相对于养殖环境,水体环境更为开放,防控难度更大。探究耐药成因、耐药机制以及药物联用的潜在协同作用,优化给药方案,延缓或削减现有及新型抗生素耐药性发生,这在短期内具有重大意义。

