阿尔茨海默病患者不同脑区SOD-2与SIRT3的表达水平及相关性*
向洁, 曹坤, 董阳婷, 曾晓晓, 徐毅, 冉龙艳, 邓婕, 官志忠,**
(1.贵州医科大学附院 病理科, 贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550004; 3.贵州医科大学 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
阿尔兹海默病(alzheimer’s disease,AD)又称老年性痴呆,是一种主要在老年期发生的神经元退行性变疾病,以进行性痴呆为主要特征,主要神经病理学改变有老年斑增多、神经元纤维缠结形成、神经元丧失及脑萎缩[1]。近年来随着以清除Aβ为主流的临床III期治疗药物研究的失败,进一步阐明AD的分子发生机制、分析临床研究失败的原因、以及采取新的治疗途径等成为当前AD研究的热点[2]。超氧化物歧化酶(superoxide dismutase,SOD)是一种含有金属元素的活性蛋白酶,可分为铜-锌-SOD(Cu-Zn-SOD,SOD-1)、锰-SOD(Mn-SOD,SOD-2)和铁-SOD(Fe-SOD,SOD-3)三种。其中,SOD-2是线粒体内重要的抗氧化物酶,可将超氧化物分解为水和过氧化氢,从而保护细胞免受氧化损伤。沉默信息调节因子-3(silent information regulator 3,SIRT3)是一种依赖NAD+的去乙酰化酶,主要定位于线粒体,与多种生物学功能密切相关,其中包括ATP生成,氧自由基清除及维持线粒体稳态等[3]。SOD-2及SIRT3都参与调节线粒体功能、抵抗氧化应激,在神经退行性疾病中起着关键作用。有研究表明,SIRT3能通过提高SOD-2活性,从而增强机体抗氧化的作用[4]。另外SIRT3协同SOD-2在衰老、致癌等方面也有着至关重要的作用[5-6],但它们在AD发病机制中的作用报道甚少,本研究以人脑组织为标本,探讨AD患者和对照组的不同脑区SOD-2和SIRT3的表达、分布及两者的关系。
1 材料与方法
1.1 试剂与材料
1.1.1抗体试剂 兔多克隆抗SOD-2抗体(美国genetex公司),小鼠多单隆抗SIRT3抗体(美国Santa Cruze公司),山羊抗鼠IgG标记cy-3和山羊抗兔IgG标记488(美国Thermo Fisher Scientific公司),免疫组织化学通用二步法试剂盒、DAB显色试剂盒、PBS缓冲液、柠檬酸盐、山羊血清(中杉金桥生物技术有限公司)
1.1.2人脑样本 由荷兰阿姆斯特丹人脑组织标本库提供AD患者(AD组)及正常人(对照组)各10例尸体解剖后脑组织标本蜡块,有大脑颞叶皮质、额叶皮质、海马及小脑等不同脑区。AD患者死亡时平均年龄为(81.5±7.1)岁,正常对照组为(79.4±9.2)岁;AD患者和对照组的死后间隔时间(PMI,死亡和尸检间隔)分别为(5.1±1.0)h和(8.0±3.4)h,研究对象的临床和神经病理学特征见表1。AD诊断根据患者的病史、临床表现和实验室检查,排除了其他可能的痴呆原因,同时根据美国国立神经病、语言交流障碍和卒中研究所标准对AD患者痴呆严重程度进行了临床分级。患者与对照组脑组织标本在各种因素上均具有良好的匹配性,包括生前和死后相关因素。生前因素包括年龄、性别、疾病状态和死亡时间,死后因素包括死后尸检时间、固定方式、保存时间等[7-9]。所提供的AD样本患者均未接受胆碱能抑制剂等特殊治疗。本研究获得贵州医科大学伦理委员会批准(2018第67号)。
1.2 方法
1.2.1免疫组织化学染色 将不同脑区的石蜡包埋标本行脑组织切片,厚度6 μm,60~65 ℃烤片1 h,将切片置于二甲苯及不同浓度乙醇脱蜡水化,0.25% PBST缓冲液洗涤切片;随后采用微波修复对切片进行组织抗原修复,待切片自然冷却后于切片上滴加内源性过氧化物酶阻断剂,室温孵育10 min;山羊血清工作液封闭1 h,滴加抗SOD-2(1∶200)、抗SIRT3(1∶200)抗体,4 ℃过夜,PBST缓冲液冲洗,滴加适量的反应增强液,室温孵育20 min,PBST缓冲液再次冲洗,滴加增强酶标羊抗小鼠/兔IgG聚合物,室温孵育20 min;加入适量新鲜配置的DAB显色液,室温孵育5~8 min后,清水终止显色;脱水、透明,中性树胶封片,镜检。

表1 两组研究对象的临床和神经病理学特征Tab.1 Clinical and neuropathological characteristics of the patients with AD and control subjects
注:AD1~AD10为AD患者,NFT为根据神经纤维缠结的分布和数量对AD的分级,Aβ为根据老年斑对AD的分级
1.2.2结果判定 每张切片随机选择5个视野(原始放大倍数为200倍),将5个视野的阳性蛋白表达平均灰度值作为每一张切片的阳性蛋白表达的灰度值。最后计算阳性细胞数以及SIRT3、SOD-2平均光密度(IOD)。
1.3 统计学分析

2 结果
2.1 SOD-2表达
脑组织中SOD-2的表达定位于细胞质中(图1A)。与对照组相比,AD组颞叶、额叶、海马等脑区中SOD-2阳性细胞数(图1B)及IOD值(图1C) 均降低(P<0.05);AD组和对照组小脑中SOD-2阳性细胞数及IOD值比较,差异无统计学意义(P>0.05)。

注:A放大200倍、白框中放大400倍,(1)与对照组比较,P<0.05图1 SOD-2在AD组及对照组大脑颞叶、额叶、海马和小脑的分布及表达(DAB染色)Fig.1 Immunohistochemical staining for SOD2 in cerebral temporal lobe, frontal lobe, hippocampus and cerebellum of patients with AD and control subjects
2.2 SIRT3表达
脑组织中SIRT3主要表达定位于细胞质中(图2A)。半定量分析显示,SIRT3阳性细胞数在AD患者颞叶、额叶、海马中均少于对对照组,差异有统计学意义(P<0.05),而在小脑中两组SIRT3阳性细胞数比较,差异无统计学意义(P>0.05),见图2B;同样,IOD值在AD组颞叶、额叶、海马中均低于对照组,差异有统计学意义(P<0.05),在小脑中两组IOD值比较,差异无统计学意义(P>0.05),见图2C。

注:A放大200倍、白框中放大400倍,(1)与对照组比较,P<0.05图2 SIRT3在AD患者及对照组大脑颞叶、额叶、海马和小脑分布及表达(DAB染色)Fig.2 Immunohistochemical staining for SIRT3 in cerebral temporal lobe, frontal lobe, hippocampus and cerebellum of AD patients and control subjects
2.3 AD患者SOD-2与SIRT3表达的关系
AD患者脑组织中,SOD-2与SIRT3蛋白表达水平在大脑颞叶(r2=0.425,P=0.041)、额叶(r2=0.411,P=0.046)及海马(r2=0.402,P=0.049)中呈正相关,说明随着SOD-2蛋白水平降低,SIRT3蛋白水平也降低(图3A、B、C)。在小脑中,这两种蛋白之间则没有相关性(r2=0.031,P=0.624),见图3D。
3 讨论
AD病因十分复杂,涉及遗传、环境等多种因素。大量研究表明,氧化应激损伤是AD发病机制中至关重要的影响因素[10]。Aβ的大量蓄积可直接破坏线粒体电子传递链,从而增加ROS的产生[11],并且影响ATP的生成[12]。另一方面,作为氧化代谢的重要场所,同时也是ROS产生和消除的重要场所。线粒体内ROS水平升高,进一步可导致线粒体凋亡[13]。本研究以定位于线粒体的关键蛋白SOD-2及 SIRT3作为研究对象,探讨两者在AD患者中的表达及相关性。研究结果显示,AD患者颞叶、额叶、海马中,SOD-2及 SIRT3表达水平较对照组明显降低,而在小脑未见明显改变。
基于对抗氧化应激损伤的AD治疗研究中发现,SOD-2基因多态性与AD的发生发展有关[14],拟AD动物模型Tg2576小鼠中SOD-2的过表达可降低小鼠脑组织海马过氧化物的含量,并可预防记忆缺陷[15]。进一步证实,SOD-2是线粒体内主要的氧自由基清除剂,在维持线粒体功能、体内外抗氧化损伤中发挥着主要作用。
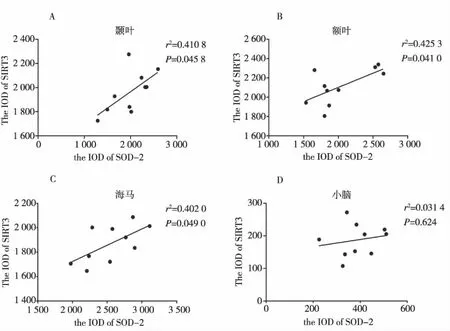
图3 AD患者大脑颞叶、额叶、海马和小脑中SOD-2与SIRT3蛋白表达的相关性Fig.3 The correlation between SOD2 and SIRT3 in SOD-2 in cerebral temporal lobe, frontal lobe, hippocampus and cerebellum of AD patients
Sirtuins蛋白家族是一组依赖烟腺嘌呤二核苷酸(NAD)的去乙酰化蛋白,家族包括7个成员,其中SIRT3的活性形式存在于线粒体基质,通过去乙酰化作用调节线粒体代谢,包括ATP的产生,ROS的代谢和细胞凋亡。SIRT3基因与衰老密切相关[16],且其升高能减轻Aβ的神经毒性,介导对神经退行性疾病的保护作用[17]。
SOD-2作为氧化应激反应中最重要最基础的抗氧化酶,可能与共同表达在线粒体的SIRT3有着密切的联系,或许介导其神经保护作用。研究表明,SOD-2与SIRT3联系密切, SIRT3是通过SOD-2的增多来实现抗ROS的作用[18]。在成骨细胞分化过程中,SIRT3可通过改变SOD-2表达,清除线粒体内的ROS,促进成骨细胞分化,而敲除SOD-2和SIRT3基因后,可抑制成骨细胞分化[19]。另一方面,抑制SIRT3-SOD-2-线粒体信号通路,可诱导血管炎症,促进动脉粥样硬化[20]。而在神经退行性疾病中,模拟亨廷顿病和癫痫的SIRT3缺陷小鼠表现出更多的神经元损伤,这种损伤最主要原因也与SOD-2含量降低有关[21]。目前两者在AD发病机制的研究较少,本研究结果显示,SOD-2 及SIRT3在AD病变较重的脑区,如颞叶、额叶、海马中表达减少,且在这3个脑区中,SOD-2表达与SIRT3表达存在正相关,说明SOD-2含量减少,SIRT3表达也减少,由此推测SOD-2与SIRT3共同参与了AD发病过程中线粒体能量代谢障碍的过程,从而导致抗氧化应激作用降低,可能是AD氧化应激假说的一个重要因素。
综上所述,AD患者颞叶、额叶、海马等脑区中SOD-2和SIRT3表达降低,SOD-2表达水平与SIRT3表达水平呈正相关,可能与该病的神经病理学改变有关。

