层粘连蛋白对奶牛乳腺上皮细胞乳蛋白表达的调控
王春梅,门晶晶,李璐,张娜,王保胜,赵锋
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
0 引 言
泌乳期奶牛的产奶量是由泌乳乳腺上皮细胞的数目和分泌能力决定的,而特定环境下细胞内外的信息交流是决定单个乳腺上皮细胞合成和分泌乳成分的直接因素。在正常生理状态下,乳腺上皮细胞借助于细胞表面的黏附分子锚定在细胞外基质(extracelular matrix,ECM)上,通过细胞-ECM相互作用实现信号转导,共同调控乳腺发育与泌乳。
基膜属于一种特化的ECM,在体内位于乳腺上皮细胞基底侧,是细胞黏附锚定的平台。近些年,一些涉及到乳腺上皮细胞体外模型建立的研究发现,当培养在重组的基膜凝胶上时,乳腺上皮细胞表现出呈圆形,聚集成簇,具有细胞连接和顶-基底极性的特点。这种三维“mammospheres”与体内泌乳期腺泡十分类似,具备合成分泌乳蛋白的能力。因此,乳腺上皮细胞和周围基膜的相互作用是乳腺发育过程中表型变化的关键调控因素[1]。
基膜诱导的乳腺上皮细胞泌乳功能分化事件往往早于全面的腺泡形态发生[2]。例如,含基膜蛋白成分的培养液诱发尚不具备泌乳功能的乳腺上皮细胞融合单层中的细胞形态收拢呈圆形,并且部分细胞发生分化[3],同时诱发乳铁蛋白基因表达[4]。在体内,乳铁蛋白是妊娠早期最先表达的乳蛋白。而一旦当这些“圆”细胞形成,第二种乳蛋白β-酪蛋白的基因被迅速的诱导表达[5]。在体内,β-酪蛋白是妊娠中期最先表达的乳蛋白。显然,细胞形态的改变使得它们能够快速应答基膜激活的泌乳分化信号,为其他乳蛋白合成信号转导途径做准备[6]。
在小鼠中的实验结果显示,乳腺上皮细胞实现泌乳功能分化至少需要两种类型信号,促(催)乳激素(如催乳素、胰岛素和氢化可的松)和基膜[7],进一步研究表明,基膜的主要成分——层粘连蛋白(laminin,LN)与催乳素的联合效应是细胞实现泌乳分化的必要条件。例如,富含LN的细胞外基质作为培养底物时,用催乳素(22 ku肽激素)刺激,信号分子PI3K被限定在基底侧[8],有利于JAK2-STAT5途径的正确激活[9-10],而在缺少LN的对照基质条件下,JAK2-STAT 5途径只能短暂激活,不能启动乳蛋白基因表达[9]。在体内和原代组织培养模型敲除β1整联蛋白基因,动物个体表现为腺泡形态缺陷,STAT5不能转位入核,抑制催乳素激活的JAK2-STAT5途径[11-12]。因此,β1整联蛋白和LN的相互作用也是维持STAT 5活性的必要条件,也就是说β1整联蛋白介导了LN与催乳素的联合效应[9]。
整联蛋白亚基α6、β1和β4能形成两种整联蛋白异二聚体α6β1、α6β4,它们都是LN的细胞表面受体。而实际上,在包括牛在内的大多数动物乳腺组织也已经发现多种整联蛋白亚基(包括α6、β1和β4)表达于乳腺上皮细胞。另外,Murney R等在分析不同挤奶频率的奶牛乳区的泌乳能力差异时,发现β1整联蛋白丰度变化可能是先影响了BMECs的PRL应答能力,进而实现调控BMECs分泌活性的[13]。
在BMECs体外培养时,β1整联蛋白表达对其乳成分合成究竟有何影响,LN和PRL信号是否需要β1整联蛋白介导,尚需进一步阐明。因此,本实验以健康泌乳期奶牛的乳腺上皮细胞为实验对象,以LN为底物,使用含有催乳素的分化培养液诱导细胞的乳蛋白合成。通过检测BMECs中β1整联蛋白的表达,分析其表达与β-酪蛋白合成的关系,对阐明上述问题进行了初步探索。
1 材料与方法
1.1 主要试剂与仪器
VE-108B垂直电泳槽(Tanon),VE-186湿转电泳槽(Tanon),PrimeScript TMRT Reagent Ki(t TaKa-Ra),SYBR Premix Ex TagTM试剂盒(TaKaRa),紫外分光光度计(Thermo),冰冻切片机(Leica),激光共聚焦扫描显微镜(Leica TCS SP2),流式细胞仪(BD,FACSAriaTMIIu),荧光定量PCR仪(Roche,LightCycle480)。
1.2 试验动物与取材
样本组织取自屠宰点奶牛泌乳乳腺,一部分切割成小块,-80℃冻存备用,其余组织采用酶消化法,获取原代奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)进行纯化培养。
1.3 细胞培养与分组
纯化后的细胞制成细胞爬片,对上皮细胞分子标志角蛋白18(Cytokeratin,CK18)、角蛋白5(Cytoketin 5,CK5)、MYH 11和培养底物包被的Transwell小室中细胞生长曲线进行检测。
经生物学特性鉴定符合泌乳调控条件的细胞继续培养扩群,取4-8代细胞转移至Transwell培养体系进行泌乳功能调控。具体流程如下:将上室加入1 mL PBS(LN终浓度30μg/mL),置超净台上过夜风干,制成LN包被板待用,同等浓度BSA包被板作为阴性对照组。将在培养瓶(T 25)中处于对数生长期的奶牛乳腺上皮细胞按105个/孔左右接种至上室中,37℃,5%CO2培养,每组设3个复孔,使用含双抗和5%胎牛血清的DMEM-F12接种培养液至细胞50%融合,再次下调胎牛血清浓度为2%培养至细胞85%左右融合,更换为无血清分化培养基(含催乳素1μg/mL,胰岛素5μg/mL,氢化可的松5μg/mL的DMEM-F12培养液)。分化培养24 h后,提取细胞总RNA和总蛋白用于后续qRT-PCR和WB检测。
1.4 流式细胞检测
纯化后的BMECs接种到6孔板培养至90%左右融合,至少收集106个细胞,PBS洗涤1次,1 mL固定透膜剂(BD)4℃放置20 min,PBS洗涤2次。AF488-CK18(Bioss)一抗(含3%BSA的PBS稀释)5μg/106个细胞,4℃避光放置40 min,每隔一段时间轻轻摇匀细胞。对照组不加一抗。PBS洗涤2次,用500μL PBS重悬细胞,上机。
1.5 组织与细胞免疫荧光
冻存乳腺组织制成8μm冰冻切片,乳腺上皮细胞制成细胞爬片。4%多聚甲醛4℃固定10 min,PBS/T漂洗2×5 min。5%BSA 37℃封闭1 h;CK18、CK5一抗均采用AF488直标抗体(Bioss)、MYH11一抗采用FITC直标抗体,均按1∶200稀释,整联蛋白β1一抗采用大鼠单克隆抗体(DSHB),按1∶20稀释,4℃孵育过夜,隔天PBS/T漂洗3×5 min;整联蛋白β1二抗(1∶400)采用AF488-山羊抗大鼠IgG(Bioss)37℃孵育1 h,PBS/T漂洗3×5 min。0.02 mg/mL DAPI37℃染核10 min,PBS/T漂洗3×5 min,抗荧光猝灭剂封片。
1.6 RNA提取与实时荧光定量PCR
使用组织细胞RNA微量提取试剂盒(Magen),从乳腺组织中提取总RNA,NanoDrop 2000检测RNA浓度,OD260nm/OD280nm确定RNA纯度。按照逆转录试剂盒说明,将总RNA反转录成cDNA。qRT-PCR上机采用20 uL体系,反应程序:95℃,30 s预变性。95℃,5 s;60℃,30 s;进行40个的循环。cDNA模板按5-100倍稀释(<100 ng),上下游引物均按0.4μmol/L添加,如表1。

表1 引物序列
1.7 蛋白提取与蛋白印迹
MinuteTM总蛋白提取试剂盒(Invent)提取细胞总蛋白,BCA蛋白浓度测定试剂盒(碧云天)测定蛋白浓度,按每孔20 ug总蛋白上样,8%SDS-PAGE(凝胶快速配制试剂盒,碧云天)电泳,湿转至NC膜。内参β-actin一抗为小鼠单克隆抗体(Bioss),二抗HRP-山羊抗小鼠IgG(中杉金桥)。β-酪蛋白、整联蛋白β1一抗均为兔单克隆抗体(Bioss)、二抗HRP-山羊抗兔IgG(中杉金桥)。使用Sag Capture(天能,Tanon 5200)对蛋白条带进行扫描,使用Imagine Pro-plus6.0软件读取蛋白灰度值。
1.8 统计分析
采用SPSS21.0软件统计分析数据。所有分析数据至少来自3次独立实验,每次实验至少3个平行,用独立样本t检验检验差异显著性,数据结果用平均值(x)±标准差(SD)表示。
2 结果与讨论
2.1 奶牛乳腺上皮细胞的生物学特性
对酶消化法纯化后的乳腺上皮细胞进行免疫荧光鉴定,如图1a在激光共聚焦显微镜下可以观察到位于拉丝状细胞骨架的CK18信号(绿色),DAPI染核可观察到卵圆形的细胞核(蓝色),同时流式细胞仪技术检测结果如图1b显示CK18阳性率达到98.9%。如图1c所示我们对肌上皮细胞的分子标志MYH 11以及体内基底侧乳腺上皮细胞的分子标志CK5也进行了检测,并没有检测到阳性信号的存在。Malven等证实牛乳腺组织产生催乳素,近年来对啮齿类动物的研究表明自分泌催乳素对于泌乳分化有着至关重要的作用[14-15],因此它在牛乳腺中也可能具有自分泌作用。qRT-PCR结果如图2所示,显示BMECs自分泌的PRL mRNA表达水平极低或未检出,添加LN对自分泌PRL基因表达未产生显著影响。BMECs在两种培养底物包被的Transwell小室中的生长速度基本一致,根据细胞生长曲线如图3所示,我们选择在细胞接近80%融合时(3 d)更换分化培养基处理24 h。总之,对纯化后细胞几项生物学特性的检测表明,我们获得了较为均一的奶牛乳腺上皮细胞,未混杂肌上皮细胞和基底侧未分化细胞[16-17],也可以排除或忽略实验体系中微量内源性PRL的干扰[15]。

图1 纯化后BMECs中的细胞分子标志
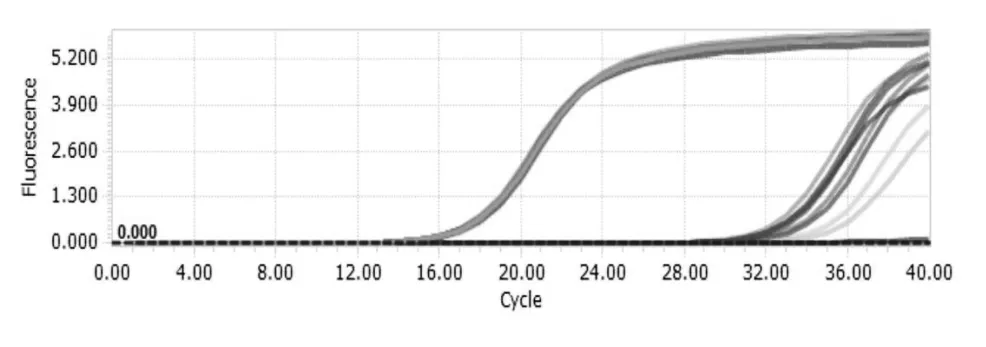
图2 自分泌催乳素qRT-PCR扩增曲线
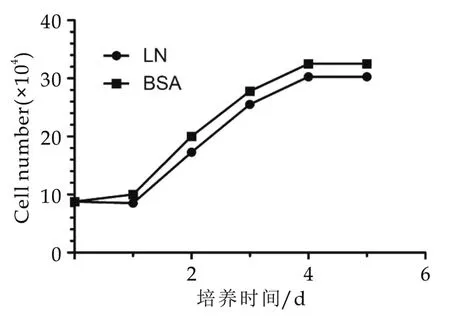
图3 不同培养底物包被Transwell小室中的细胞生长曲线
2.2 整联蛋白β1和α6亚基的表达定位
实验获取3头泌乳奶牛乳腺组织,每头奶牛至少取用3块样本,每块样本至少制取检测3张6~8μm的冰冻切片,泌乳奶牛乳腺的组织结构如图4a和4b所示,乳腺小叶由结缔组织分割而成,每个腺泡是单层腺上皮细胞围绕而成的空泡样结构,每个小叶由几十个至上百个形态和大小不同的腺泡组成,而这种差异是由于腺泡分泌活动不一致决定的。
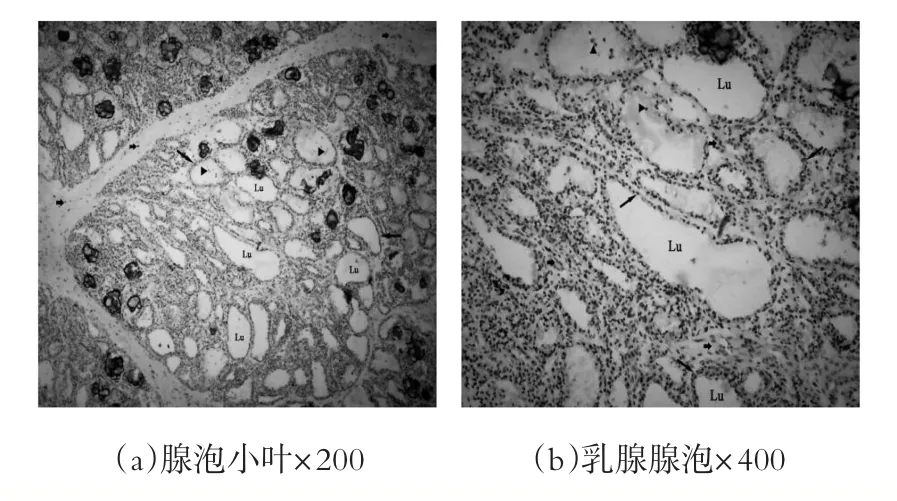
图4 泌乳奶牛乳腺组织结构示意图
整联蛋白表达荧光定位结果如图5a所示,整联蛋白β1主要定位于泌乳腺泡细胞的基底侧细胞,借助蓝色细胞核辅助定位,可以判断出部分位于基底侧细胞信号分布在基底侧细胞膜一侧。相邻腺泡细胞间侧信号较弱,朝向腺泡腔的细胞顶膜信号微弱或无信号。细胞间质区域的梭形成纤维细胞以及其他间质细胞也检测到整联蛋白β1信号,但是不同于基底侧腺泡细胞的极性分布,这些信号环绕整个细胞膜。
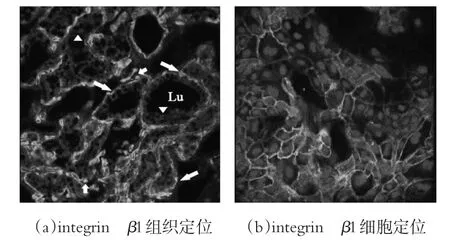
图5 整联蛋白β1的表达定位
同时,我们对分离自不同批次的奶牛乳腺的BMECs进行体外培养,每个处理组的BMECs至少制作3张细胞爬片,来观察β1整联蛋白亚基在体外培养的BMECs中的表达定位,代表性结果如图5b所示,无论是否添加外源LN作为培养底物,β1整联蛋白亚基均有表达,从细胞顶部至基底部沿Z轴进行扫描,同时借助细胞核辅助定位,在接近细胞基底部检测到较强的荧光信号,这与在组织切片观察到的极性分布模式一致。在基底侧表达的定位特点决定了整联蛋白β1能够通过簇集与LN充分结合形成活性构型,并且也是其与其他激素和生长因子受体形成蛋白复合物的前提条件[18-19]。
2.3 LN对BMECs中整联蛋白β1亚基表达的影响
为了证实基膜主要成分LN对于BMECs中整联蛋白β1亚基mRNA和蛋白水平表达丰度的影响,实验中在Transwell上室底部膜上包被LN,人为模拟细胞生长的极性环境,另外在下室添加含HIP催乳复合物的DMEMF12培养液,从基底侧定向刺激细胞对泌乳分化作出应答。培养24 h后,收集细胞,分别提取总RNA和总蛋白,进行qRT-PCR和WB的检测,结果如图6,图7所示:包被LN组与BSA组相比,ITGB1的表达水平无显著差异(P>0.05),整联蛋白β1亚基蛋白水平差异显著(P<0.01)。
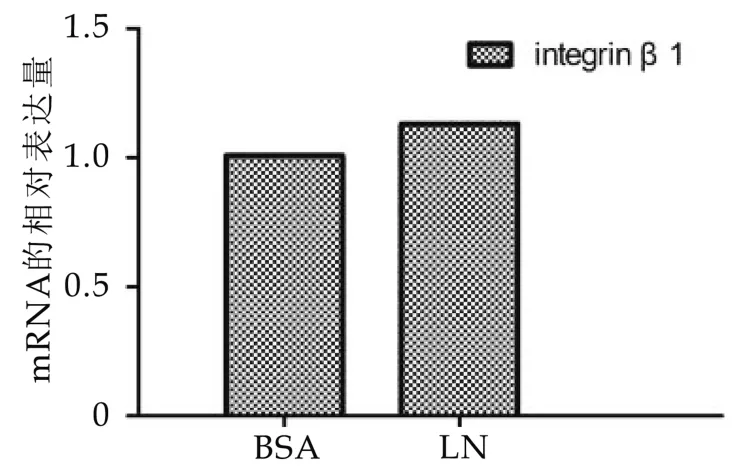
图6 LN对BMECS中整联蛋白β1mRNA水平表达的影响
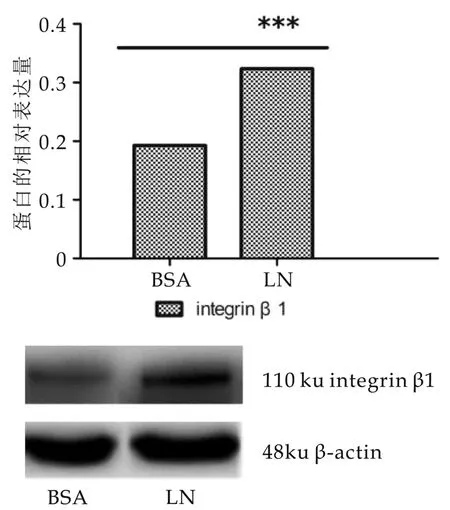
图7 LN对BMECS中整联蛋白β1蛋白水平表达的影响
整联蛋白作为一种膜蛋白能够参与细胞的内吞外排,它的蛋白表达水平由mRNA丰度、蛋白循环速率和降解速率几方面共同决定,我们的实验结果表明添加LN底物未能改变整联蛋白β1的mRNA表达,但可能通过增加整联蛋白循环速率或是抑制其降解实现的[18-19]。
2.4 LN对BMECs中乳蛋白表达的影响

图8 LN对BMECS中乳蛋白mRNA水平表达的影响
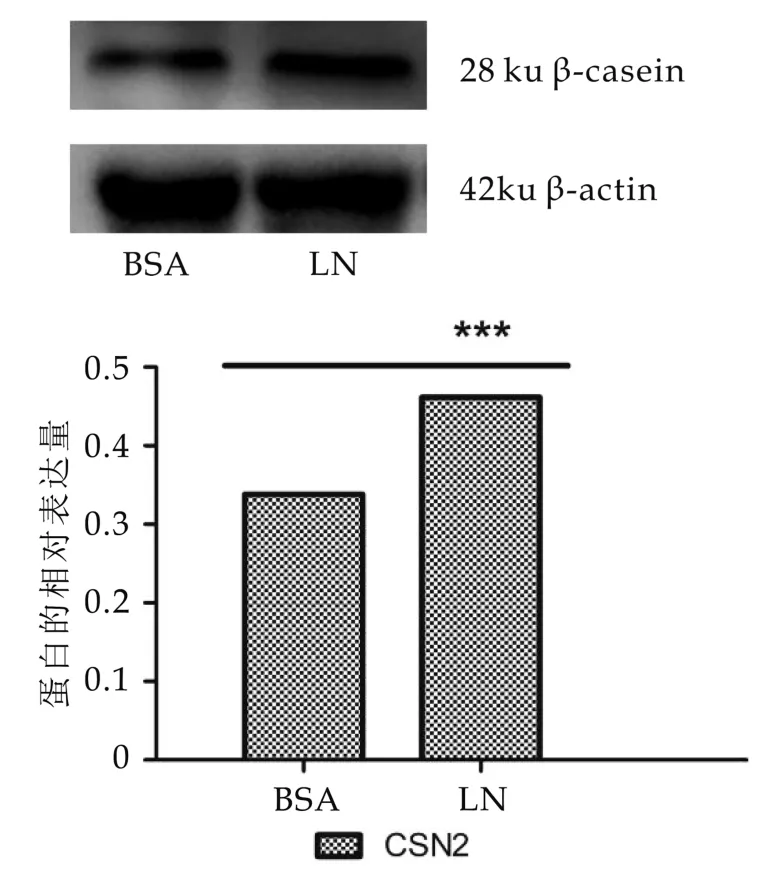
图9 LN对BMECS中β-酪蛋白蛋白水平表达的影响
为了验证LN对于乳蛋白表达的影响,实验中添加催乳复合物对BMECs进行24 h的泌乳分化刺激,允许BMECs有足够的时间在乳蛋白mRNA和蛋白水平上都发生变化。结果如图8、图9所示:包被LN组与BSA组相比,乳铁蛋白mRNA表达水平差异极显著(P<0.01)。包被LN组与BSA组相比,β-酪蛋白在mRNA和蛋白表达水平均差异显著(P<0.01)。包被LN组与BSA组相比,CSN 2的蛋白表达水平差异显著(P<0.01)
LN的存在,显然有利于乳铁蛋白和β-酪蛋白的表达,促进了BMECs的泌乳分化。有许多研究已经证实催乳复合物中的催乳素能够通过结合受体激活下游信号分子Stat5,作为一种转录调节因子,Stat5与β酪蛋白mRNA丰度和蛋白水平密切相关,结合本实验中LN引起的β-酪蛋白上调伴随着β1亚基蛋白的同步上调,以及前言中提到的研究报道β1亚基丰度增强BMECs对催乳素的应答能力[13,20-21],我们推断LN可以通过上调β1亚基丰度来协助催乳素实现促进β-酪蛋白表达的作用。此外,乳铁蛋白是妊娠早期最先表达的乳蛋白,是BMECs处于生乳第一阶段的特征,而在奶牛血液中催乳素的浓度直到生乳第二阶段(妊娠中后期)才逐渐升高,临近分娩时达到高峰,这期间伴随着β-酪蛋白合成与分泌的启动,显然催乳素与奶牛早期泌乳分化关联不大[22],在体外也并没有研究提供直接证据支持催乳素及其受体信号能够增强乳铁蛋白的表达,所以LN可能以一种不依赖于催乳素作用的方式来影响包括乳铁蛋白在内的其他乳蛋白表达[23-25]。
3 结 论
作为一种细胞外基质,LN能影响其细胞表面受体整联蛋白β1亚基的表达水平,进而通过其潜在的信号枢纽作用来增强BMECs对催乳素信号的应答水平,上调相关乳蛋白β-酪蛋白的蛋白合成。LN也具有非催乳素依赖性促泌乳分化作用,诱导或增强包括乳铁蛋白在内的其他不受催乳素信号调控的乳蛋白表达。

