抗金黄色葡萄球菌α-溶血素全人源单链抗体的筛选及初步鉴定①
李 春 吴 桐 秦大莲 于 红 谢 翔 李 雪 袁 青
(西南医科大学药学院药理学系,泸州646000)
金黄色葡萄球菌(Staphylococcus aureus)简称金葡菌,为临床常见病原菌,能产生多种毒素、酶及抗原蛋白,具有较强的致病性,能引起皮肤、呼吸道严重感染及败血症[1]。抗生素是长期以来治疗金黄色葡萄球菌感染的主要有效手段。但在1961年从临床上首次分离出致病性强、传播途径广的耐甲氧西林金黄色葡萄球菌(MRSA)后,随着世界范围内抗生素、消毒剂滥用以及抗生素残留向环境释放的情况越来越严重,其耐药范围日益扩大,耐药程度日益严重,MRSA成为全球院内感染的首要病原菌,也有人将其称为“超级细菌”。 MRSA感染同乙型肝炎、艾滋病(AIDS)并称为世界三大感染性疾病[2]。所谓“最后一线用药”的万古霉素是目前用于治疗MRSA感染的首选药,但也由于抗生素的滥用,最终导致万古霉素中间体金黄色葡萄球菌(VISA)菌株的出现,到2002和2004年出现了高度耐万古霉素的金黄色葡萄球菌(VRSA)。因此,研发新的抗金黄色葡萄球菌的药物或者疫苗迫在眉睫,发现新的有效药物或者疫苗的靶点已经成为了目前国际研发的新热点[3]。
金黄色葡萄球菌分泌的多种毒力因子决定了细菌的致病性,包括α-溶血素(α-HL)、杀白细胞素(PVL)、酚溶性调节蛋白(PSMs)、γ-溶血素等。其中α-HL是一种细胞外毒素,也是主要的毒力因子之一。α-HL的前体由319个氨基酸组成,其前体通过聚集形成了一个相对分子质量为2.32×105的七聚体,然后再通过折叠形成一个β桶状的跨膜区域,此区域为1.4×10-9m,它可以允许分子量小于2 kD的分子通过,如钾离子、钠离子,从而引起靶细胞的坏死[4]。Bubeck等[5]研究表明敲除α-HL基因后,感染金黄色葡萄球菌的肺炎小鼠模型的致死率显著降低。芝加哥大学学者采用杂交瘤技术制备出抗α-溶血素单克隆抗体(MAbs)进行被动免疫实验,结果表明MAbs在体外可预防人类肺泡上皮细胞(A549)受到损伤,并且接受免疫的小鼠在感染金黄色葡萄球菌后死亡率有显著降低[6]。虽然单克隆抗体具有结构均一、纯度高、特异性强、效价高、血清交叉反应少、制备成本低等多种优点,但由于是以小鼠为细胞来源,抗体的鼠源性对人具有较强的免疫原性,可使人体产生人抗鼠抗体,从而会削弱单克隆抗体的治疗作用,甚至导致机体的免疫病理损伤。因此高亲和力、高特异性、毒副作用小的全人源基因工程抗体是当前治疗性抗体研发的趋势所在[7]。本研究成功表达纯化了可溶性的金黄色葡萄球菌α-HL,以纯化的α-HL作为抗原从全人源天然抗体文库中筛选出抗α-HL的全人源单链抗体,为进一步控制MRSA感染奠定基础。
1 材料与方法
1.1实验材料、试剂 Ni-NTA亲和纯化系统和BenchMarkTMpre-stained protein ladder购自Invitrogen公司;辅助噬菌体M13K07、E.coli BL21、E.coli TG1及pCANTAB-5E噬菌体载体和HRP标记的抗M13抗体、HRP标记的抗Flag-tag抗体均购自Gene公司; rTaqDNA聚合酶和低分子量蛋白Marker购自TaKaRa公司;HRP标记的山羊抗小鼠抗体购自Promega公司;Discovery StudioTM购于BIOVIA。
1.2方法
1.2.1α-HL/p-Cold TF融合蛋白的表达纯化 扩增金黄色葡萄球菌α-HL基因,插入p-Cold TF载体,转化感受态细胞E.coli BL21,测序验证序列正确后,将阳性克隆子进行表达。将在LBA液体培养基(LB含100 μg/ml 氨苄青霉素)中过夜培养的1 ml 菌液接种在50 ml新鲜LBA液体培养基,培养至OD600=0.4~0.5,加入终浓度为1 mmol/L的IPTG诱导剂,15℃诱导表达24 h,离心收集细菌沉淀,0.01 mol/L PBS重悬后,超声裂解细菌,离心收集上清,SDS-PAGE电泳鉴定后,采用Invitrogen公司的Ni-NTA亲和纯化系统对表达的可溶性α-HL融合蛋白进行纯化。
1.2.2免疫印迹法检测抗原蛋白的表达 将纯化后α-HL/p-Cold TF融合蛋白进行SDS-PAGE电泳,电泳后转印至PVDF膜上,室温5%脱脂奶粉封闭1 h,加入一抗(抗His-tag抗体1∶5 000) 4℃过夜,1×PBST(1×PBS含0.05% Tween-20)洗膜3次,加二抗(HRP标记的羊抗鼠抗体1∶5 000)室温孵育1 h,1×PBST洗膜3次,加入化学发光剂(Luminata Crescendo Western HRP substrate,USA)显影,凝胶成像系统扫描分析。
1.2.3抗α-HL全人源单链抗体的筛选 本实验前期已成功构建了全人源单链抗体(scFv)文库,文库容量达到2.5×108,多样性好,可用于筛选抗α-HL单链抗体[8]。以生物素化的α-HL融合蛋白为抗原,采用噬菌体展示技术对全人源scFv文库进行4轮富集,随机挑取富集后的文库克隆子进行噬菌体扩增,具体方法参照文献[9]。扩增后的噬菌体抗体采用ELISA进行检测。α-HL纯化蛋白用包被液(0.1 mol/L NaHCO3/Na2CO3溶液,pH9.6) 稀释为20 μg/ml,于酶标板内4℃包被过夜。次日,于37℃用封闭液(1 × PBS 含5% 脱脂奶粉和0.05% Tween-20)封闭酶标孔1 h,1×PBST (1×PBS 含0.05%Tween-20)洗涤后与封闭后的抗体文库噬菌体37℃孵育1 h。洗涤酶标孔后,加入二抗(HRP标记的抗M13抗体)于37℃孵育1 h。最后用TMB显色液显色,于450 nm 处读取吸光值(A) 。
1.2.4scFvs的可溶性表达 将scFvs和pLZ16载体[10]经过NcoⅠ和NotⅠ限制性内切酶双酶切后使用T4连接酶进行过夜连接,转化感受态细胞E.coli DH5α,PCR及测序验证序列正确后进行可溶性表达。将转化成功的菌株在LBAG液体培养基(LB含100 μg/ml氨苄青霉素和2%葡萄糖)中培养至OD600=0.5,加入终浓度为1 mmol/L的IPTG 于32℃诱导表达5 h,离心收集沉淀,加入0.01 mol/L PBS重悬沉淀并进行超声破碎,离心收集上清(为表达粗提液)备用。
1.2.5单链抗体的鉴定 免疫印迹法检测抗体的表达方法同前,将表达粗提液SDS-PAGE电泳后转印至PVDF膜上,封闭后加入HRP标记的抗Flag-tag抗体,最后于凝胶成像系统扫描分析。ELISA鉴定单链抗体性质:包被购自Sigma的α-HL于酶标板中用于检测单链抗体与抗原的结合活性;包被金黄色葡萄球菌和白色葡萄球菌全菌用于检测单链抗体的特异性。一抗为表达的scFvs粗提液,二抗为HRP标记的抗Flag-tag抗体,最后加入TMB显色液显色,于450 nm处读取吸光值(A) 。
2 结果
2.1α-HL融合蛋白的纯化及鉴定 P-Cold TF融合表达载体携带有氨苄青霉素(Ampicillin)抗性基因,所以用Amp作为抗性筛选目的蛋白,并且P-Cold TF融合表达载体携带有多聚组氨酸标签(His-Tag),因此利用Ni-NTA亲和纯化系统中nickel-IMAC resin对His-Tag的结合特性进行纯化。蛋白表达并纯化完成后,经SDS-PAGE电泳检测,结果显示:成功纯化出单一的目的蛋白,其大小为90 kD(图1),其中载体上的TF分子伴侣大小为48 kD,主要用于增加蛋白表达的可溶性。采用免疫蛋白印迹法Western blot鉴定蛋白,证明表达纯化的蛋白即为目的蛋白α-HL(图2)。
2.2抗α-HL全人源单链抗体的筛选 将纯化的α-HL融合蛋白生物素化,并将其作为抗原,采用免疫磁珠法对天然全人源单链抗体文库进行4轮噬菌体展示富集,从富集4轮后的单链抗体文库中随机挑取克隆子,采用phage-ELISA法进行抗原抗体结合鉴定。结果显示:经4轮噬菌体展示筛选后,特异性单链抗体得到富集。随机挑取的1 000余个克隆子进行ELISA初筛,取2个不包被抗原的酶标孔作为阴性对照。结果显示,阴性对照OD450值为0.05左右,部分克隆子与抗原有结合反应,其中OD450>0.8的阳性单链抗体占34%左右,图3为采用ELISA筛选出的部分克隆子。
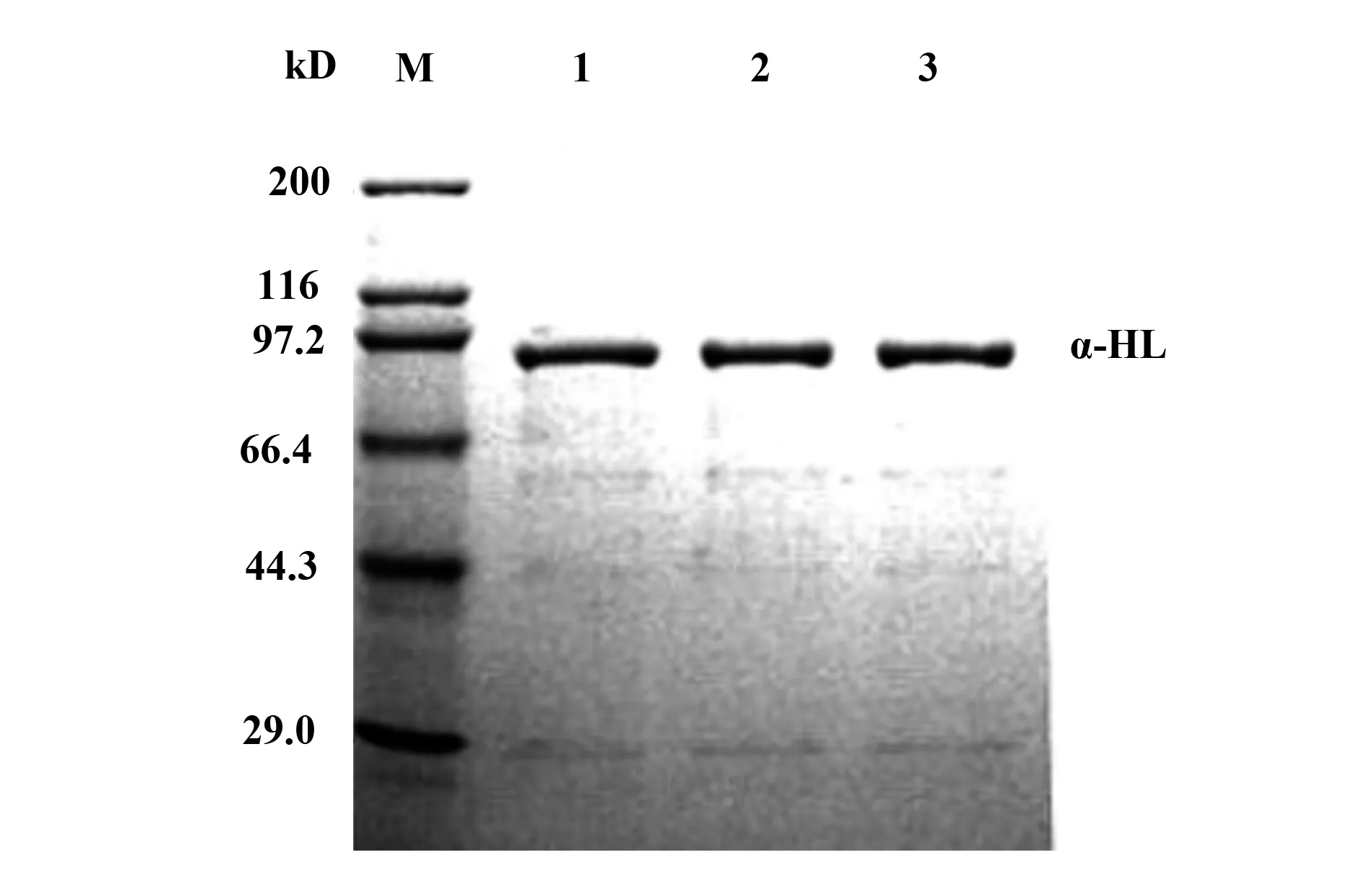
图1 SDS-PAGE电泳分析纯化后的α-HL融合蛋白Fig.1 Analysis of purified α-HL fusion protein by SDS-PAGENote: Marker.Protein molecular weight marker;Lanes 1-3.Expressed protein of α-HL fusion protein.
2.3单链抗体的测序鉴定 将OD450值最高的18株单链抗体进行大量表达后提取质粒测序,测序结果表明:其中15株单链抗体测序序列为开放阅读框,为linker (Ser4Gly)3连接的VH和VL。说明从天然全人源单链抗体文库中成功筛选到抗α-HL全人源单链抗体。Discovery StudioTM展示抗α-HL全人源单链抗体条状结构(图4)。

图2 免疫印迹法验证α-HL融合蛋白Fig.2 Identification of α-HL fusion protein by Western blotNote: Marker.BenchMarkTM Pre-Stained Protein Ladder;Lanes 1-3.Expressed protein of α-HL fusion protein.
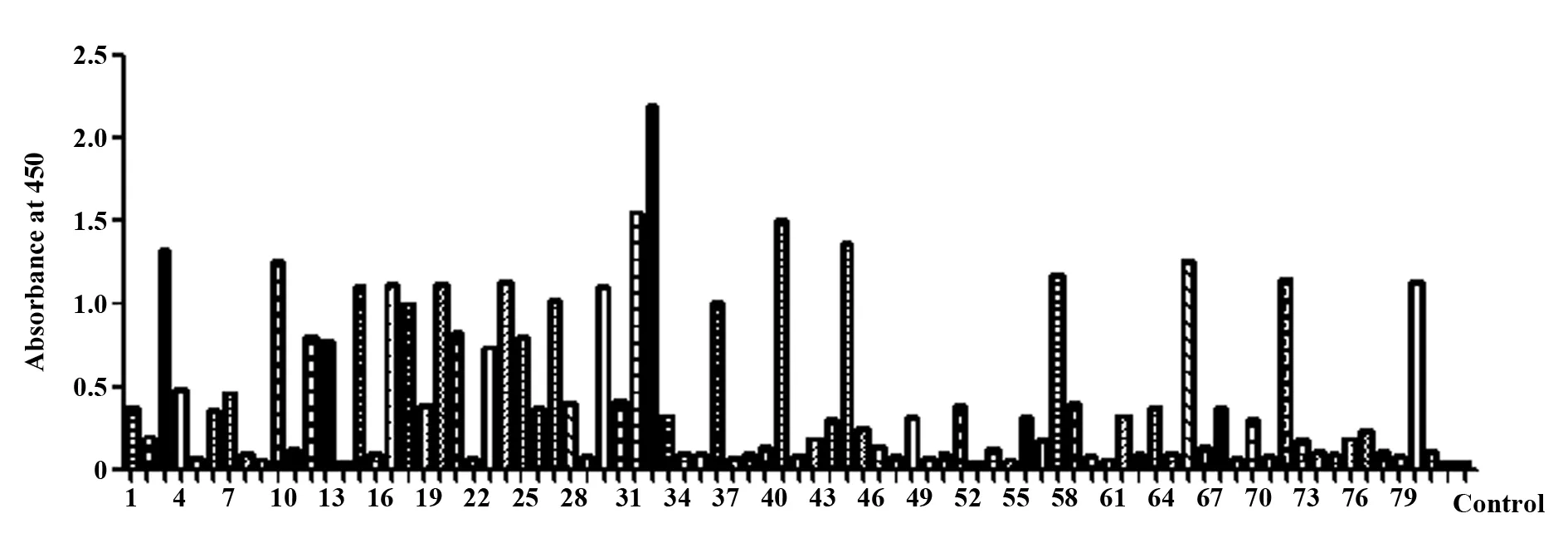
图3 ELISA初筛抗α-HL全人源单链抗体Fig.3 Preliminary selection of scFvs against α-HL by ELISANote: 1-82.Number of different clones.The absorbance (A) reading at 450 nm was taken as the result.The negative control was about OD450=0.05.
图4 抗α-HL全人源单链抗体条状结构图Fig.4 Ribbon diagram of anti-α-HL positive scFv(scFv777)Note: Variable regions(both VH and VL) were shown in yellow.
2.4单链抗体的表达鉴定 噬菌体筛选载体表达蛋白量低,所以本研究将测序成功的单链抗体经双酶切后插入前期构建的pLZ16载体质粒中,PCR验证scFvs插入正确(图5)。抗体经IPTG诱导表达后采用免疫印迹法验证抗体,结果显示:抗体成功表达,目的蛋白分子量大小约为30 kD(图6)。
2.5单链抗体的特异性检测 Phage-ELISA大量筛选阳性单链抗体需大量抗原,所以本研究前期自行制备α-HL DNA,将其插入P-Cold TF载体再转化入E.coli BL21经验证正确后进行表达。由于P-Cold TF载体会融合表达Trigger Factor,所以为了进一步检测筛选出的单链抗体与α-HL的结合特异性,现将购买的α-HL(Sigma,USA)作为抗原包被酶标板,二抗使用HRP标记的抗Flag-tag抗体,ELISA检测结合活性。结果显示,筛选出的克隆子与Sigma的α-HL均具有高结合活性,差异具有统计学意义(P<0.05),表明筛选出的阳性抗体为针对α-HL的单链抗体,即为抗α-HL全人源单链抗体(图7)。
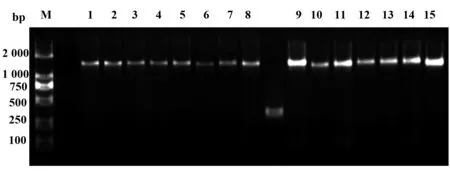
图5 PCR 验证scFvs插入pLZ16载体结果Fig.5 Identification of amplified scFvs from pLZ16 plasmid by PCRNote: M.DNA marker DL2000 (TaKaRa,Japan);Lanes 1-15.scFv2,scFv10,scFv46,scFv214,scFv511,scFv538,scFv555,scFv718,scFv722,scFv759,scFv777,scFv802,scFv845,scFv921,scFv997.Between lane 8 and lane 9 was a negative control hole.

图6 免疫蛋白印迹法检测抗体表达结果Fig.6 Identification of scFvs by Western blotNote: Lanes 1-15.Expressed protein of scFv2,scFv10,scFv46,scFv214,scFv511,scFv538;scFv555,scFv718,scFv722,scFv759,scFv777,scFv802,scFv845,scFv921,scFv997.The size of protein was about 30 kD.
由于葡萄球菌是最常见的化脓性球菌,其感染主要是由金黄色葡萄球菌引起,同菌属的白色葡萄球菌一般不致病。为检测抗α-HL单链抗体的特异性,本研究将金黄色葡萄球菌和白色葡萄球菌全菌作为抗原包被酶标板,抗α-HL全人源单链抗体为一抗,二抗为HRP标记的抗Flag-tag抗体,ELISA结果显示:15株抗α-HL单链抗体与金黄色葡萄球菌均具有高结合活性,差异具有统计学意义(P<0.05);但不与白色葡萄球菌相结合,说明通过富集筛选出的抗α-HL全人源单链抗体具有良好的特异性(图8)。

图7 ELISA鉴定初筛的抗α-HL单链抗体Fig.7 Identification of preliminary screened scFvs against α-HL by ELISANote: The absorbance (A) reading at 450 nm was taken as the result.The negative control was about OD450=0.05.Black horizontal bars indicated standard deviation of each group.***.P<0.001.
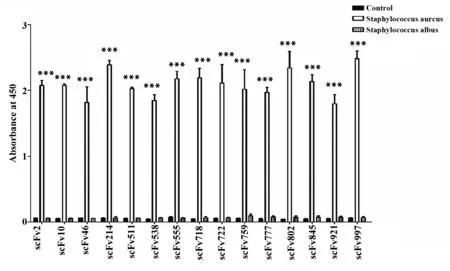
图8 ELISA检测抗α-HL单链抗体的特异性Fig.8 Specificity of anti-α-HL scFvs detected by ELISANote: The absorbance (A) reading at 450 nm was taken as the result.The negative control was about OD450=0.05.Black horizontal bars indicated standard deviation of each group.***.P<0.001.
3 讨论
金黄色葡萄球菌感染特别是耐甲氧西林金黄色葡萄球菌MRSA的感染可造成危及生命的侵袭性感染,如肺炎、皮肤脓肿及菌血症、心内膜炎等。随着全球范围内的抗生素滥用,出现了几乎对所有抗生素耐药的MRSA。近年来,由于抗生素研究的滞后,使得抗金黄色葡萄球菌感染的治疗举步维艰,需迫切寻求新的治疗方式。已有相关资料表明,α-HL缺陷型菌株在动物感染模型中的毒力明显下降[5]。因此,抗金黄色葡萄球菌α-HL抗体药物的开发,作为一个全新的治疗方式,具有极大临床应用潜能。
单克隆抗体药物的发展经历了鼠源性单克隆抗体、嵌合型单克隆抗体、人源化单克隆抗体和人源性单克隆抗体的四个阶段[11]。近几年,经美国食品和药物管理局(FDA)批准应用于临床的抗体药物也多为人源化单克隆抗体[12,13]。采用杂交瘤技术制备的鼠源性抗α-溶血素单克隆抗体已被证实可降低感染金黄色葡萄球菌小鼠的死亡率[6]。本研究创新性地制备全人源单克隆抗体,其具有穿透性强、分子量小、便于操作,且最大程度地降低甚至消除人抗鼠抗体反应(HAMA)的特点,同时保留或增加了天然抗体的主要生物学活性和特异性,去除或减少无关结构。
本研究在天然条件下纯化得到α-HL融合蛋白,并通过SDS-PAGE和Western blot得以验证。Phage-ELISA筛选出的scFvs经测序正确后插入表达量更高的pLZ16载体中进行诱导表达。通过检测表达的抗体蛋白与α-HL的结合活性和对金黄色葡萄球菌的特异性来鉴定单链抗体。实验结果表明本研究成功筛选出了抗金黄色葡萄球菌α-HL全人源单链抗体。
美国基因泰克公司研究人员在Nature上发表了抗体-抗生素偶联药物优于万古霉素治疗菌血症的疗效的研究结果,为治疗MRSA带来新方向[14]。后期本研究将进一步完善抗金黄色葡萄球菌α-HL全人源单链抗体的生物学功能实验,为临床控制耐药金黄色葡萄球菌感染提供依据。