氧化还原方程式的配平方法探究
祝英航 指导教师:赵 杰
(山东省烟台第一中学 264001)
氧化还原是非常重要的化学概念,也是高中化学的重点和难点,经常出现在高考题中.对于刚上高一的学生来说,氧化还原方程式的配平具有较大的挑战性.笔者作为高一化学课代表,化学成绩一直不错,但在运用氧化还原基本理论知识配平氧化还原方程式时出错不少.在分析思考后,笔者发现,常用配平氧化还原方程式的方法并不能普遍应用于所有的习题.在查阅相关文献的基础上,本着“大胆假设、小心求证”的原则,运用逻辑推理和比较分析等方法,笔者针对氧化还原方程式配平过程中的习题,总结电子守恒法和原子守恒法,希望能对广大高中同学的化学学习有所帮助.
一、氧化还原理论知识归纳总结
1.氧化还原反应的定义
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应.在氧化还原反应中,反应物所含某种或某些元素化合价升高的反应叫做氧化反应;反应物所含某种或某些元素化合价降低的反应叫做还原反应.氧化与还原这两个对立的过程相互依存而统一于一个氧化还原反应之中.在氧化还原反应中,所含的某种元素的化合价降低的反应物,称为氧化剂;所含的某种元素的化合价升高的反应物,称为还原剂.
2.氧化还原反应的实质和特征
氧化还原反应从表面来看是反应前后元素的化合价发生了变化,实质上则是反应前后有电子转移或电子偏移发生.在氧化还原反应中,得电子者为氧化剂,氧化剂自身被还原;失电子者为还原剂,还原剂自身被氧化.氧化剂得到的电子数必等于还原剂失去的电子数.
二、氧化还原方程式解题技巧
1.氧化还原方程式配平的常用方法——电子守恒法
电子守恒法就是在氧化还原反应中得失电子守恒,其氧化还原方程式配平的一般步骤包括:
(1)标:标出有化合价变化的元素的化合价;
(2)列:列出反应前后元素化合价的变化值;
(3)等:利用最小公倍数法使氧化数降低总值和升高总值相等;
(4)定:确定氧化剂、还原剂、氧化产物和还原产物的化学计量数;
(5)平:利用观察法配平其他物质,配平后,方程式改为等号;
(6)查:检查原子守恒、电子守恒及电荷守恒(离子反应).
例1 配平:_NaClO3+_H2O2+_H2SO4—_ClO2+_O2+_Na2SO4+_H2O
解析根据电子守恒的原则,先标出反应中氧化数发生变化的元素的化合价,如下:
再列出变化值,利用最小公倍数法使氧化数降低总值和升高总值相等.

配平氧化剂、还原剂、氧化产物、还原产物:
2NaClO3+H2O2+_H2SO4—
2ClO2+O2+_Na2SO4+_H2O
配平氧化数有变化元素的原子数后,再配平其他氧化数没有变化的元素的原子数.根据氢的原子数可知H2O化学计量数为2,Na2SO4和H2SO4化学计量数为1,得:

2ClO2+O2+Na2SO4+2H2O
例2配平:_SO2+_H2S—_S↓+_H2O
解析对于此化学方程式,可以看出只有S化合价改变,根据电子守恒的原则,先标出反应中氧化剂、氧化产物、还原剂、还原产物的价态,如下:
再列出变化值,利用最小公倍数法使氧化数降低总值和升高总值相等.


配平氧化剂、还原剂:
SO2+2H2S—S↓+H2O
根据硫元素可知产物硫的化学计量数为3:
SO2+2H2S—3S↓+H2O
配平氧化数有变化元素的原子数后,再配平其他氧化数没有变化的元素的原子数,根据氢元素可知H2O的化学计量数为2.因此化学方程式为:

例3配平:_MnO4-+_Fe2+—_Mn2++_Fe3+
解析根据电子守恒的原则,先标出反应中氧化数发生变化的元素的化合价,如下:
再列出变化值,利用最小公倍数法使氧化数降低总值和升高总值相等.


配平氧化剂、还原剂、氧化产物、还原产物:
MnO4-+5Fe2+—Mn2++5Fe3+
因为离子方程式需要电荷守恒,观察等式两边的电荷,等式左边电荷数为+9,等式右边电荷数为+17.需要配平电荷,根据高锰酸钾在酸性环境中的氧化性可知在等式左边加8个H+,则有
MnO4-+5Fe2++8H+—Mn2++5Fe3+

2.氧化还原方程式配平的简便方法——原子守恒法
经过对大量习题的观察与规律摸索后,笔者发现,除了电子守恒配平法外,还可以采用方程配平的基本原则——原子守恒,对部分氧化还原方程式进行配平.在氧化还原方程式配平过程中,原子守恒法适用的基本条件为:在化学反应中,若有一种元素的化合价在反应前后未发生变化,且在反应前后均仅存在于一种物质中,则可以利用反应前后的原子守恒进行方程式的配平.现通过以下例题进行说明:
例4配平
_KMnO4+_HCl—_KCl+_MnCl2+_Cl2↑+_H2O


经检验,与电子守恒法配平结果一致.
例5配平:_NH3+_O2—_NO+_H2O
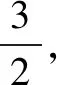

经检验,与电子守恒法配平结果一致.
例6 配平:
_Cu+_HNO3(稀)—_Cu(NO3)2+_NO↑+_H2O
解析通过观察,H在反应前后化合价都没改变,且反应前后均只在一种物质中出现,符合原子守恒的使用条件.假设H2O的系数为1,则HNO3的系数为2.
设Cu(NO3)2和NO的系数为分别为a、b,则化学方程式变换为
aCu+2HNO3(稀)——aCu(NO3)2+bNO+H2O
则根据N和O守恒的原则,列出等式:
2=2a+b
6=6a+b+1
解得a=3/4、b=1/2,配平等式为整数,化学方程式两边乘以4,可得:

3Cu(NHO3)2+2NO↑+4H2O
经检验,跟电子守恒法配平结果一致.
氧化还原方程式的配平考察的是学生对氧化还原知识的综合掌握能力,本文重点介绍了电子守恒法和原子守恒法.对于电子守恒法,应熟练掌握各类氧化剂、还原剂中元素的价态变化,利用标、列、等、定、平、查的六个步骤配平.对于原子守恒法,应注意观察方程中是否有未发生价态变化的元素,必要时可设未知数结合反应前后的原子守恒进行配平.掌握这两种方法,可以解决绝大部分氧化还原方程式的配平,对高中学生而言具有实用性和针对性.
总之,要想提高氧化还原方程式配平的解题正确率,一方面需理解并掌握氧化还原的相关理论知识,抓住电子转移守恒的关键点,创新解题思维;另一方面需通过典型习题的训练,逐步熟悉和合理运用解题技巧,最终才能取得令人满意的成绩.

