Bi2WO6/UiO-66复合材料的制备及其光催化性能
何云鹏 金雪阳 李文卓 杨水金 吕宝兰
(湖北师范大学化学化工学院,污染物分析与资源化技术湖北省重点实验室,黄石 435002)
0 引 言
日益严重的水污染问题是一个世界性的环境问题,挑战着人类的生存和可持续发展。近年来,人们对多种治理环境污染的技术开展了研究,其中利用半导体光催化技术处理污染物的研究受到了科研工作者的广泛关注[1-3]。光催化可快速有效地降解环境中的污染物,并且无二次污染[4-5]。铋系半导体作为一类重要的可见光光催化剂,具有特殊的电子结构、很强的催化性能,因此在光催化领域被广泛研究[6]。
Bi2WO6是近几年受到关注的一种铋系光催化剂,Bi2WO6是由WO6八面体片层和Bi2O2层交替组成的Aurivillius型氧化物,形成的开放式层状空隙结构可当做光催化反应的场所,并且构成晶胞单元的扭曲WO6八面体的偶极矩还有利于光生载流子的分离[7-8]。目前,人们采用水热法制备了Bi2WO6微球和纳米板[9-10]。相较于传统固相法,水热法制备的Bi2WO6具有可控制晶体的尺寸、形貌和分散性的优点,并具有很好的光催化性能。但是单一的Bi2WO6的电子和空穴容易发生复合,限制了它的活性,所以通过改性的方式来改善Bi2WO6的催化性能。目前主要通过2种方式来改性Bi2WO6:一是掺杂单质或离子来改进其光学性质,例如采用N[11]、Fe3+[12]、Er3+[13]等来掺杂;二是通过与其他半导体复合来提高电子和空穴的分离效率,例如采用TiO2[14]、g-C3N4[15]、ZnO[16]等。两种半导体之间可以产生异质结来提高电荷分离效率。金属有机骨架材料(MOFs)是指金属离子或金属簇与有机配体通过配位键形成的无限网络结构。有些MOFs材料表现出半导体的特性,在光照下可被激发产生电子和空穴[17-18]。与其他的光催化剂相比,MOFs具有较大的比表面积和孔隙率,因此MOFs在光催化领域引起越来越多的关注,其中UiO-66属于一种直接半导体[19],由于具有较高的热稳定性和化学稳定性而被广为研究[20-21]。
我们用水热法将Bi2WO6与UiO-66复合,得到的复合光催化剂Bi2WO6/UiO-66对罗丹明B染料具有很强的光降解能力。可见光照射50 min后,RhB的相对浓度降低98.5%。经过5次的循环利用,该复合物的催化活性没有明显降低,表明该催化剂具有较高的稳定性和循环利用价值。实验结果说明Bi2WO6/UiO-66光催化活性增强的原因可能是两者之间形成异质结使电荷转移效率增加[22],光响应范围拓宽,比表面积增大。
1 实验部分
1.1 试剂和仪器
1.1.1 实验试剂
所用试剂主要有:氯化锆(ZrCl4,AR,阿拉丁试剂有限公司),对苯二甲酸(H2DBC,AR,天津市大茂化学试剂厂),N,N-二甲基甲酰胺(DMF,AR,国药集团化学试剂有限公司),冰乙酸(CH3COOH,AR,天津市凯通化学试剂有限公司),五水硝酸铋(Bi(NO3)3·5H2O,AR,国药集团化学试剂有限公司),二水钨酸钠 (Na2WO4·2H2O,AR,国药集团化学试剂有限公司),硝酸(HNO3,GR,开封东大化工有限公司),无水乙醇(C2H5OH,AR,国药集团化学试剂有限公司),甲醇(CH3OH,AR,国药集团化学试剂有限公司)。
1.1.2 表征仪器
所用仪器及工作条件如下:S-3400N型扫描 电子显微镜(日本Hitachi公司);HT7700型透射电子显微镜(日本 Hitachi公司), 电压为 200 kV;D8 ADVANCE X-Ray 衍射仪(德国 Bruker公司),Cu Kα辐射,波长λ=0.154 18 nm,工作电压为40 kV,电流为 30 mA,扫描范围 2θ=5°~70°;5700 型红外拉曼光谱仪(美国 Nicolet公司),KBr压片法;ASAP2020HB型比表面积分析仪(美国麦克公司);ESCALAB 250xi XPS光电子能谱仪 (美国Thermo Fisher公司);UV-2500紫外-可见漫反射 (日本Shimadzu公司);CHI 660E电化学工作站(上海辰华仪器有限公司);LS55荧光光谱(美国Perkin Elmer公司),激发波长为300 nm;Sievers900 TOC有机碳分析仪 (杭州艾品医药科技有限公司);Quantaurus-Tau荧光寿命测试仪(滨松光子学商贸有限公司)。
1.2 催化剂的制备
1.2.1 UiO-66的制备
称 取 0.298 g(1.28 mmol)ZrCl4、0.212 g(1.28 mmol)H2BDC溶于30 mL DMF中,再加入一定量冰乙酸,超声30 min。转移到45 mL反应釜中120℃保持24 h,得到的产物分别用DMF和甲醇洗涤3次,在80℃下真空干燥24 h,得到UiO-66白色晶体,放在干燥器中备用。实验中将ZrCl4和H2BDC的用量固定,改变冰乙酸的用量,使其原料物质的量之比分别为 nZrCl4∶nH2BDC∶nCH3COOH=1∶1∶15、1∶1∶30、1∶1∶45,CH3COOH 分别为 1.1 mL(19.2 mmol)、2.2 mL(38.4 mmol)、3.3 mL(57.6 mmol)。 制得 UiO-66 分别记为 U1、U2、U3。
1.2.2 Bi2WO6/UiO-66的制备
称取 0.155 g(0.469 mmol)的 Na2WO4·2H2O 溶于10 mL水得到A溶液,称取0.455 g(0.938 mmol)的Bi(NO3)3·5H2O 溶于 8 mL 的 0.4 mol·L-1硝酸得到溶液B,将A溶液滴入B溶液中,超声20 min,然后加入一定量已制备的UiO-66,超声30 min后将溶液转移至45 mL反应釜中180℃保持12 h,得到的产物用水和乙醇分别洗涤3次,在60℃下真空干燥5 h。即可得到复合光催化剂Bi2WO6/UiO-66。实验中根据2种中心元素的物质的量之比控制UiO-66的用量:0.25 g(nBi∶nZr=1∶1)、0.125 g(nBi∶nZr=2∶1)、0.062 5 g(nBi∶nZr=4∶1)、0.031 3 g(nBi∶nZr=8∶1), 分别记为 BZ1、BZ2、BZ4、BZ8。
1.3 光催化测试
取50 mL的10 mg·L-1罗丹明B溶液于光反应器中,加入0.02 g催化剂。暗光处理30 min,达到吸附-脱附平衡后,将溶液置于300 W的氙灯光源下光照,每隔10 min取一次样离心后在λ=554 nm处测试上清液吸光度C,计算RhB的相对浓度C/C0[23-24],分析光催化活性。
2 结果与讨论
2.1 SEM和TEM表征
图1为在不同模板剂 (CH3COOH)用量下制备UiO-66的SEM图,图中U3为大小相等、分散均匀的颗粒,说明在 nZrCl4∶nH2BDC∶nCH3COOH=1∶1∶45 的条件下可制备出形貌规则的UiO-66颗粒。图2为Bi2WO6,UiO-66(b)和 BZ2的 TEM图。在图 2a中观察到Bi2WO6是由大量大小不规则且光滑的纳米片组成,图2b显示为具有八面体结构的UiO-66纳米颗粒,其粒径为300~400 nm。对于样品BZ2,在图2c中可看到Bi2WO6纳米片紧贴在UiO-66颗粒表面,说明Bi2WO6已与UiO-66复合。图2d中测得的晶格间距为0.315 nm,对应于正交晶系Bi2WO6的(131)晶面(PDF No.39-0256)。

图 1 U1(a),U2(b)和 U3(c)的 SEM 图Fig.1 SEM images of U1(a),U2(b)and U3(c)

图 2 Bi2WO6(a),UiO-66(b)和 BZ2(c,d)的 TEM 图Fig.2 TEM images of Bi2WO6(a),UiO-66(b)and BZ2(c,d)
2.2 XRD表征
从样品的 XRD 图(图 3)可看出 Bi2WO6、UiO-66与BZ2的结晶度较高。UiO-66的XRD图与文献报道一致[25],说明成功合成了UiO-66。Bi2WO6的特征衍射峰与正交晶系的Bi2WO6(PDF No.39-0256)一致。在BZ2的图中,除了Bi2WO6的特征衍射峰之外,在2θ=7.4°、8.5°、25.8°、30.8°出现的特征衍射峰分别与UiO-66 的(111)、(200)、(442)、(711)晶面一致[26]。Bi2WO6与UiO-66复合后的BZ2图中特征衍射峰强度减弱,可归因于Bi2WO6对UiO-66的衍射峰起到抑制作用[27],而UiO-66影响了Bi2WO6晶体的生长[28]。XRD的结果说明Bi2WO6与UiO-66成功复合。
当然多媒体并不是完美无缺的,它的使用也存在一定的弊端和缺陷,如页面频繁切换容易造成学生视疲劳、知识点被分隔让学生难以对课程内容有系统认识等。因此并不能完全丢弃传统的板书,应用多媒体时结合适当的板书进行归纳和解析,便于学生从总体上把握知识结构,这会比完全依赖多媒体教学有着更好的教学效果[5]。
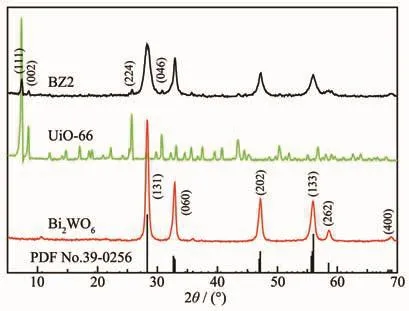
图3 Bi2WO6,UiO-66和BZ2的XRD图Fig.3 XRD patterns of Bi2WO6,UiO-66 and BZ2
2.3 红外表征
图4 为样品的红外光谱图。UiO-66的光谱图中,在1 577和1 398 cm-1处分别为配体对苯二甲酸的O-C-O键不对称和对称伸缩振动;1 506 cm-1的弱峰为苯环中典型的C=C振动;746和667 cm-1处的峰是由于配体对苯二甲酸中O-H键和C-H键的伸缩振动引起;1 159、1 107和1 020 cm-1处的峰是Zr-O键伸缩振动引起的;667和487 cm-1处的峰分别代表UiO-66骨架Zr6O4(OH)4(COO)12单位中μ3-O和μ3-OH键的伸缩振动[26,29]。Bi2WO6的光谱图中822 cm-1处的峰为O-W-O键不对称伸缩振动;726 cm-1处为W-O-W键和Bi-O键伸缩振动峰的重合;576 cm-1处的峰是W-O键伸缩振动引起的[30]。复合物的红外光谱和Bi2WO6的类似,而1 577、1 506、1 159、1 107、1 020 cm-1处的 UiO-66 特征吸收峰也出现在复合物的红外光谱中。

图4 Bi2WO6,UiO-66,BZ2红外光谱图Fig.4 FT-IR spectra of Bi2WO6,UiO-66,BZ2
2.4 样品的织构参数
表1显示,UiO-66表现出高比表面积的微孔结构,Bi2WO6为低比表面积的介孔结构。复合材料BZ2的比表面积比纯Bi2WO6大,这可归因于UiO-66的引入阻止了Bi2WO6纳米片的团聚。结果表明,BZ2具有大的比表面积,可以为光催化反应提供更多的表面活性位点,从而增强光催化活性[31]。
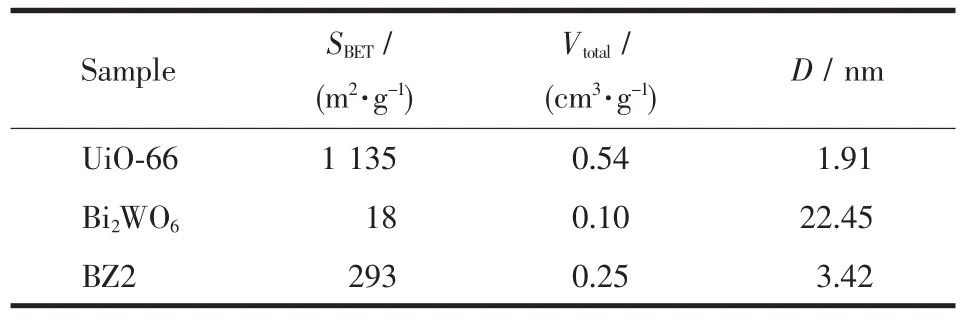
表1 Bi2WO6、UiO-66和BZ2的织构参数Table 1 Texture parameters of Bi2WO6,UiO-66 and BZ2
2.5 XPS表征
通过XPS来分析BZ2样品的化学组成和元素价态。图5a为BZ2的全谱图,表明复合物中存在Zr、Bi、W、C、O 元素, 这些元素与样品化学成分一致;图5b所示为样品Zr3d的XPS图谱,位于182.67和185.06 eV的结合能处的2个峰对应UiO-66中Zr3d5/2和Zr3d3/2,表明样品中存在UiO-66中的Zr6+[27];图5c的Bi元素在Bi4f处分裂成2个峰,峰值为 159.3和 164.6 eV,对应 Bi2WO6中 Bi4f7/2和Bi4f5/2,说明样品中存在Bi3+[32];图5d中35.4和37.6 eV处的峰对应Bi2WO6中的W4f5/2和W4f7/2,说明样品中存在W6+[30];图5e中位于530.2 eV结合能处的峰最强,归因于Bi2WO6中以W-O键和Bi-O键的形式存在的O原子,532.2和531.9 eV处的峰分别对应-OH中的O原子和吸附的H2O中的O原子[33];图5f中在 284.8、286.2、286.8、288.8 eV 处的峰分别对应 UiO-66 中 C=C、C-O、C=O、O-C-O 键[33-35]。
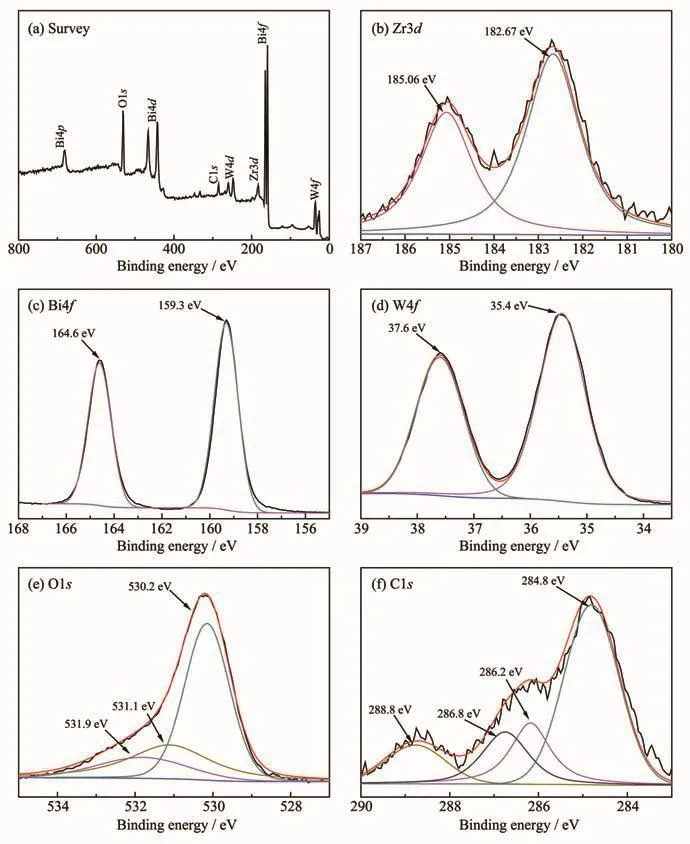
图5 BZ2的XPS图谱Fig.5 XPS spectra of BZ2
2.6 UV-Vis DRS与VB-XPS表征
样品的光学性质用UV-Vis DRS光谱进行表征(图6)。由图6a可知UiO-66在320 nm处具有吸收边,不可以被可见光激发。Bi2WO6在450 nm处出现吸收边,当UiO-66和Bi2WO6复合后,复合物的吸收边明显发生红移,其中BZ2的光吸收范围最大,这是复合物光催化性能增强的原因之一。图6b以(αhν)2对能量(hν)做图得出 Bi2WO6、UiO-66 和 BZ2的带隙图[36],Bi2WO6、UiO-66 的 Eg分别为 2.92、3.87 eV,与文献报道相近[37-38]。而BZ2的Eg为2.61 eV,说明Bi2WO6和UiO-66发生复合。通过图6c的VBXPS测试得出Bi2WO6的导带电位为1.90 eV,UiO-66的HUMO轨道电位为3.15 eV。
2.7 光催化活性
图7a为样品的光催化活性图。在可见光光照50 min后,UiO-66与Bi2WO6复合物的光催化活性明显高于2种纯物质,RhB的相对浓度均下降90%以上,其中BZ2的光催化活性最强。暗光处理30 min时,UiO-66对RhB的吸附量大于Bi2WO6,说明UiO-66可以富集RhB。图中还可看到暗反应30 min前,随着复合材料中UiO-66含量的增加,对RhB的吸附量也逐渐增大,这也是提高降解效率的原因[39]。
为了研究复合材料的稳定性和可重复性,对Bi2WO6和BZ2降解RhB进行循环实验。图7b、7c分别为Bi2WO6和BZ2的5次循环实验,结果表明Bi2WO6的光催化活性下降很快,而BZ2的光催化活性变化很小,说明复合物BZ2相比于纯Bi2WO6具有更好的稳定性与可重复性。

图 6 (a)Bi2WO6,UiO-66,Bi2WO6/UiO-66 的 UV-Vis DRS 光谱图;(b)(αhν)2对光子能量(hν)曲线图;(c)Bi2WO6和UiO-66的VB-XPS图谱Fig.6 (a)UV-Vis DRS spectra of Bi2WO6,UiO-66,Bi2WO6/UiO-66;(b)Plot of(αhν)2 versus the photon energy(hν);VB-XPS spectra of Bi2WO6 and UiO-66(c)
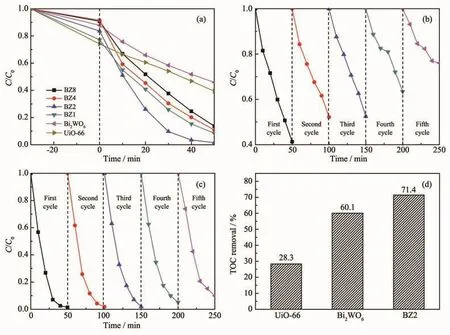
图7 (a)Bi2WO6、UiO-66和BZ2的光催化降解图;(b)Bi2WO6和(c)BZ2光催化降解RhB的循环实验;(d)不同催化剂可见光照射50 min时对RhB的TOC去除率Fig.7 (a)Photocatalytic degradation curves of Bi2WO6,UiO-66 and BZ2;Recyclability of(b)Bi2WO6 and(c)BZ2 in photocatalytic degradation of RhB;(d)TOC removal of RhB in the presence of various catalysts under visible light irradiation for 50 min
2.8 机理研究
2.8.1 电化学测试
在光催化中,电荷的分离与转移是决定光催化活性的关键因素。光电流强度可代表样品的电荷分离效率,强度越大,电子转移越快,光催化性能就越高[40]。由图8a可知,复合物BZ2的光电流强度最强,所以复合物BZ2的光催化效果增强。
电化学阻抗与光催化剂和电解质界面电荷转移的电阻有关[29]。阻抗图中圆弧所对应的圆半径越小,电子转移电阻越低,光诱导电荷转移效率就越高,从而促进电子和空穴的分离[41]。图8b中复合物BZ2的圆弧对应圆的半径最小,电荷转移率最高,使复合物BZ2光催化活性提高。
2.8.2 荧光测试
荧光光谱发射的结果是光生载流子重组的表现。如图9a,在激发波长为300 nm时,Bi2WO6在430~460 nm处出现发射峰,与文献类似[42]。图中BZ2的荧光强度明显低于Bi2WO6,表明BZ2中电子和空穴的复合得到了有效的抑制。
图9b为荧光寿命图谱,平均荧光寿命计算公式为[43]:

其中 A1、A2表示振幅,τ1、τ2表示荧光寿命。通过计算得出Bi2WO6与BZ2的平均寿命分别为12.42、7.49 ns。BZ2较短的荧光寿命说明其光生电子快速转移,从而抑制了电子和空穴的复合,提高光催化活性[44]。
2.8.3 自由基捕获实验
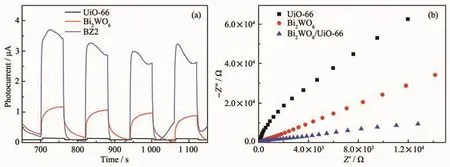
图8 Bi2WO6、UiO-66和BZ2在可见光照射下的光电流响应图 (a)和阻抗图 (b)Fig.8 Photocurrent response curves(a)and EIS(b)of Bi2WO6,UiO-66 and BZ2 under visible light
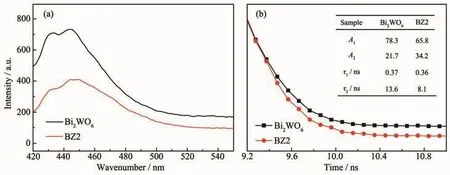
图9 Bi2WO6和BZ2在300 nm激发下的荧光光谱图 (a)和荧光衰减寿命图谱 (b)Fig.9 Photoluminescence spectra under 300 nm excitation(a)and time-resolved fluorescence decays(b)of Bi2WO6 and BZ2
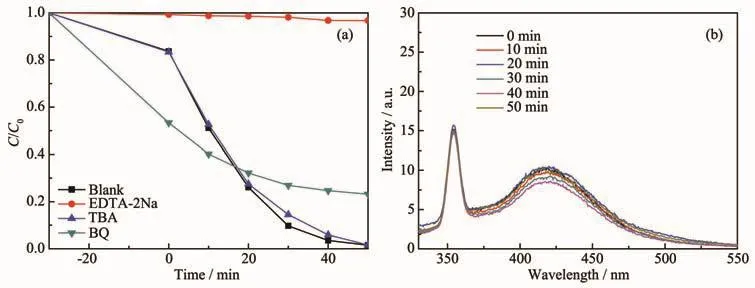
图10 (a)BZ2光催化的自由基捕获实验;(b)BZ2在0.5 mmol·L-1对苯二甲酸-氢氧化钠溶液中随可见光照射时间变化的光致发光光谱Fig.10 (a)Trapping experiment of active species in BZ2;(b)Photoluminescence spectral changes with visible-light irradiation time in the presence of BZ2 in a 0.5 mmol·L-1 terephthalic acid-NaOH solution
通过自由基捕获实验进一步探究了光催化反应的机理,乙二胺四乙酸二钠(EDTA-2Na)、叔丁醇(TBA)和对苯醌(BQ)分别用来捕获空穴(h+)、羟基自由基(·OH)和超氧自由基(·O2-)。由图 10a 可知,在加入EDTA-2Na后,材料几乎没有光催化效果,说明h+在光催化反应中起到主导作用;加入BQ后,光催化效果降低,说明·O2-在光催化反应中起到一定的作用;加入TBA后,样品的光催化效果没有改变,意味着·OH在光催化反应中不是主要的活性物种。以对苯二甲酸为探针分子,采用光致发光技术对催化剂表面产生的·OH进行检测[45-46]。在0.5 mmol·L-1对苯二甲酸的氢氧化钠溶液中,对BZ2光催化0~50 min的溶液进行荧光测试。如图10b所示,对苯二甲酸的荧光强度在425 nm处几乎无变化,进一步证明了光催化过程中·OH不是主要活性物种。
2.8.4 光催化机理
通过图6b得出的带隙Eg以及图6c得出的价带电位,根据公式ECB=EVB-Eg[47]计算得出Bi2WO6的导带电位为-1.02 eV、UiO-66的LUMO轨道电位为-0.72 eV。

图11 Bi2WO6/UiO-66的光催化降解RhB机理图Fig.11 Schematic diagram of the photocatalytic mechanism for degradation of RhB by Bi2WO6/UiO-66
根据以上结果,提出了可能的光催化机理 (图11)。RhB被光激发产生的光生电子e-迁移到UiO-66的LUMO轨道上,它的电位比(-0.13 eV)更负,所以e-可以将氧气还原成·O2-来降解有机污染物。Bi2WO6可以被可见光激发产生光生e-和h+,光生电子从Bi2WO6的CB转移到UiO-66的LUMO轨道,使Bi2WO6的VB上h+增多,从而促进了电荷分离[48]。大量的h+也可以高效地降解有机污染物。光催化降解过程为:

3 结 论
通过水热法将UiO-66与Bi2WO6复合,制备了新型的光催化剂Bi2WO6/UiO-66。该复合材料在可见光下光催化降解罗丹明B时有很强的活性和稳定性。根据样品的表征结果,Bi2WO6与UiO-66发生了复合,且复合物光催化活性增强的原因可能为:(1)电荷转移效率增加;(2)复合物光吸收范围增大;(3)复合物比表面积增大。通过自由基捕获实验发现空穴(h+)是增强光催化活性的主要活性物种,并提出了可能的光催化反应机理。

