紫花苜蓿半胱氨酸合酶基因MsSDCS-0植物GFP荧光表达载体构建与拟南芥转化
赵菲佚,马家琦,安建平,焦成瑾,马伟超
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
紫花苜蓿(Medicago savita)属豆科苜蓿多年生草本植物,素有“牧草之王”和“饲料皇后”的美称。[1]苜蓿有极高的营养价值,[2]是世界上最重要的牧草之一,广泛分布于全世界,对牛、羊等牲畜的生长具有重要的作用。[3]
硫在动物所需的营养中占有重要地位,对促进家畜的生长和发育以及家畜产品的质量和生产具有极其重要的意义。在苜蓿品质指标中,含硫氨基酸含量为重要的指标之一。[4]苜蓿虽富含高量蛋白,但氨基酸组成不平衡,含硫氨基酸[半胱氨酸(Cys)和甲硫氨酸(Met)]含量很低,而Cys和Met是人畜的必需氨基酸,长期食用低硫含量的饲料会引起牛羊的脱毛,降低皮毛质量,蛋奶质量以及影响对其他氨基酸的吸收。因此提高苜蓿含量中含硫氨基酸的含量在牧草生产中具有重要的意义。
半胱氨酸是植物合成的第一个有机硫化物,其合成调控很可能是提高植物含硫氨基酸的关键点,因而,半胱氨酸合成酶(CSase)在植物含硫氨基酸代谢中起着关键的作用。CSase是由多成员组成的小家族。目前,已经从拟南芥、水稻、大豆、截形苜蓿、鹰嘴豆等植物中克隆得到OAS-TL基因,部分基因已成功转入拟南芥等模式植物[5],通过基因工程的手段从紫花苜蓿本身克隆到OAS-TL的基因,然后再将其转入紫花苜蓿,提高OAS-TL的表达量,从而提高体外无机硫转化为体内有机硫的效率,进而增加紫花苜蓿的硫含量。
本研究将紫花苜蓿三得利(Sanditi)半胱氨酸合成酶基因成员MsSDCS-0序列从克隆载体pBSC亚克隆至pCAMBIA1205植物表达载体上,成功构建植物荧光表达载体pCAMBIA1205-GFPn-MsS⁃DCS-0,转入野生型(Col-0)拟南芥原生质体考察半胱氨酸合成酶MsSDCS-0成员亚细胞定位,并同时转化拟南芥整体植物以考察其表达模式。为该基因成员在植物含硫氨基酸代谢中功能与应用后续研究提供基础。
1 材料和方法
1.1 材料
1.1.1植物材料
拟南芥野生型(Col-0)为本实验室保存。
1.1.2实验菌株与载体
大肠杆菌E.coliDH5α与含pBSC-MsSDCS-0克隆载体DH5α菌株、农杆菌GV3101、荧光表达载体pCAMBIA1205-GFPn均为本实验室保存。
1.1.3菌落PCR引物
含阳性植物荧光GFP表达载体的GV3101农杆菌菌落PCR鉴定引物序列如表1,由上海生物工程公司合成。

表1 菌落PCR鉴定用引物序列
1.1 试剂与仪器
1.2.1主要试剂
SanPrep柱式质粒DNA小量抽提试剂盒、San⁃Prep柱式DNA胶回收试剂盒、T4 DNA连接酶试剂盒、Taq DNA聚合酶等购自上海生物工程股份有限责任公司。限制性内切酶Bam HⅠ和SalⅠ等均购自Takara公司。
1.2.2主要仪器
梯度PCR仪(Eppendorf,6321A),凝胶成像系统(UVP,GelDoc-it2),激光共聚焦显微镜(Con⁃focal)(Zeiss,META-510)。
1.3 试验方法
1.3.1MsSDCS-0基因植物表达载体的构建
克隆载体pBSC-MsSDCS-0及植物荧光表达载体pCAMBIA1205-GFPn的工程菌培养与质粒提取按试剂盒产品指导进行。使用Bam HⅠ和SalⅠ对目标质粒进行双酶切,酶切体系建立及酶切反应结果确认均按标准分子操作进行[6]。
1.3.2 pCAMBIA1205-GFPn-MsSDCS-0重组质粒转化GV3101与阳性菌落鉴定
取3μl构建成功的pCAMBIA1205-GFPn-MsS⁃DCS-0重组质粒转化至GV3101感受态细胞中,转化过程使用冻融法进行。转化细胞涂布于含Chl(30mg/L),Rif(50mg/L)和Gent(25mg/L)抗性的LB平板上,28℃倒置培养过夜,挑取单菌落作为模板PCR验证,筛选阳性克隆。PCR反应条件为94℃预变性10min,94℃变性10 s,58.5℃退火30 s,72℃延伸1min,共35个循环,最后72℃延伸7min.使用正向引物为35SF,反向引物MsSDCS-0R进行PCR扩增。扩增产物经0.8%琼脂糖凝胶电泳检测,确认阳性克隆后保存备用。
1.3.3 pCAMBIA1205-GFPn-MsSDCS-0重组质粒拟南芥原生质体瞬时表达
使用生长在短日照条件下,大约3~4周未开花植物,取第2~4对叶片,用锋利的刀片去掉叶片的尖部和尾部,把中间部分切成0.5~1mm的长条。将10~20个叶片的切片溶于装5~10ml的W 5溶液(1.25%celluase R10,0.3%mace-rozyme R10,0.4 Mmannitol,20mM KCl,20mMMES,pH 5.7,10 mM CaCl2,0.1%BSA,0.45μm滤膜过滤,溶液呈透明橙色)烧杯中。用30~75μm(200目)的尼龙膜过滤含有原生质体的W 5溶液置于50m l的离心管中。100 g,lmin离心沉淀原生质体,去上清。在PEG转化前用适量的MMg溶液(0.4 Mmannito,15mMMgCl2,4mMMES,pH 5.7)悬浮原生质体(1-2x105/m l)。
30μg质粒DNA加入200μl原生质体(4x104)放入离心管中,混匀,勿上下颠倒,防止原生质体破碎。加220μl PEG溶液(4 g PEG4000,3m l H2O,2.5 ml 0.8 M mannitol,1 ml 1 M CaCl2),混匀,23℃孵育5~30min.每次处理6个样品,加0.8ml W5溶液,混匀,10 g,lmin,离心去除PEG,先用100μlW 5悬浮原生质体,再加W5至1m l.液体放在24孔板上23℃孵育,24 h后在Confocal下进行荧光亚细胞定位观察。
1.3.4植物GFP荧光表达载体的拟南芥转化
植物转化方法采用农杆菌浸蘸法,[7]拟转化农杆菌GV3101菌株在含Chl(30mg/L),Rif(50mg/L)和Gent(25mg/L)抗性的5ml LB液体培养基中过夜培养,次日转接于200ml与上述小量培养液相同的LB培养基中,当菌液的OD600至0.8~1.0时,5000 rpm常温离心10min收集菌体,菌体沉淀重悬浮于等体积(200ml)MSB培养基(每L含MS 2.2 g、蔗糖50 g、silwet L-77 200μl、6-BA 200μl)中,挑选处于开花期、生长良好的野生型拟南芥Col-0,在含目的载体质粒的GV3103的转化液中转化2min后,用保鲜膜包裹,分别做好标记,水平放置于培养盘中暗中培养24 h,后置于正常生长条件下继续生长。T1代种子分别用于表型观察和荧光观察。
2 结果与分析
2.1 MsSDCS-0基因植物GFP荧光表达载体构建
pBSC-MsSDCS-0及pCAMBIA1205-GFPn质粒经Bam HⅠ和SalⅠ双酶切、胶回收后,使用T4 DNA连接酶将MsSDCS-0片段与pCAMBIA1205-GFPn酶切后载体进行连接,并转化DH5α感受态细胞中。在含Chl抗性的LB平板上筛选阳性克隆。挑取单个阳性克隆菌落于LB/Chl培养基中震荡培养。质粒提取质量如图1A所示,用Bam HⅠ和SalⅠ对所构建重组质粒载体进行双酶切验证,电泳结果如图1 B所示。并将该重组质粒载体被命名为pCAM⁃BIA1205-GFPn-MsSDCS-0.
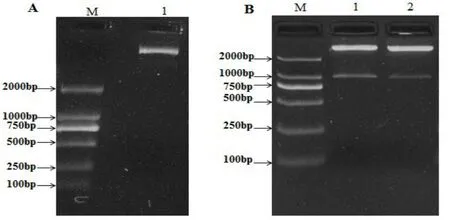
图1 重组质粒pCAMBIA1205-GFPn-MsSDCS-0质粒提取与酶切验证
电泳检测结果显示:重组质粒载体pCAM⁃BIA1205-GFPn-MsSDCS-0经Bam HⅠ和SalⅠ双酶切后可释放出2个片段,其分别为目的基因MsS⁃DCS-0片段及pCAMBIA1205-GFPn载体骨架片段,条带表现清晰,分别为~970bp和~10Kb,且符合预期大小。表明MsSDCS-0已成功构建到植物荧光表达载体pCAMBIA1205-GFPn上,可用于拟南芥原生质体转化及农杆菌GV3101的转化。
2.2 pCAMBIA1205-GFPn-MsSDCS-0农杆菌及拟南芥转化与阳性转化子验证
将重组载体pCAMBIA1205-GFPn-MsSDCS-0使用冻融法转化至GV3101农杆菌。挑取农杆菌转化克隆作为PCR模板,以35SF为正向引物,目的基因特有MsSDCS-0R为反向引物进行菌落PCR,扩增产物经0.8%琼脂糖凝胶电泳检测,结果如图2A所示。为考察目的基因在拟南芥中的表达模式,以农杆菌介导的方式将所构建的植物GFP荧光表达载体转化至拟南芥中,T1代种子在含潮霉素的MS平板上进行筛选,并提取筛选平板上的阳性植株基因组DNA为模板,以与鉴定阳性农杆菌相同的引物进行PCR扩增,扩增结果如图2B所示。
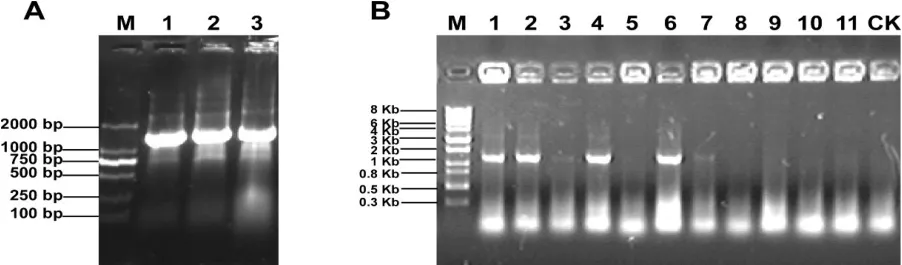
图2 pCAMBIA1205-GFPn-MsSDCS-0转化、GV3101菌落及拟南芥PCR验证
图2A显示不同的转化农杆菌均可扩增出一条大约1600 bp的阳性条带,片段大小约为1000bp,2x35S长度约为600 bp,扩增条带大小与理论预期大小相符,此结果表明植物荧光GFP表达载体转化农杆菌成功,可以用于拟南芥植物的转化过程。
从图2B中可看出,在所选取的11株拟南芥转化株中,4株可扩增出一条处于约1.6 Kb阳性带,而未转化植株无阳性特征条带。扩增出的阳性条带明显,片段大小与农杆菌中的阳性条带相同,考虑其所用引物的特异性,可确认目的基因植物GFP荧光表达载体已成功转化至拟南芥中。
2.3 MsSDCS-0的亚细胞定位观察
为考察目的基因在细胞中的亚细胞定位,将所构建的重组植物GFP荧光表达载体以PEG方法转化至拟南芥野生型(Col-0)原生质体中,表达24 h后在Confocal上进行荧光观察,原生质体中GFP荧光观察如图3所示:
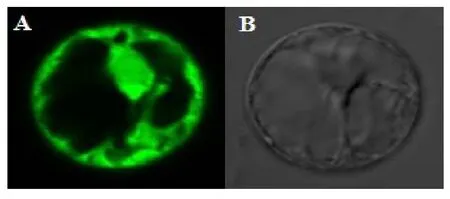
图3 pCAMBIA1205-GFPn-MsSDCS-0转化拟南芥后MsSDCS-0蛋白的荧光亚细胞定位
图3基因荧光图谱显示:在所观察的细胞中,目的基因表达蛋白荧光信号主要出现于胞质中或细胞器中,表明目的基因在细胞中主要定位于胞质或细胞器中。
2.4 重组质粒载体pCAMBIA1205-GFPn-MsS⁃DCS-0转基因拟南芥表型观察
苜蓿半胱氨酸合成酶成员MsSDCS-0主要参与植物体内半胱氨酸的合成,为确认当该基因成员在植物体内过表达后是否会对植物的生长产生影响,本研究中获得MsSDCS-0的拟南芥后,将其T1代种子种植于营养钵中,当生长至3-4周后观察其生长表型是否会发生变化,典型的MsSDCS-0转基因拟南芥生长表型如图4所示:

图4 MsSDCS-0转拟南芥阳性植株表型观察
图4显示,与野生型拟南芥相比,过表达MsS⁃DCS-0的拟南芥在3-4周的生长表型,包括叶的数目、形状及叶色上并未显示出差异。表明当MsS⁃DCS-0在植物体内过表达后不会对植物的正常生长产生有害的影响。
2.5 pCAMBIA1205-GFPn-MsSDCS-0在拟南芥根中的表达模式
基因表达模式预示着基因的功能,为考察Ms⁃SDCS-0在转基因拟南芥中的在体表达模式,将目的基因的植物GFP荧光表达载体转入拟南芥中,使用GFP荧光观察转拟南芥根尖目的基因表达模式,目的基因在转基因拟南芥根尖的GFP荧光Confocal图像如图5所示:与在拟南芥中所观察到的该基因亚细胞定位一样,该基因在转基因拟南芥根尖中的GFP荧光信号主要表达于植物细胞的胞质中,在部分细胞中也可在核中检测到该基因的GFP荧光信号,从上述结果可看出,该基因在体也主要表达于细胞胞质中。
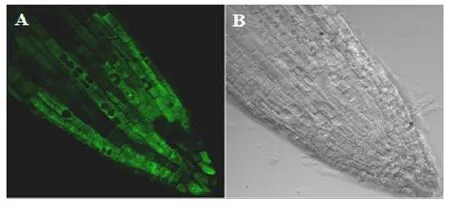
图5 转基因拟南芥根尖目的基因GFP图像
3 讨 论
本研究对含pBSC-MsSDCS-0克隆载体阳性菌株进行复苏纯化并提取质粒,将其与pCAM⁃BIA1205-GFPn载体使用Bam HⅠ和SalⅠ双酶切,纯化后使用T4 DNA连接酶进行连接,最终构建成功GFP融合的目的基因植物表达载体。验证载体正确后使用PEG方法转化入野生型拟南芥(Col-0)原生质体中,荧光观察目的基因的定位。同时将目的基因植物表达载体转入农杆菌GV3101,对野生型拟南芥(Col-0)根尖进行荧光观察,确认该基因的表达模式。此外,对转基因拟南芥的生长表型进行了观察。
本研究结果表明:MsSDCS-0拟南芥原生质体及在体植物根尖中主要定位于细胞质中,并在植物细胞器中也可检测到荧光信号,表明部分该蛋白成员也存在于植物细胞器中。植物CSase家族存在多个同工酶成员,已有研究表明,不同植物其成员组成不同,水稻有9个同工酶,拟南芥有9个,高粱和大豆各6个,毛果杨有10个[7]。在拟南芥中对于Cys合成所需的同工酶和编码基因已经有了比较详细的研究,CSase家族中的9个成员的基因序列已全部测出。[8]通过生化分析已确认,拟南芥中合成半胱氨酸的主要同工酶有OAS-TL A1(细胞质)、OAS-TLB(叶绿体)、和OAS-TLC(线粒体)。其合成的主要场所是叶肉细胞胞质,酶活性可以达到细胞总OAS-TL活性的95%以上。[8-11]本研究结果表明苜蓿半胱氨酸合成酶MsSDCS-0成员主要定位于拟南芥胞质中,此与已有的成果相一致,说明其与拟南芥相应成员序列的高相似性与其功能的一致性。也说明该成员主要在胞质中参与植物半胱氨酸合成的功能。
然而,前期对该成员的体外活性测试显示,该酶是一个双功酶,体外活性测试中表现出了2种活性。其不仅具有半胱氨酸合成酶的活性,也表现出了氰基丙氨酸合成酶的活性,此活性的功能主要用于细胞内对CN-的解毒上,并主要在细胞器如线粒体中进行[12]。本研究中MsSDCS-0不仅定位于胞质中,也存在于细胞器中,猜测其在细胞不同的部位行使不同的功能。然而,该成员在细胞中定位于不同的部位,或其可进行跨膜转输,仍需对此机理做进一步的研究。
在拟南芥中过表达苜蓿半胱氨酸合成酶成员MsSDCS-0未发现植物生长表型异常,表明在提高植物体内Cys合成或其他含硫氨基酸含量时,没有对植物的生长产生影响。猜测在植物体内可能存在其他的调节元件或机制,以对抗该基因的过表达影响,使其生长表型未发生变化。然而,植物细胞内任何的基因过表达均会对其整个代谢网络发生扰动,此种影响可能是本研究未检测的项目。因此,对转基因植物中含硫氨基酸含量的测定及其他的生理指标的测定也是本研究的进一步工作。

