泄浊清瘀汤辅助治疗对痛风急性发作患者血清学指标的影响
刘 丹 邱君畴
(北京市第一中西医结合医院,北京100026)
痛风由嘌呤代谢紊乱、尿酸排泄障碍所致高尿酸血症引起,临床表现多样,包括急性痛风性关节炎、痛风石、尿酸盐肾病,重者致关节残疾、肾功能不全[1-2]。痛风急性发作是指尿酸盐结晶在关节周围形成的急性炎症性疾病,以关节剧烈疼痛肿胀、关节畸形为主要表现。目前西医治疗以非甾体消炎药为主,可在一定程度上缓解临床症状,但部分患者可因药物耐受而疗效下降[3]。中医学认为痛风急性发作者病机为脏腑积热、内伏毒邪、毒巩骨节,研究表明浊清瘀汤治疗急性痛风疗效较好[4]。泄浊清瘀汤具有清热祛湿、泄浊消肿、活血止痛等功效,本次研究将该药方联合美洛昔康用于临床痛风急性发作的临床疗效、血清学指标改变等进行阐述。现报告如下。
1 资料与方法
1.1 病例选择 纳入标准:符合临床痛风诊断标准;急性发作的单个跖趾、跗跖、踝等剧烈疼痛;入院前6个月内无痛风急性发作史;入院前未自主服药治疗;知情同意并签署知情同意书;本观察获医院伦理委员会批准。排除标准:合并全身感染性疾病者;合并局部皮肤溃烂、外伤等其他致痛因素者;妊娠或者哺乳期女性。
1.2 临床资料 选取在本院2017年1月至2018年1月间治疗的68例痛风急性发作患者为研究对象,入组患者按随机数字表法分为观察组与对照组各34例。其中对照组男性20例,女性14例;年龄28~59岁,平均(35.93±9.21)岁;痛风病程 1~12 年,平均(4.95±1.63)年。观察组男性19例,女性15例;年龄27~60岁,平均(35.86±9.07)岁;痛风病程 2~10 年,平均(4.76±1.49)年。两组患者临床资料比较差异无统计学意义(P>0.05)。
1.3 治疗方法 对照组采用痛风急性发作常规治疗,包括休息、低能量低嘌呤饮食,日饮水≥2 000 mL,碱化尿液。同时给予美洛昔康片(江苏飞马药业有限公司,国药准字H20030679,生产批号160203,规格7.5 mg/片)每次1片,每日1次,连续1周。观察组在对照组基础上采用泄浊清瘀汤治疗:络石藤、川牛膝、薏苡仁、萆薢各 30 g,当归、赤芍各 15 g,秦艽、虎杖、苍术、黄柏、白芥子各10 g。加水300 mL煎煮至100 mL,分早晚2次顿服,连续1周。
1.4 观察指标 治疗前、治疗1周后,均抽取两组患者的晨起空腹肘静脉血3 mL,抗凝处理后室温静置分层、离心取上层血清,-80℃冻存。采用发光免疫法测定血尿酸水平。采用酶联免疫吸附法测定血清中炎症因子的含量,包括 IL-37、IL-18、IL-1β。 采用放射免疫法测定血清中疼痛介质的含量,包括前列腺素E2(PGE2)、环氧合酶-2(COX-2)。
1.5 疗效标准 治疗1周后,判断两组患者的疗效。痊愈:疼痛消失、关节功能恢复正常,血尿酸等实验室指标恢复正常,好转:疼痛减轻、关节功能改善,血尿酸下降。无效:临床症状及关节功能、实验室指标水平无明显改变甚至加重。总有效率=(痊愈例数+好转例数)/总例数×100%。
1.6 统计学处理 应用SPSS13.0统计软件。计量资料以(±s)表示,行 t检验;率的比较采用 χ2检验以(%)表示。P<0.05为差异具有统计学意义。
2 结 果
2.1 两组近期疗效比较 见表1。观察组近期疗效总有效率显著高于对照组(P<0.05)。
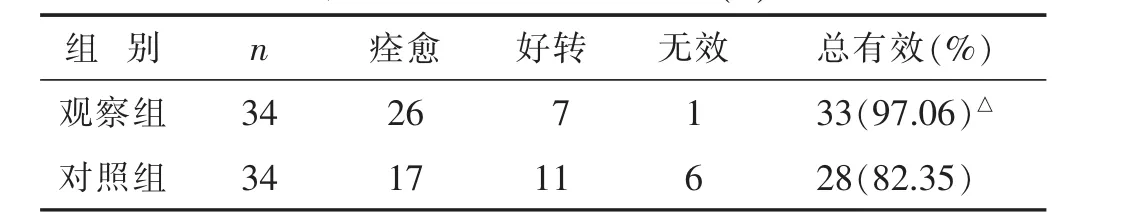
表1 两组近期疗效比较(n)
2.2 两组治疗前后血尿酸水平比较 治疗1周后观察组、对照组血尿酸水平分别为(325.59±46.53)μmol/L、(512.73±64.19) μmol/L,均分别低于治疗前的(850.27±94.61) μmol/L、(842.19±98.63) μmol/L,且观察组低于对照组(P<0.05)。
2.3 两组治疗前后炎症因子水平比较 见表2。两组患者炎症因子IL-1β、IL-37、IL-18的水平均低于治疗前,且观察组低于对照组(P<0.05)。
表2 两组治疗前后血清中炎症因子水平比较(pg/mL,±s)
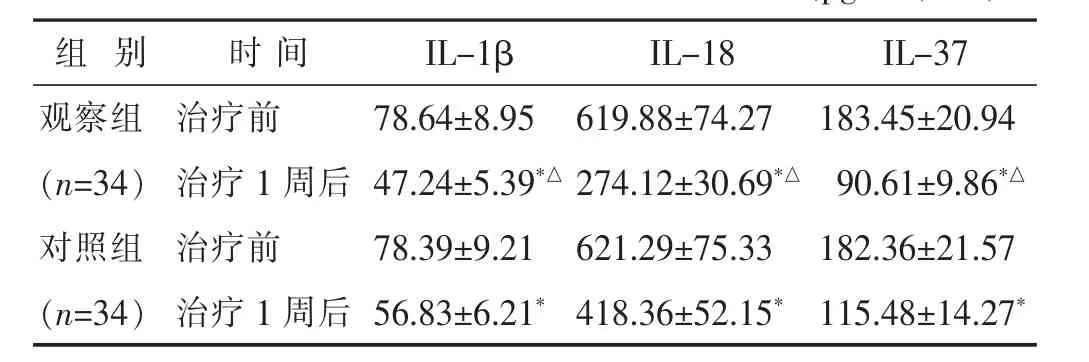
表2 两组治疗前后血清中炎症因子水平比较(pg/mL,±s)
与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同
组 别 时 间 IL-37 IL-1β IL-18观察组 治疗前 183.45±20.94(n=34) 治疗 1 周后 90.61±9.86*△对照组 治疗前 182.36±21.57 78.64±8.95 619.88±74.27 47.24±5.39*△ 274.12±30.69*△78.39±9.21 621.29±75.33(n=34) 治疗 1 周后 115.48±14.27*56.83±6.21*418.36±52.15*
2.4 两组治疗前后疼痛介质含量比较 见表3。两组患者血清中疼痛指标COX-2、PGE2含量均低于治疗前,且观察组低于对照组(P<0.05)。
3 讨 论
痛风急性发作在临床中较为常见,美洛昔康等非甾体类消炎药是其治疗的最常见药物,可不同程度缓解临床症状,但不同患者的起效程度不一,部分不敏感者仍出现病情反复甚至加剧[5-6]。中医学将该病归于“热痹”范畴,由脏腑积热、内伏毒邪、毒巩骨节所致,治疗推荐以活血清热、泄浊止痛为主。泄浊清瘀汤是由络石藤、秦艽、当归、川牛膝、赤芍、虎杖、萆薢、苍术、黄柏、薏苡仁、白芥子等多味中药制成的汤剂,有研究表明,在痛风大鼠模型中该处方能有效缓解痛风炎症表现,目前较多学者推荐将其与西医联合用于临床痛风急性发作患者的治疗。
表3 两组治疗前后血清中疼痛介质含量比较(pg/mL,±s)
组 别 时 间 PGE2 COX-2观察组 治疗前 58.68±7.34 19.35±2.31(n=34) 治疗 1 周后 43.16±5.23*△ 10.05±1.42*△对照组 治疗前 58.92±7.15 19.28±2.17(n=34) 治疗 1周后 49.63±5.21* 14.16±1.75*
泄浊清瘀汤方中络石藤、秦艽具有泄浊止痛之功效,当归活血化瘀,川牛膝通利关节,赤芍、虎杖散瘀止痛,苍术、黄柏清热燥湿;白芥子消肿散结、薏苡仁渗湿除痹[7]。现代药理学则指出,该方具有改善机体血液流变性及微循环、增加缺血器官血流量,调节血脂代谢,防止血管重构等多重作用。本次研究将该药方与常规非甾体消炎药美洛昔康联合用于痛风急性发作患者的治疗,发现观察组的治疗总有效率高于对照组,说明泄浊清瘀汤可有效提升痛风急性发作患者的疗效。两组血尿酸水平治疗后均下降,且观察组治疗后血尿酸水平下降幅度优于对照组,从血清学水平证实泄浊清瘀汤辅助治疗可有效降低血尿酸水平。
痛风急性发作是由痛风性炎症所致,既往研究已经证实多种炎症介质异常表达参与了其发生发展[8]。IL-1β、IL-18是典型的促炎因子,当单钠尿酸盐沉积于关节及其周围组织后,激活NALP3炎性体,进而诱导一系列炎症因子的释放,引起急性关节炎[9-11]。IL-37具有抗炎及免疫抑制作用,目前已经有研究在风湿性关节炎滑膜组织中找到高表达的IL-37[12-13]。上述炎症因子与痛风发生发展具有紧密联系,其循环血含量波动也应与痛风病情基本吻合,故检测其含量可作为评价痛风病情的有效手段。本次研究发现:两组患者治疗后血清中IL-1β、IL-18、IL-37的含量均较治疗前降低,且观察组患者治疗后血清中上述指标含量更低,说明泄浊清瘀汤辅助治疗可更为有效降低患者的全身炎症反应,也证实其可抑制炎症反应。
疼痛是痛风急性发作患者的最主要临床表现之一,部分患者疼痛极为剧烈、给身心造成巨大痛苦[14]。前列腺素作为第三信使参与炎症性疼痛发生,其中PGE2可使局部毛细血管扩张、血管通透性增加,加速组织充血及血浆渗出、促进多种中性蛋白酶产生、导致软骨吸收及骨破坏[15]。PGE2含量与痛风急性发作患者疼痛程度、关节损伤程度高度一致,检测其含量也是判断临床治疗效果的客观指标之一[16]。COX-2是合成PGE2的关键酶,其含量与PGE2呈正相关,当痛风性关节炎急性发作时血清中COX-2含量上升,是开启炎症及疼痛等临床表现的重要起始因子[17-18]。本次研究发现:与治疗前比较,两组患者治疗后血清中PGE2、COX-2的含量降低;进一步与对照组比较,观察组患者治疗后血清中PGE2、COX-2的含量较低,证实泄浊清瘀汤辅助治疗可有效抑制疼痛介质的产生,这也是其缓解患者疼痛等临床症状的直接原因。
综上所述,泄浊清瘀汤辅助治疗可有效降低痛风急性发作患者的血尿酸水平、提升临床疗效,具体作用的发挥与减少疼痛介质产生、抑制全身炎症反应直接相关。

