鼻咽癌中MACC-1 的表达与临床病理特征和预后间的关系
韦妹艳 陈辉 段智 许奇美 汪砥
鼻咽癌(Nasopharyngeal carcinoma,NPC)是最常见的头颈部恶性肿瘤之一,并且我国是世界上鼻咽癌发病率最高的国家[1],据一项流行病学调查研究[2]显示,世界其他国家和地区鼻咽癌的发病率不到1/10万,而我国南方几个省份鼻咽癌的发病率高达30/10 万;据不完全统计世界上大约80%鼻咽癌发生于中国[3]。鼻咽癌的早期症状不典型,可表现为涕中带血、单侧的耳鸣、耳闭塞感、听力下降或头痛等不典型症状[4];正是由于鼻咽部解剖结构的复杂性及临床症状的不典型性,使得鼻咽癌的早期临床诊断比较困难,甚至需要进行反复活检才能够确诊,且确诊时大多已发生颈部淋巴结的转移[5]。而目前公认的鼻咽癌治疗的首选方案为放射治疗[6],尽管近几年放化疗技术不断成熟,但是鼻咽癌治疗后的总生存率仍保持在50%左右,局部复发和远处转移是治疗失败的最终原因[7]。目前关于鼻咽癌局部浸润和转移机制的研究尚不明确,因此,探究与鼻咽癌局部浸润、转移及复发有关的生物学指标显得尤为重要。结肠癌转移相关基因(Metastasis-associated in colon cancer-1,MACC-1)是于2009年对人类结肠癌组织、转移肿瘤组织及人体正常组织进行全面扫描时发现的一个新的基因[8],并且已有研究[9]证实MACC-1基因在结肠癌、肝癌、食管癌中高表达,并与肿瘤的浸润、局部复发及远处转移相关,且其高表达与生存期存在一定关系。本研究采用免疫组化法测定结肠癌转移相关基因(MACC-1)在NPC肿瘤组织中的表达,探讨其与鼻咽癌肿瘤的病理学特征及预后的关系。
1 材料与方法
1.1 一般资料选取我院2006年1月~2012年12月间确诊并放化疗的初治鼻咽癌患者标本90 例及同期送检的慢性炎症鼻咽黏膜组织标本75例,分别为鼻咽癌组和慢性炎症组,所有患者均经病理学检查确诊,并具有完整的住院病历资料。鼻咽癌组中男54 例,女36 例,年龄28~74 岁,平均(52.4±13.8)岁,慢性炎症组中男40例,女35例,年龄27~78岁,平均(53.8±15.4)岁。两组患者在年龄、性别比例等方面比较,差异无统计学意义,具有可比性。
鼻咽癌组患者病理诊断符合《中国常见恶性肿瘤诊治规范》中的关于鼻咽癌的诊断标准[10],且于我院接受放化疗的初治患者,病史资料详细,无严重的心脑血管疾病及其他系统肿瘤病史。患者入院接受治疗前行血常规、尿常规、肝肾功能、鼻咽部MR、头颅及胸部CT、腹部B 超及骨扫描检查,而鼻咽癌的TNM分期采用1992年制定的福州分期标准[11]。鼻咽癌组中患者的病理组织学检查结果:低分化鳞癌84 例,未分化鳞癌5 例,腺癌1 例;TN 分期中T1~T237 例,T3~T453 例,N034 例,N1~N356 例;临床分期Ⅰ~Ⅱ14 例,Ⅲ~Ⅳ76 例;治疗方式:单纯放疗患者21 例,同步放化疗患者69 例;三维调强放疗患者34 例,二维常规放疗患者56 例;鼻咽癌组患者随访采用门诊随访和电话随访,随访频率为放疗后2年内每季度1 次,2~5年内每半年1 次,5年以上每年随访1 次,随访内容主要包括鼻咽部MR、头颅和胸部CT、腹部B超及骨扫描。
1.2 免疫组化S-P 法鼻咽癌组及慢性炎症组标本在取材后首先使用10%中性甲醛固定,随后脱水和石蜡包埋,以厚度为4μm 进行切片,之后进行MACC-1(结肠癌转移相关基因)染色。具体步骤:切片在60℃烤箱内过夜后进行脱蜡水化,随后使用3%的过氧化氢室温孵育,蒸馏水冲洗,PBS 冲洗3次,之后滴山羊血清封闭液,不洗,直接滴加兔抗人MACC-1多克隆抗体,37℃孵育60~90min,PBS漂洗3次,滴加生物素标记的二抗,37℃孵育,PBS漂洗后滴加S-P试剂,37℃孵育,PBS漂洗后,DAB显色,苏木素复染,封片,镜检。结果判定:采用半定量法对MACC-1的染色结果进行判定:①染色强度的计分:0 分为不染色,1 分为浅黄色,2 分为黄色,3 分为棕黄色;②染色细胞评分:取10个高倍镜视野(×400),每个高倍镜视野中随机选择100 个细胞,总计1000个细胞,计算染色细胞的比例,0分为染色细胞比例<5%,1 分为5%~25%,2 分为25%~50%,3 分为50%~75%,4 分为>75%;免疫组化评分=染色强度计分×染色细胞评分,0 分为(-),1~3 分为(+),4~6分为(++),>6 分为(+++),(-)为阴性,(+)、(++)、(+++)为阳性。
1.3 统计学方法使用Excel 建立数据库,将数据库导入SPSS 13.0软件进行统计学分析,计量资料使用均数±标准差(±s)表示,计数资料使用频数表示,计量资料比较采用t检验,率的比较采用χ2检验,有序等级资料采用秩和检验,单因素生存分析采用K-M检验,多因素生存分析采用COX多因素分析,P<0.05为差异具有统计学意义。
2 结果
2.1 MACC-1 的表达情况鼻咽癌组与慢性炎症组患者MACC-1免疫组化评分分别为(6.25±1.43)分、(2.13±0.67)分,差异有统计学意义(P<0.05);鼻咽癌组与慢性炎症组患者MACC-1的阳性表达率分别为70.0%、45.3%,鼻咽癌组MACC-1的阳性率显著高于慢性炎症组,经有序资料秩和检验结果显示,两组间比较差异具有统计学意义(P<0.05)。见表1。
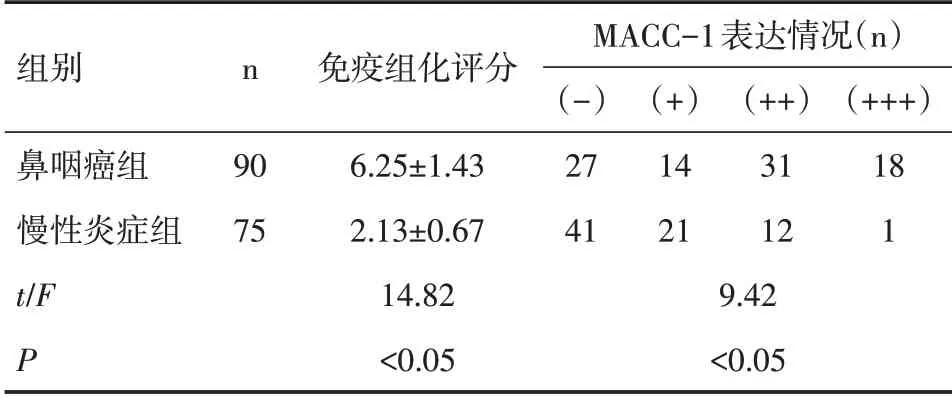
表1 两组MACC-1的表达情况
2.2 MACC-1 的表达与临床特征及病理特征关系将MACC-1 的表达情况与临床及病理组织学特征间关系进行统计学分析显示,鼻咽癌组中MACC-1的表达与年龄没有相关性,在不同年龄间表达的阳性率差异不具有统计学意义(P>0.05);MACC-1 的表达与性别无相关性,不同性别之间MACC-1表达阳性率的差异不具有统计学意义(P>0.05);MACC-1的表达与T分期、N分期及临床分期有相关性,T3~T4期患者的MACC-1表达的阳性率高于T1~T2期患者,差异具有统计学意义(P<0.05);N1~3期患者MACC-1表达的阳性率高于N0期患者,差异具有统计学意义(P<0.05);临床分期中Ⅲ~Ⅳ期患者MACC-1阳性率显著高于Ⅰ~Ⅱ期患者,差异具有统计学意义(P<0.05)。见表2。
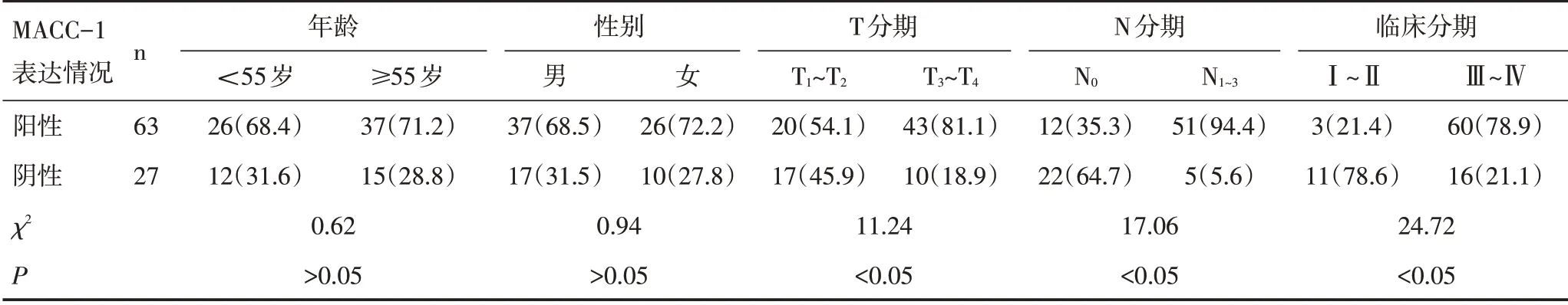
表2 MACC-1与鼻咽癌临床及病理特征关系[n(%)]
2.3 MACC-1 表达情况与患者预后的关系入选鼻咽癌患者随访由首次放疗结束时开始,至2016年6月随访结束,随访时间43~107 个月,平均(72.3±12.7)个月,失访1 例。截至随访结束时,总计有15例患者复发,复发部位7例为鼻咽部,5例为颅底复发,3 例为淋巴结复发;37 例患者死亡,均为鼻咽癌的复发或远处转移;随访结束时,MACC-1表达阳性患者的总生存率为50.8%,MACC-1 表达阴性患者的总生存率为77.8%,经Log-Rank 检验显示,MACC-1表达阳性患者生存率低于MACC-1表达阴性患者,差异具有统计学意义(χ2=8.094,P<0.05)。生存曲线见图1。
3 讨论
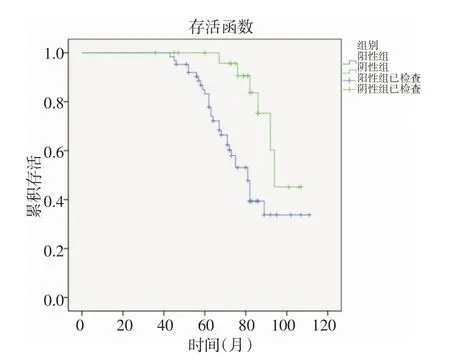
图1 生存曲线
我国是全世界范围内鼻咽癌发病率最高的国家之一,据不完全统计我国南方省份中鼻咽癌的患者占到世界范围内的80%左右,同时鼻咽癌作为耳鼻喉科最常见的恶性肿瘤,选择合理的治疗方式一直是临床中需要解决的问题。由于鼻咽部隐窝解剖位置隐蔽、鼻咽部周围重要的血管神经、丰富的淋巴结构等原因,不仅给手术治疗鼻咽癌带来了困难,同时导致鼻咽癌极易发生远处转移[12];鼻咽癌早期的临床表现不具有特异性,鼻咽癌患者确诊时大多已到达中晚期甚至发生远处转移,为有效的治疗带来了困难[13]。鼻咽癌最为常见的病理组织学类型为低分化型鳞癌,其对放疗较为敏感[14],且目前放疗已经成为治疗鼻咽癌常规同时也是较为有效的方式,随着三维放疗、调强放疗等放疗方式的不断进步成熟,鼻咽癌的治疗也逐渐规范[15],然而目前鼻咽癌患者的病死率仍较高。鼻咽癌放射治疗失败的主要原因为局部复发和远处转移。MACC-1基因最早是于人类结肠癌肿瘤组织、转移瘤及正常组织的扫描中所发现的新基因,后来发现其不仅在结肠癌组织中常见,而且参与包括食管癌、肝癌、肾癌等多种肿瘤的发生发展过程[16]。有研究[17]显示,MACC-1在结肠癌肿瘤组织中表达水平最高,提示其与结肠癌的发生发展相关,同时可以此为靶点作为靶向治疗的突破。此外有报道[18]显示,MACC-1在肝癌、食管癌中的表达显著高于其他人体正常组织中的表达水平,其与肿瘤的淋巴结转移及高TNM分期密切相关,同时有研究[19]证实,MACC-1高表达的食管癌患者的5年生存率明显低于MACC-1 低表达的患者,且将食管癌中MACC-1表达情况作为提示患者预后的指标。一项有关鼻咽癌的研究[20]显示,MACC-1 高表达通过促进Akt(Serr473)和β-catenin的表达来促进肿瘤细胞的增殖、侵袭和转移,提示高表达MACC-1预示鼻咽癌患者的不良预后,可考虑将靶向MACC-1 作为治疗鼻咽癌的新的治疗方向。但目前对于MACC-1 与信号转导之间关系的研究较少,对MACC-1的信号转导及调控途径的研究有利于以MACC 作为靶点的基因治疗。本研究中,通过免疫组化S-P 法对比鼻咽癌组和慢性炎症组中MACC-1的表达情况发现,鼻咽癌组的MACC-1显著高于慢性炎症组,与文献报道相符;同时对鼻咽癌患者TN 分期、临床分期的MACC-1 的表达分析发现,高表达的MACC-1与高TN 分期、高临床分期显著相关,且MACC-1阳性患者的总生存率要显著低于阴性患者,此与其他肿瘤中关于MACC-1的生存研究相符合。
综上所述,鼻咽癌组织中MACC-1 的表达情况可作为判定鼻咽癌患者预后的一个独立指标,且积极研究MACC-1 基因的信号转导及调控方式有助于发现新的鼻咽癌的靶向治疗方式。

