南京地区女性高危型HPV亚型分布特征及与宫颈病变的临床分析
张美娟,成祥君,邱胜丰,2△
(1.南京医科大学第一附属医院检验学部,江苏南京 210029;2.江苏省妇幼保健院检验科,江苏南京 210036)
宫颈癌是常见的妇科恶性肿瘤之一,近年来呈明显上升和年轻化趋势[1]。宫颈癌前病变的发生、发展与高危型人乳头瘤病毒(HR-HPV)的持续感染密切相关[2]。HPV是女性通过性传播感染的最常见病毒。至今已发现的HPV亚型有150多种,其中HR-HPV包括16、18、52、58型等,不同HPV型别所致疾病存在差异。
目前,我国宫颈癌筛查仍以细胞学检查为主,但在宫颈疾病诊治中HPV感染检测及分型检测的应用也逐渐得到推广[3]。为探讨HR-HPV亚型检测诊断宫颈病变的价值及南京地区女性患者HR-HPV的分布,本研究对2017年在江苏省妇幼保健院就诊患者的HR-HPV亚型分布进行了分析,并与细胞学结果进行了比较,以便优化诊疗路径。
1 资料与方法
1.1一般资料 收集2017年1月1日至12月31日在江苏省妇幼保健院妇科因各类原因就诊、经知情同意自愿接受宫颈HPV分型检查的3 598例女性患者的病例资料,年龄16~86岁,平均(39.73±9.39)岁,中位年龄40岁。部分患者疑似存在宫颈病变,其中831例同时进行了宫颈细胞学及阴道镜组织学病理检查。纳入标准:(1)既往有性生活史;(2)3个月内未使用性激素;(3)非妊娠期;(4)非月经期;(4)无严重自身免疫性疾病。
1.2仪器与试剂 采用罗氏Cobas 4800 HPV检测系统[包括Cobas x480 DNA提取仪,实时荧光定量Cobas z480聚合酶链反应(PCR)仪及循环数(Ct)值自动读取软件平台]进行检测,Cobas HPV检测试剂盒购自美国罗氏公司。
1.3方法
1.3.1用干净棉球擦净宫颈口分泌物,然后用专用毛刷前半部于宫颈管内1.0~1.5 cm适当加压,顺时针旋转5圈左右,收集宫颈管内及外口的脱落上皮细胞,置于保存液中,用漩涡法洗脱刷头上细胞,标明信息后送分子实验室。Cobas HPV检测试剂盒可同时检测14种HR-HPV,包括16、18和其他12种HR-HPV(31、33、35、39、45、51、52、56、58、59、66、68b)。按试剂盒说明书的要求,提取HPV DNA,并将已自动加样的PCR板移至Cobas z480 PCR仪中进行PCR扩增和荧光检测。读取Ct值并报告检测结果。以β-globin保守基因作为内部质控,每次实验中均设置阴性和阳性质控。
1.3.2细胞学检查与宫颈组织活检 细胞学检查采用液基细胞学检查(TCT)。分类诊断结果为:(1)未见宫颈上皮病变或恶性改变(NILM);(2)未明确诊断的非典型鳞状上皮细胞(ASCUS);(3)非典型鳞状上皮细胞不除外高级别鳞状上皮内病变(ASC-H);(4)低级别宫颈鳞状上皮内病变(LSIL);(5)高级别宫颈鳞状上皮内病变(HSIL);(6)宫颈癌(包括鳞状细胞癌、腺癌)。ASCUS及以上病变判定为细胞学检查阳性。经细胞学诊断为ASCUS及以上或HR-HPV阳性者经阴道镜评估后取宫颈活组织进行病理检查。宫颈组织病理活检结果报告方式为:(1)良性病变、慢性炎症;(2)宫颈上皮内瘤变(CIN)Ⅰ;(3)CINⅡ;(4)CINⅢ;(5)鳞状细胞癌;(6)腺癌。
1.4统计学处理 采用SPSS19.0统计软件对数据进行分析,计数资料以率(%)表示,采用χ2检验。检验标准:α=0.05,以P<0.05为差异有统计学意义。2 结 果
2.1HR-HPV整体感染情况 3 598例标本中HR-HPV阳性1 404例,阳性率为39.02%。根据美国中期指南确定的筛查年龄已由30岁提前至25岁[4],因此,本研究将25岁作为划分界限。HR-HPV感染人群主要集中于25~<55岁(89.58%)。随着年龄的增长,HR-HPV阳性率逐渐增高。阳性率最高者是65岁以上人群,阳性率为58.06%,其次为55~<65岁年龄段,阳性率为46.52%。35~<45岁患者HPV阳性率为40.98%;25~<35岁患者HR-HPV阳性率为35.00%。各年龄组患者HR-HPV阳性率比较,差异有统计学意义(χ2=20.364,P=0.001)。见表1。
2.2HR-HPV混合感染及不同亚型分布情况 1 404例阳性患者中以单一亚型感染者最多,1 247例(88.82%);双重感染者154例(10.97%);三重感染者仅检出3例。单一感染中以其他12种HR-HPV最多,991例(79.47%);HPV16阳性211例(16.92%);HPV18阳性45例(占3.61%)。双重感染以HPV16与其他12种HR-HPV混合感染较多见,102例(66.23%);其次是HPV18与其他12种HR-HPV的混合感染,50例(32.47%);HPV16和HPV18的双重感染仅检出2例。为分析不同HR-HPV亚型的感染情况,将多重感染病例中不同亚型进行分别计算,HPV16阳性318例(20.33%),HPV18阳性99例(6.33%),其他12种HR-HPV阳性1 147例(73.34%)。

表1 HR-HPV整体感染及年龄分布情况
注:各年龄组HPV阳性率比较,χ2=20.364,*P=0.001
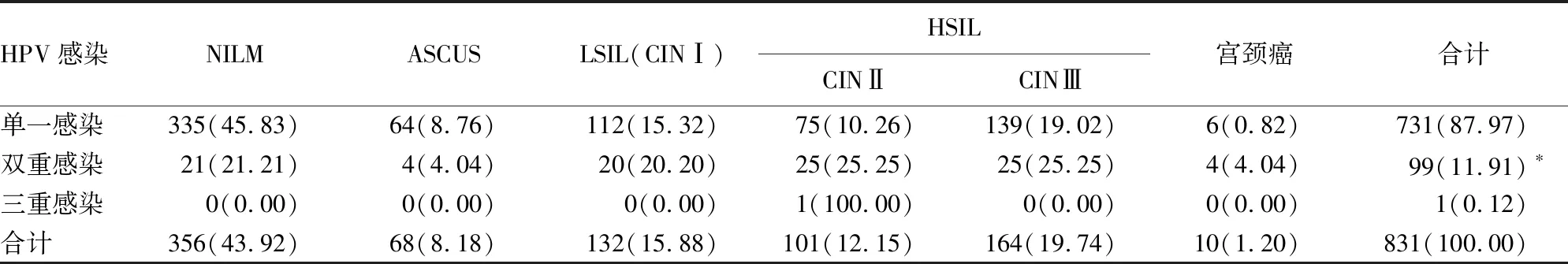
表2 HPV多重感染与宫颈病变的关系[n(%)]
注:与单一感染比较,χ2=35.846,*P=0.000
2.3831例同时进行了宫颈细胞学及阴道镜组织学病理检查患者宫颈病变分析 在不同程度的宫颈病变中,均以单一亚型感染为主(87.97%)。单一感染者中发生HSIL及以上宫颈病变率为30.10%(220/731);而双重感染者发生HSIL及以上宫颈病变率为54.55%(54/99)。相较于单一感染,双重感染发生宫颈病变级别明显升高,差异有统计学意义(χ2=35.846,P=0.000)。三重感染因患者数较少,故未进行统计学分析。见表2。为分析不同HPV亚型与宫颈病变的关系,对831例有病理诊断患者中的多重感染病例分别进行计算。HPV16阳性患者宫颈病变率最高,达22.34%,且病理诊断主要是HSIL(CINⅡ~Ⅲ)者,占53.88%(111/206);HPV18阳性患者宫颈病变率为7.38%,病理学检查结果为HSIL(CINⅡ~Ⅲ)者仅占29.41%(20/68),而LSIL(CINⅠ)较多,达23.53%;其他12种HR-HPV阳性患者宫颈病变率为70.28%,病理诊断为HSIL(CINⅡ~Ⅲ)者占28.70%(186/648)。三组患者宫颈病变情况比较,差异有统计学意义(χ2=16.721,P=0.000)。因本研究纳入的宫颈癌患者数较少,故HPV16和18阳性率分别为2.43%和4.41%,其他12种HR-HPV阳性率更低,仅有0.93%。见表3。

表3 不同HPV感染亚型与宫颈病变的关系
注:3种HPV型别宫颈病变情况比较,χ2=16.721,*P=0.000
3 讨 论
宫颈癌发病率居全球妇科恶性肿瘤第2位,流行病学及基础医学研究已证实,HR-HPV的持续感染是CIN和宫颈癌的主要病因[5]。所以,对HR-HPV的早期分型检测能及时发现宫颈病变并进行早期治疗,以降低宫颈癌发病率,起到早发现、早诊断、早治疗的作用。目前,很多国家和地区均将HPV的基因分型检测纳入到宫颈癌前筛查计划中[6]。
我国HPV的阳性率因地区和研究人群不同而存在明显差异[7]。本研究结果显示,本院妇科门诊就诊人群HR-HPV阳性率为39.02%,与王珑等[8]在赣南地区进行的研究结果类似,但明显高于夏艳等[9]在上海地区进行的研究结果(23.66%)。究其原因,除地域、人群差异外,与使用的检测方法不同亦有关。本研究结果显示,随年龄的增长,HR-HPV阳性率逐渐增高,阳性率最高的是65岁以上人群,与林亚珍等[10]在漳州地区进行的研究结果类似。考虑到本研究中65岁以上人群的样本量较少,今后应更多关注老年女性HPV感染情况。值得注意的是在25岁以下的年轻女性中HPV阳性率也高达35.03%,可能与年轻女性宫颈上皮修复功能尚未成熟有关,过早的性生活、多个性伴侣等因素易增加感染的风险。因此,有必要扩大对年轻女性HPV基因分型检测的普查范围。尽管年轻女性感染HR-HPV后绝大部分可自然清除,但持续感染仍可能罹患宫颈癌,因此,青春期女性可考虑尽早接种HPV疫苗[11]。
由于不同亚型HPV其编码外壳的基因变异很大,不同HPV亚型之间基本无交叉保护性抗体,易造成不同HR-HPV的多重感染[12]。有学者认为,HPV多重感染出现持续感染的危险性更大,易导致宫颈病变。但也有文献报道多重HPV亚型感染与宫颈病变进展无关,可能与研究纳入的样本人群不同有关[10]。本研究结果显示,HR-HPV感染者中以单一亚型感染为主,占87.97%,与大多文献报道结果一致[13]。但双重感染者发生HSIL及以上宫颈病变显著多于单一感染者(分别为54.55%、30.10%),可能与在单一感染状态下自身免疫系统更易清除病毒有关。
不同亚型HPV感染对宫颈细胞恶变的发生、发展具有显著差异[14]。本研究结果显示,其他12种HR-HPV感染者宫颈病变率最高,占70.28%,其次为HPV16阳性者,占22.34%,HPV18阳性最低,仅占7.38%。通过研究明确了本地区HPV感染流行的主要型别,将对HPV感染引起的宫颈病变的预防和治疗提供可靠依据。根据目前的资料显示,相较于HPV16和HPV18,其他12种HR-HPV的致癌风险相对较低,阳性患者只需定期复查[15]。因本研究所用检测方法的局限性,是对12种HR-HPV亚型感染的汇总结果,并不能具体到某一型别。随着对不同HR-HPV亚型感染与宫颈病变研究的深入,发现其他12种HR-HPV亚型对宫颈病变的预防治疗也具有越来越重要的意义。因此,通过其他检测方法对12种HR-HPV亚型进行具体分型检测,也是今后HR-HPV分型检测的方向。
本研究结果显示,HPV16阳性患者宫颈病变为HSIL(CINⅡ~Ⅲ)者最多,占53.88%,显著高于HPV18阳性和其他12种HR-HPV阳性患者的宫颈病变为HSIL(CINⅡ~Ⅲ)者(分别占29.41%、28.70%),不同HR-HPV亚型宫颈病变程度比较,差异有统计学意义(P<0.05)。由此可见,HPV16是致病力最强的亚型,更易致宫颈高级别病变。与大多数文献报道结果一致。其原因可能是HPV16感染后抑制机体免疫应答能力更强,更易实现持续性感染有关[16]。故应加强对HPV16阳性患者的管理,发现阳性者积极进行阴道镜检查,及早发现宫颈高级别病变。
宫颈癌的发生、发展是由量变到质变、渐变到突变的连续过程。因此,在宫颈疾病治疗前有必要了解HR-HPV感染状况及基因型别,将有利于宫颈癌的预防、疫苗的研制和接种,以及对宫颈疾病患者的术后管理,应引起患者、医院和社会的高度关注。
南京地区女性HR-HPV阳性率随年龄的增长逐渐增高。以单一感染为主,但多重感染能显著增加宫颈病变发生率,其中HPV16亚型感染更易引发宫颈高级别病变。

