枯草芽孢杆菌BC80-6 发酵条件的优化及对烟草根黑腐病的控病效果
王文凤,张丽娜,朱启法,汪文杰,周本国,檀根甲*,许大凤*
1. 安徽农业大学,合肥市长江西路130 号 230036
2. 中国烟草总公司安徽省公司,合肥市政务区潜山南路666 号 230071
3. 安徽皖南烟叶有限责任公司,安徽省宣城市鳌峰中路72 号 242000
4. 安徽省烟草公司池州市公司,安徽省池州市清风东路89 号 247000
5. 安徽省农科院烟草研究所,合肥市农科南路40 号 230031
枯草芽孢杆菌是一类好氧性革兰氏阳性细菌[1-2]。在自然界分布广泛,对环境友好,是土壤和植物微生态中的优势微生物种群。枯草芽孢杆菌抗逆性较强,具有很好的抗菌防病作用[3-4],可防治多种植物病害[5-6]。乔俊卿等[7]发现枯草芽孢杆菌BS916 可以在番茄根部有效定殖,是其在田间防治番茄青枯病的重要保障。刘庆丰等[8]利用枯草芽孢杆菌XF-1 来抑制白菜根肿病菌的侵染和繁殖。顾真荣等[9]发现枯草芽孢杆菌G3 不仅能较好的防治菜豆和茄子苗期的炭疽病和菌核病,同时还能防治番茄的叶霉病,防效达78.8%。黎起秦等[10]发现内生枯草芽孢杆菌B47对番茄青枯病的防效可达79.79%。易龙等[11]利用内生枯草芽孢杆菌T295 较好的控制了烟草根黑腐病的发生。由于枯草芽孢杆菌具有稳定的定殖能力和适应能力,使其具有巨大生存空间的竞争优势,从而能有效发挥其抗菌防病作用。但由于在引入新拮抗枯草芽孢杆菌时,需要打破原来的生态平衡,且拮抗枯草芽孢杆菌的定殖较为复杂和困难,这就使很多拮抗菌的生防效果不稳定。枯草芽孢杆菌BC80-6(Bacillus subtilis,BC80-6)是低能离子束注入诱变获得的拮抗菌,具有较强的广谱性,对烟草根黑腐病菌(Thielaviopsis basicola)具有一定的生防作用。为此,探究了3 种BC80-6 菌株处理液对烟草根黑腐病菌菌丝生长、孢子萌发的抑制作用,再以菌株BC80-6 活菌含量为指标,优化菌株BC80-6的发酵培养基成分和发酵条件,并开展田间控病防效试验,旨在为建立烟草根黑腐病的绿色防控体系提供依据。
1 材料与方法
1.1 材料和试剂
1.1.1 材料
烤烟品种为云烟97,由安徽省农业科学院烟草研究所提供。枯草芽孢杆菌BC80-6(Bacillus subtilis,BC80-6)和烟草根黑腐病菌[Thielaviopsis basicola(Berk.et br.)Fer.]均由安徽农业大学植物保护学院病理研究室分离、鉴定与保存。
1.1.2 试剂
葡萄糖、乳糖、淀粉、甘油、麦芽糖、酵母浸出物、牛肉膏、尿素、氯化铵、大豆蛋白胨、蛋白胨、葡萄 糖、琼 脂 粉、NaCl、K2HPO4、NaH2PO4、MgSO4、CaCl2、FeSO4、MnCl2(合肥沐辰生物技术有限公司),70%甲基托布津可湿性粉剂(河北冠龙农化有限公司),80%多菌灵可湿性粉剂(江苏泰仓农化有限公司)。
1.2 方法
1.2.1 培养液制备
将枯草芽孢杆菌BC80-6 在NA 培养基上活化48 h后,接入50 mL的NB培养液中,28 ℃、180 r/min振荡培养72 h,进行活菌液、过滤液和高温灭菌液的制备[12]。①活菌液:将培养液4 000 r/min 离心15 min 后弃上清液,沉淀中加入无菌水混匀后,4 000 r/min 离心15 min 后弃上清液,重复上述步骤1 次,获得浓度为1×108cfu/mL 的活菌液。②过滤液:将培养液先用0.22 μm 的微孔滤膜过滤,将过滤后的溶液8 000 r/min 离心30 min,离心后获得的上清液即为过滤液。③高温灭菌液:将过滤液经121 ℃灭菌20 min,获得高温灭菌液。
NA 培养基:牛肉浸膏3 g,蛋白胨5 g,葡萄糖10 g,琼脂粉20 g,水1 L。
NB 培养基:牛肉浸膏3 g,蛋白胨5 g,葡萄糖10 g,水1 L。
1.2.2 生长抑制率的测定
病原菌菌碟的制备:挑取一小块病原菌接入PDA 平板中,在25 ℃恒温培养箱中培养5 d。用直径为4 mm 的打孔器沿菌落边缘打取菌碟,将菌碟接入PDA 平板中央,25 ℃培养9 d,再用直径为4 mm 的打孔器沿菌落边缘打取菌碟,备用。
将活菌液、过滤液、高温灭菌液分别按1∶10、1∶100、1∶500 进行稀释,制备成3 种PDA 培养基。在3 种培养基中分别接入病原菌菌碟,置于25 ℃恒温培养箱中培养,每隔3 d 观察一次。不加任何处理液的培养基为对照,每个处理重复3 次。9 d后用十字交叉法测量菌落直径,计算不同培养液对菌丝生长的抑制率。
菌丝生长抑制率=(对照组菌落平均直径-处理组菌落平均直径)/对照组菌落平均直径×100%
1.2.3 孢子萌发抑制率的测定
将烟草根黑腐病病原菌接入PDA 平板中,在25 ℃恒温培养箱中培养9 d 后,配制孢子悬浮液(浓度为2×105个/mL)。将活菌液、过滤液、高温灭菌液分别按1∶20、1∶200、1∶1 000 进行稀释,再分别与孢子悬浮液按1∶1 的比例进行混合。取150 μL的混合液滴于凹玻片中,置于培养皿内保湿,25 ℃恒温培养箱中培养。无菌水处理为对照,每个处理重复3 次。6 h 后观察孢子的萌发情况,每个处理镜检300 个孢子,并计算不同处理液浓度对烟草根黑腐病菌分生孢子萌发的抑制率。
孢子萌发抑制率=(对照组孢子萌发平均数-处理组孢子萌发平均数)/对照组孢子萌发平均数×100%
1.2.4 培养基成分的优化
种子液的配制。将枯草芽孢杆菌BC80-6 接种在NA 培养基上培养48 h 后,用接种环蘸取活化后的菌种,接入装有25 mL 种子培养基(蛋白胨10 g,酵母浸出物5 g,氯化钠10 g,水1 L,pH 7.0)的三角瓶中,28 ℃、180 r/min 黑暗振荡培养36 h。
碳源的优化。分别用1%葡萄糖、1%乳糖、1%淀粉、1%甘油和1%麦芽糖(W/V)等量替代基础发酵培养基中的蔗糖,制成不同碳源培养基。基础发酵培养基(蔗糖10 g,蛋白胨10 g,氯化钠5 g,水1 L,pH 7.0)为对照。按5%的接种量分别接入装有25 mL 不同碳源培养基的培养瓶中,160 r/min、28 ℃下黑暗振荡培养。24 h 后测定不同碳源培养基中活菌含量(活菌含量即1 mL 培养基中所含枯草芽孢杆菌的数量,cfu/mL),每个处理重复3 次。根据不同碳源培养基中的活菌含量确定最佳碳源。
氮源的优化。分别用1%酵母浸出物、1%牛肉膏、1%尿素、1%氯化铵、1%大豆蛋白胨(质量体积比)替代基础发酵培养基中的蛋白胨,以基础发酵培养基为对照。按5%的接种量接入分别装有25 mL 不同氮源培养基的培养瓶中,160 r/min、28 ℃条件下黑暗振荡培养,24 h 后测定不同氮源培养基中的活菌含量,每个处理重复3 次。根据不同氮源培养基中的活菌含量确定最佳氮源。
无机盐的优化。根据微生物对大量元素与微量元素不同的利用情况[13],在不同基础发酵培养基 中 分 别 加 入0.5% NaCl、0.5% K2HPO4、0.5%NaH2PO4、0.05% MgSO4、0.05% CaCl2、0.005‰FeSO4、0.005‰MnCl2(质量体积比),基础发酵培养基为对照。按5%的接种量接入装有25 mL 不同无机盐培养基的培养瓶中,160 r/min、28 ℃条件下黑暗振荡培养,24 h 后测定不同无机盐培养基中的活菌含量,每个处理重复3 次。根据不同无机盐培养基中的活菌含量确定最佳无机盐种类。
通过氮源、碳源、无机盐3 个单因素试验,筛选出最佳氮源、碳源、无机盐的种类。设置最佳氮源含量(A)、最佳碳源含量(B)、最佳无机盐含量(C)3 个因素处理,每个因素分别设置3 个水平,按L9(33)正交设计进行试验。
1.2.5 发酵条件的优化
生长曲线的测定。将活化的枯草芽孢杆菌BC80-6 接入1.2.4 节中确定的最优培养基中,25 ℃发酵培养,每3 h 取1 次菌液,测定菌液OD600,共培养48 h。未接菌的培养基为空白对照。以时间为横坐标,菌体OD600为纵坐标,绘制枯草芽孢杆菌的生长曲线。
培养温度的优化。摇床温度设定为25、28、30、33、35、37、40 ℃,将BC80-6 接到50 mL 优化后的培养基中,摇瓶培养24 h 后,测定活菌含量并绘制图表。
培养液初始pH 值的优化。优化培养基的初始pH 设为5.5、6.0、6.5、7.0、7.2、7.5、8.0,将BC80-6接入不同pH、50 mL 优化后的培养基中,在最适生长温度下培养24 h 后,测定活菌含量并绘制图表。
接种量的优化。按1%、3%、5%、7%、9%(体积比)的接种量将BC80-6 分别接入到50 mL 优化后的培养基中,在最适生长温度下培养24 h 后,测定活菌含量并绘制图表。
转速的优化。摇床转速分别调节为120、140、160、180、200、220 r/min,将BC80-6 接入到50 mL优化后的培养基中,在最适生长温度下培养24 h后,测定活菌含量并绘制图表。
装液量的优化。在5 个250 mL 三角瓶中,分别装入20、40、60、80 和100 mL 优化后的培养基,按照最适接种量将BC80-6 接入到培养基中,在最适生长温度下培养24 h 后,测定活菌含量并绘制图表。
1.2.6 田间防控效果调查
BC80-6 发酵液和病原菌孢子悬浮液的制备。根据摇瓶培养优化的发酵条件,用40 L 发酵罐扩大培养BC80-6 至菌液浓度为1×108cfu/mL,用于灌根施药。将烟草根黑腐病原菌接入PDA 培养基中,25 ℃恒温培养9 d。用无菌水冲洗PDA 平板上的病原菌,制备浓度为106~107个/mL 的孢子悬浮液。
在安徽省宣城市黄渡乡选择土壤肥力较好的地块作为试验田。于2017 年3 月14 日进行大田移栽,烟苗移栽两周后进行接种。用灭菌的剪刀斜切烟草根部造成伤口,取20 mL 孢子悬浮液灌于烟株根部。接种后10 d 进行灌根施药,每株烟苗200 mL 发酵液。同时设70%甲基托布津可湿性粉剂、80%多菌灵可湿性粉剂和清水为对照。每个处理20 株烟草,共3 次重复,随机区组排列。施药后第20 天,按照GB/T 23222—2008[14]进行病害调查及分级,并计算发病率、病情指数及防治效果,用DPS 软件对数据进行方差分析。
2 结果与分析
2.1 处理液对烟草根黑腐病菌菌丝生长及孢子萌发的影响
由表1 可知,3 种枯草芽孢杆菌BC80-6 处理液对烟草根黑腐病菌菌丝的生长均具有抑制作用。随着处理液稀释倍数的增加,其对BC80-6 菌丝生长的抑制率逐渐减小。其中,活菌液的抑制效果最好,10-1倍的活菌液对BC80-6 菌丝生长的抑制率为93.20%。10-1倍的过滤液和高温灭菌液对BC80-6 菌丝生长的抑制率分别为74.9%、7.4%,高温灭菌液抑制效果最差。

表1 不同处理液对烟草根黑腐病菌的抑制作用Tab.1 Inhibitory effects of different treatment solutions on T. basicola
3 种枯草芽孢杆菌BC80-6 处理液对烟草根黑腐病菌孢子的萌发均具有抑制作用(表1)。其中,活菌液和过滤液对烟草根黑腐病菌孢子的萌发均具有较好的抑制作用,10-1倍的活菌液和过滤液对孢子萌发的抑制率分别为95.3%、93.4%。随稀释倍数的增加,活菌液和过滤液对孢子萌发的抑制率逐渐降低,且不同稀释倍数之间差异显著。灭菌液的抑制效果最差,10-1、10-2、5×10-2倍的灭菌液对孢子萌发的抑制率为30.3%、3.8%和2.4%。
2.2 培养基成分的优化
2.2.1 碳源的优化
由图1 可知,菌株BC80-6 在不同碳源培养基中均可生长。其中,在蔗糖为碳源的培养基中,菌株BC80-6 的活菌含量最高,为1.58×109cfu·mL-1;葡萄糖和乳糖次之,其活菌含量分别为1.42×109和1.39×109cfu·mL-1。因此,菌株BC80-6 生长的最佳碳源是蔗糖,其次是葡萄糖。
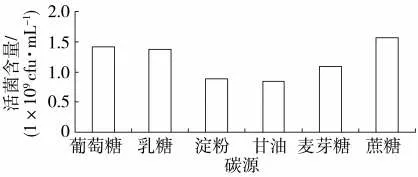
图1 碳源对枯草芽孢杆菌生长的影响Fig.1 Effects of carbon sources on growth of B. subtilis
2.2.2 氮源的优化
由图2 可知,氮源为有机氮时菌株BC80-6 的生长明显优于无机氮。以无机氮(尿素、氯化铵)为氮源,菌株BC80-6 的活菌含量较少(<0.28×109cfu·mL-1),说明菌株BC80-6 不能很好地利用这两种氮源。以有机氮(酵母浸出物、牛肉膏、蛋白胨和大豆蛋白胨)为氮源,菌株BC80-6 的活菌含量均高于1.2×109cfu·mL-1。菌株BC80-6 生长的最适氮源是酵母浸出物,活菌含量为1.95×109cfu·mL-1。

图2 氮源对枯草芽孢杆菌生长的影响Fig.2 Effects of nitrogen sources on growth of B. subtilis
2.2.3 无机盐的优化
由图3 可知,菌株BC80-6 在无机盐为MgSO4、CaCl2、NaCl2的培养基中生长较好,活菌含量较多,分别为1.98×109、1.54×109和1.52×109cfu·mL-1。菌株BC80-6 不适合在含FeSO4的培养基中生长,活菌含量仅为0.62×109cfu·mL-1,远小于CK(1.4×109cfu·mL-1)的活菌含量。因此,菌株BC80-6 在无机盐为MgSO4的培养基中生长最好。

图3 无机盐对枯草芽孢杆菌生长的影响Fig.3 Effects of inorganic salts on growth of B. subtilis
2.3 碳源、氮源、无机盐3 因素的正交优化
由2.2 节结果可知,最佳碳源、氮源、无机盐的种类分别是:蔗糖、酵母浸出物、MgSO4。蔗糖、酵母浸出物、MgSO4各设3 个含量水平,进行正交试验(表2)。
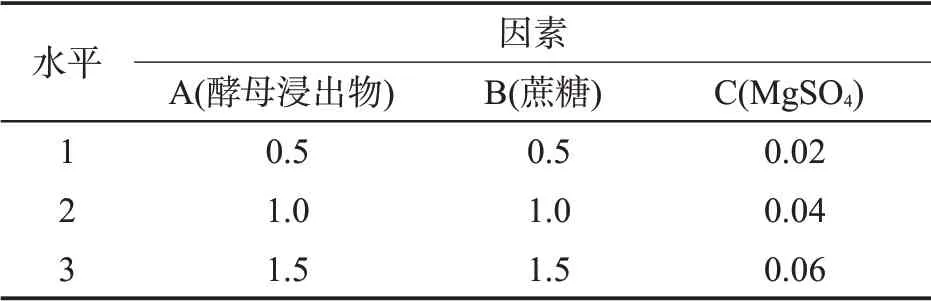
表2 正交试验因素和水平编码Tab.2 Factors and levels of orthogonal experiment(%)
正交试验结果(表3)表明:当培养基中的酵母浸出物、蔗糖、MgSO4含量分别为0.5%、1.5%、0.06%时,菌株BC80-6 的活菌含量最高,即最适合菌株BC80-6 的生长。R 值能反应3 种因子对活菌含量影响的大小,R 值越大,则该因子的影响越大。RA>RB>RC,即酵母浸出物含量对菌株BC80-6生长的影响最大,为主要因子,蔗糖含量其次,MgSO4影响最小。
F 检验结果(表4)表明:酵母浸出物的F 值最大,为110.789(>F0.01),呈极显著差异,是主要影响因素。蔗糖的F 值介于F0.01与F0.05之间,呈显著差异。硫酸镁的F 值<F0.05,对菌株BC80-6 生长的影响较小。
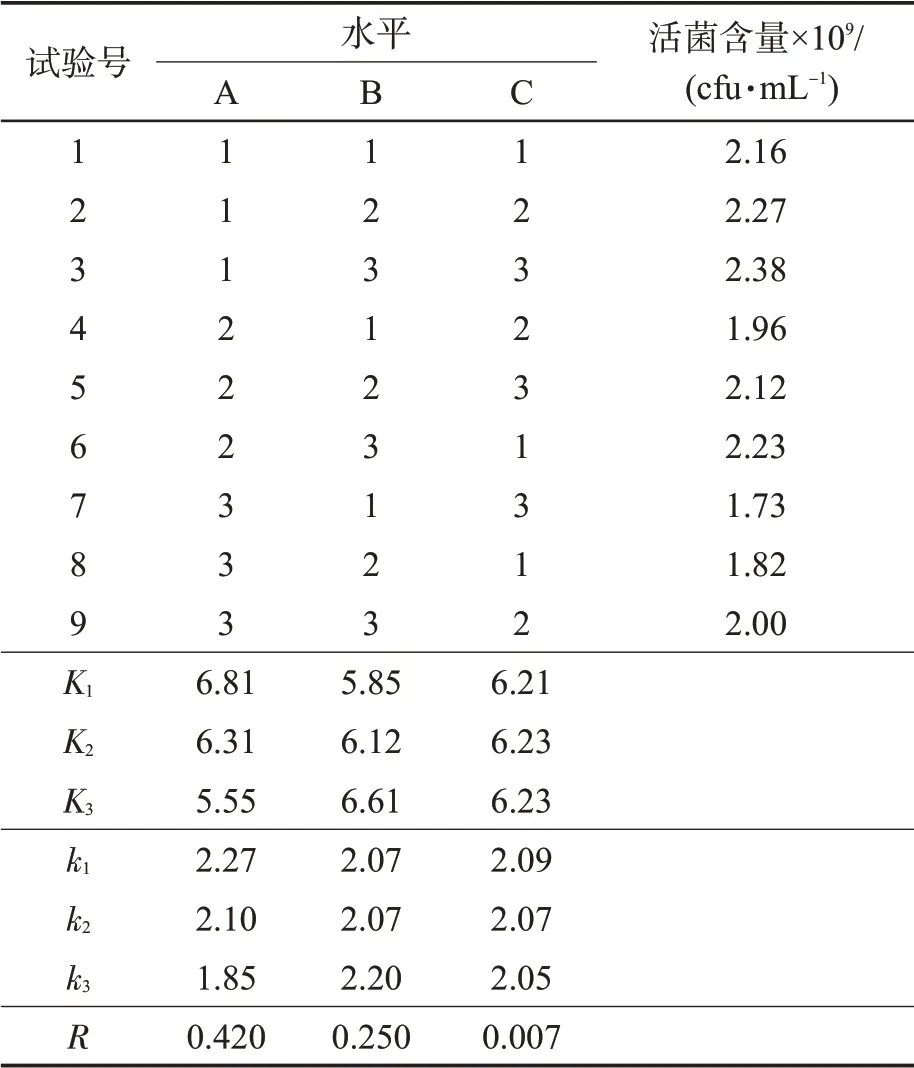
表3 L9(33)正交试验结果①Tab.3 Results of L9(33)orthogonal experiment
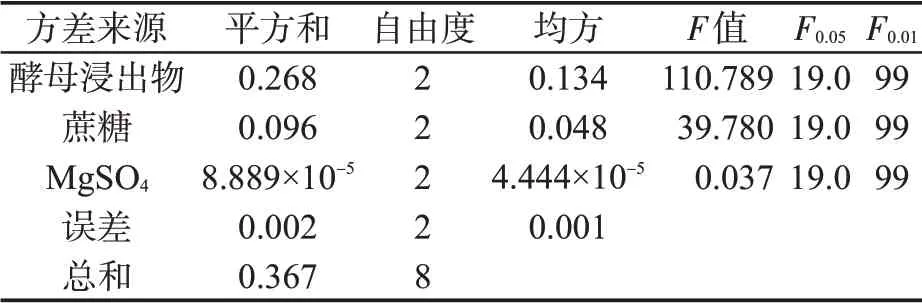
表4 正交试验的方差分析Tab.4 Variance analysis of orthogonal experiment result
2.4 发酵条件的优化
2.4.1 生长曲线的测定
由图4 可知,0~3 h 为菌株BC80-6 的生长停滞期,活菌含量增长较少。3 h 后菌株BC80-6 生长较快,活菌含量大幅增加。9~24 h,菌株BC80-6 生长稳定,活菌含量增长缓慢。24 h 活菌含量达到最大,为2.5×109cfu/mL。24 h 后活菌含量开始减少,菌株BC80-6 进入生长衰亡期。因此,选用培养9~24 h 的菌液为菌种较合适,此时菌株BC80-6在对数生长末期,既有较高的细胞活力,又可获得较多的细胞数。2.4.2 培养温度的优化

图4 枯草芽孢杆菌BC80-6 的生长曲线Fig.4 Growth curve of B. subtilis BC80-6
由图5 可知,菌株BC80-6 适宜在25~28 ℃生长。在28 ℃时,其发酵液里活菌含量最多,为2.52×109cfu/mL。因此,28 ℃是菌株BC80-6 的最适培养温度。
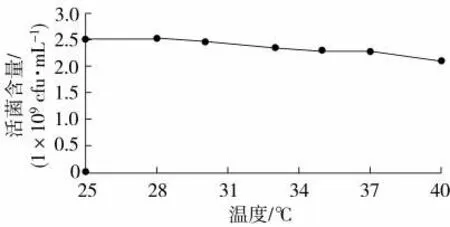
图5 温度对枯草芽孢杆菌BC80-6 生长的影响Fig.5 Effects of temperature on growth of B. subtilis BC80-6
2.4.3 培养液初始pH 的优化
由 图6 可 知,当pH 在5.5~6.5 之 间,菌 株BC80-6 的活菌含量随pH 的增大而增大。当pH 为6.5 时,活菌含量达到最大,为2.44×109cfu/mL。当pH 在6.5~8.0 之间,随着pH 的增大,菌株BC80-6的活菌含量明显下降。因此,培养液的pH 应控制在6.5 左右。

图6 pH 对枯草芽孢杆菌BC80-6 生长的影响Fig.6 Effects of pH on growth of B. subtilis BC80-6
2.4.4 接种量的优化
由图7 可知,当接种量为5%时,菌株BC80-6的活菌含量最多,为2.48×109cfu/mL。因此,5%的接种量为最适接种量。

图7 接种量对枯草芽孢杆菌的影响Fig.7 Effects of inoculation amount on B. subtilis
2.4.5 转速的优化
由图8 可知,转速从120 r/min 增加至180 r/min时,菌株BC80-6 的活菌含量逐渐增加,转速从180 r/min 增加至220 r/min 时,活菌含量逐渐减少。转速为180 r/min 时,菌株BC80-6 的活菌含量最多,为2.48×109cfu/mL,表明转速影响菌株BC80-6 的生长。因此,菌株BC80-6 的最佳转速为180 r/min。
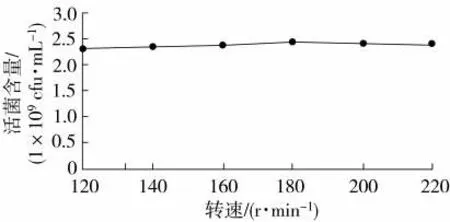
图8 转速对枯草芽孢杆菌生长的影响Fig.8 Effects of rotational speed on growth of B. subtilis
2.4.6 装液量的优化
由图9 可知,装液量不同,菌株BC80-6 的活性不同。当250 mL 三角瓶的装液量在20~40 mL 之间时,菌株BC80-6 的活菌含量随装液量的增加而增加。当250 mL 三角瓶的装液量大于40 mL 时,活菌含量随装液量的增加而下降。装液量为40 mL 时,菌株BC80-6 的活菌含量最多,为2.46×109cfu/mL。因此,摇床培养时,250 mL 三角瓶的最佳装液量为40 mL。
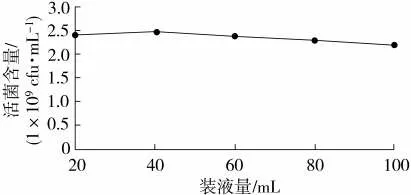
图9 装液量对枯草芽孢杆菌BC80-6 生长的影响Fig.9 Effects of loading solution on growth of B. subtilis BC80-6
2.5 枯草芽孢杆菌BC80-6 对烟草根黑腐病的田间防控效果
结果(图10)表明,大多数对照组烟苗出现明显的根黑腐病症状,烟苗根系出现黑色腐烂,植株明显矮化,叶片萎蔫,长势较差。菌株BC80-6 处理的烟苗地上部分较少出现萎蔫症状,长势较好,根部正常。由表5 可知,菌株BC80-6 处理的烟株发病率和病情指数显著低于对照组,大田防治效果达88.19%。与生产上使用的化学药剂(多菌灵和甲基托布津)防治效果差异不大。

图10 枯草芽孢杆菌大田防治烟草根黑腐病的效果Fig.10 Control effects of B. subtilis on tobacco black root rot in fields
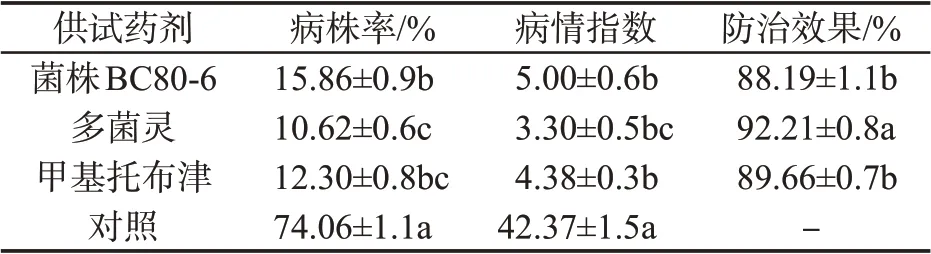
表5 枯草芽孢杆菌对烟草根黑腐病的控病效果Tab.5 Control effects of B. subtilis on tobacco black root rot
3 讨论
枯草芽孢杆菌可通过产生抗菌物质来抑制病原菌的生长[15-18]。本研究中,枯草芽孢杆菌BC80-6 的过滤液和灭菌液对烟草根黑腐病菌的菌丝和孢子有一定抑制作用,表明菌株BC80-6 可产生某些抗菌物质来抑制烟草根黑腐病菌的生长。菌株BC80-6 活菌液对烟草根黑腐病菌菌丝和孢子的抑制效果最好,可能是由于菌株BC80-6 不断繁殖产生更多抗菌物质,或与病原菌不断争夺营养,从而有效地抑制病原真菌生长。
通过发酵试验对菌株BC80-6 培养基的配方及培养条件进行优化,结果表明培养条件的不同,碳氮无机盐及其含量的不同对菌株BC80-6 的活菌含量影响很大。优化后的菌株BC80-6 培养基成分及其含量与已报道的培养基成分具有差异[19-22],可能跟不同菌株的生活环境不同、所需要的营养成分也不同有关。优化后的菌株BC80-6 培养条件与叶云峰等[13]、秦艳等[19]、孙莎莎[23]等的研究结果有所不同。不同细菌的寄居环境不同,因而其最佳发酵条件也不同。优化后的培养基成分较少、价格相对较低,而且是生产上较容易获得的化工原料,因而在工业化发酵生产中有一定的优势。
易龙等[24]在温室中测定了芽孢杆菌对烟草根黑腐病菌的控病试验,发现芽孢杆菌的防效为80.2%,与对照药剂多菌灵和甲基托布津的处理效果无明显差异。本试验中,菌株BC80-6 对烟草根黑腐病的大田防效为88.19%,接近生产上使用的多菌灵和甲基托布津(分别为92.21%、89.66%)的防效。表明芽孢杆菌具有较好的生物防治能力,可用于烟草根黑腐病的生物防治。
4 结论
①在3 种枯草芽孢杆菌BC80-6 处理液对烟草根黑腐病菌菌丝生长、孢子萌发的抑制试验中,抑制效果最好的是10-1倍活菌液。②1.5%蔗糖、0.5%酵母浸出物、0.06%硫酸镁(质量体积比)是培养菌株BC80-6的最佳培养基配方。③在时间24 h、温度28 ℃、初始pH 6.5、摇床转速180 r/min、接种量5%、250 mL 三角瓶装液量40 mL 的条件下,最有利于菌株BC80-6 的发酵。④菌株BC80-6 活菌液对烟草根黑腐病的大田防效达88.19%。

