SS-31对蛛网膜下腔出血大鼠模型早期脑损伤及NLRP3炎性小体的影响
彭 华, 唐晓平, 孙浩耕, 赵 龙, 杨彬彬, 张 涛
(川北医学院附属医院神经外科, 四川 南充 637000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种具有高发病率和死亡率的中风疾病[1]。最近的研究表明,早期脑损伤(early brain injury,EBI)在SAH患者的不良预后中起关键作用[2]。越来越多的证据表明,神经炎症在SAH的早期阶段有助于损伤进展[3]。Nod样受体蛋白3(NLRP3)炎性小体被认为可以调解中风后的脑损伤。在NLRP3炎性体激活后,促进白细胞介素1β(IL-1β)和白细胞介素18(IL-18)的成熟和分泌,从而启动细胞凋亡(pyrotosis)促炎细胞死亡途径[4]。已有研究表明,NLRP3炎性小体的激活与多种疾病的发生及病情进展相关。在中枢神经系统中,异常激活的NLRP3炎性小体是神经退行性疾病的发病原因之一[5]。大量研究表明,脑出血后NLRP3炎性小体被激活,并损伤脑组织。因此,通过药理学的抑制或者沉默NLRP3的表达,则可以降低SAH后的脑损伤程度。线粒体靶向抗氧化肽SS-31是一种新型的线粒体靶向肽,可以穿透血脑屏障,定位于线粒体内膜。当细胞稳态受到干扰时,SS-31会作为抗氧化剂来消除过量的活性氧(ROS)。已有研究表明,SS-31对SAH后EBI有保护性作用[6],但具体机制和作用途径尚不清楚。本实验旨在探讨线粒体靶向抗氧化肽SS-31对NLRP3炎性小体的影响以及对SAH早期脑损伤的作用,现报道如下。
1 材料与方法
1.1 实验动物成年雄性Sprague-Dawley(SD)大鼠120只,体质量310~330 g,购自北京华阜康生物科技股份有限公司。将大鼠饲养于昼夜分明,湿度、温度适宜的干净环境中,按时按需给予食物和水。动物实验经川北医学院动物伦理委员会批准进行。
1.2 实验试剂SS-31购自上海强耀生物有限科技公司,ROS测定试剂盒购自南京建成生物工程研究所,DC蛋白质测定试剂盒购自美国Bio-Rad公司,NLRP3购自美国Abcam公司,IL-1β购自美国Santa公司,IL-18购自美国Abcam公司。
1.3 方法
1.3.1 动物分组 将大鼠随机分为4组:假手术组(Sham组)、手术组(SAH组)、手术+载体组(SAH+V组)和手术+SS-31组(SAH+SS-31组),每组30只。SAH+SS-31组在SAH后2 h经腹腔注射SS-31,剂量为5 mg/kg,SAH+V组在SAH后2 h经腹腔注射等量PBS溶液。
1.3.2 动物模型建立 SAH组用戊巴比妥(40 mg/kg,腹腔注射)麻醉大鼠后,暴露左颈动脉及其分支,将颈外动脉向远端横切,然后将4-0单丝尼龙缝合线置于内部,并通过颈内动脉前进直至感觉到阻力,其发生在大脑中动脉和大脑前动脉的交界处。将缝合线进一步推进约3~5 mm进行动脉穿孔并产生SAH,停留10 s。在Sham组中没有穿孔的情况下进行类似的手术。术中持续观测大鼠的动脉血压、体温和氧分压(PaO2)等生命体征。
1.3.3 神经功能评估 根据Fritz等[7]的评分系统,在SAH后24 h评估神经缺陷,评分系统包括以下6项测试:自发活动、四肢运动的对称性、前爪伸展、攀爬、身体本体感觉以及对触摸的反应。每个测试评分为0~3分或1~3分,总评分范围为3~18分。较低的评分代表更严重的神经缺陷。
1.3.4 脑含水量测量 在SAH后24 h处死大鼠。取出脑并立即称重以获得湿重(WW)。将样品在105℃下干燥24 h并再次称重以获得干重(DW)。脑含水量=[(WW-DW)/WW]×100%。
1.3.5 ROS测定 在SAH后24 h收集左基底皮质样品,按照制造商的说明用ROS测定试剂盒测量总ROS水平。将脑组织称重并在0.1 mmol/L PBS中匀浆,然后离心(1 000 r/min,10 min,4℃)。使用DC蛋白质测定试剂盒测定上清液的蛋白质浓度。将上清液(190 μL)加入96孔板中并与1 mmol/L DCFH-DA(10 μL)混合。将上清液与PBS混合,作为阴性对照。将样品在37℃下孵育30 min。通过分光荧光光度法在480 nm的激发波长和520 nm的发射波长下测量混合物。脑组织中的ROS水平表示为荧光强度/每毫克蛋白质。
1.3.6 蛋白质印迹分析 提取面向血块的同侧基底皮质样品。将皮质样品均质化,并离心(1 000 r/min,10 min,4℃)。将上清液进一步离心,然后使用小牛血清白蛋白标准品(DC蛋白质)测定试剂盒测定蛋白质浓度。将等量的蛋白质(50 μg)悬浮在上样缓冲液中,然后在95℃下变性5 min,并加载到SDS-聚丙烯酰胺凝胶(SDS-PAGE)上。电泳并转移到聚偏二氟乙烯膜上后,用非脂肪奶缓冲液封闭膜2 h,然后在4℃下与NLRP3(ab98151, 1∶800)、凋亡相关斑点样蛋白(ASC,ab155970, 1∶1 000)、半胱天冬酶-1(ab1872, 1∶1 000)、IL-1β(SC-23460, 1∶500)和IL-18(ab71495, 1∶1 000)的一抗进行孵育。将膜与辣根过氧化物酶缀合的第二抗体在室温下孵育1 h。通过X射线胶片检测蛋白质条带密度,并通过Image J软件定量。
1.3.7 Fluoro-Jade C染色 将样品干燥30 min,再水化,然后在0.06%高锰酸钾溶液中孵育10 min。用水冲洗后,将切片用0.000 1% Fluoro-Jade C溶液染色5 min。最后将切片再次干燥,在二甲苯中澄清,并用封固剂覆盖。
1.3.8 TUNEL和PANT染色 TUNEL染色检测DNA双链损伤。使用二氨基联苯胺(DAB)底物试剂盒进行过氧化物酶染色,然后将切片用苏木精复染。PANT染色检测具有单链DNA损伤的细胞。将切片在1% Triton X-100中冲洗,以使切片透化,采用2% H2O2淬灭内源性过氧化物酶。将切片与PANT反应混合物一起温育。在37℃下保持90 min。通过与链霉抗生物素蛋白-辣根过氧化物酶和DAB底物一起温育来检测掺入受损DNA中的生物素化dATP。
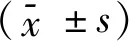
2 结果
2.1 SS-31对SAH大鼠神经功能和脑水肿的影响SAH组的神经学评分显著低于Sham组(P<0.05)(表1); SAH+SS-31组的神经学评分显著高于SAH+V组(P<0.05)。SAH诱导24 h后进行脑水肿定量检测发现,SAH组的全脑含水量显著高于Sham组;而SAH+SS-31组的脑含水量显著低于SAH+V组。
2.2 SS-31对SAH后大鼠ROS产生的影响SAH后24 h,ROS水平显著升高,与SAH+V组比较,SS-31处理的大鼠ROS的含量显著降低(表2)。
2.3 SS-31对SAH后大鼠NLRP3炎性小体的影响蛋白质印迹分析显示,Sham组的NLRP3、ASC和caspase-1的表达较低,SAH诱导后则显著增加,而经过SS-31治疗后其增加受到抑制(图1、表3)。
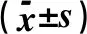
表1 大鼠神经功能和脑水肿结果
注: 与Sham组比较,*P<0.05; 与SAH + V组比较,#P<0.05; 与SAH+SS-31组比较,&P<0.05。

表2 各组大鼠ROS含量比较
注: 与Sham组比较,*P<0.05; 与SAH+V组比较,#P<0.05; 与SAH+SS-31组比较,&P<0.05。

图1 NLRP3等相关蛋白印迹分析
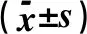
表3 各组大鼠NLRP3等相关蛋白表达情况比较
注: 与Sham组比较,*P<0.05; 与SAH+V组比较,#P<0.05; 与SAH+SS-31组比较,&P<0.05。
2.4 SS-31对SAH后大鼠IL-1β和IL-18的影响蛋白质免疫印迹分析发现,SAH后24 h,IL-1β和IL-18的表达显著增加,而与SAH+V组比较,SS-31处理的大鼠明显降低IL-1β和IL-18的表达(图2、3和表4)。
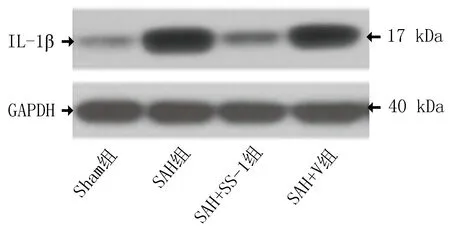
图2 IL-1β蛋白免疫印迹
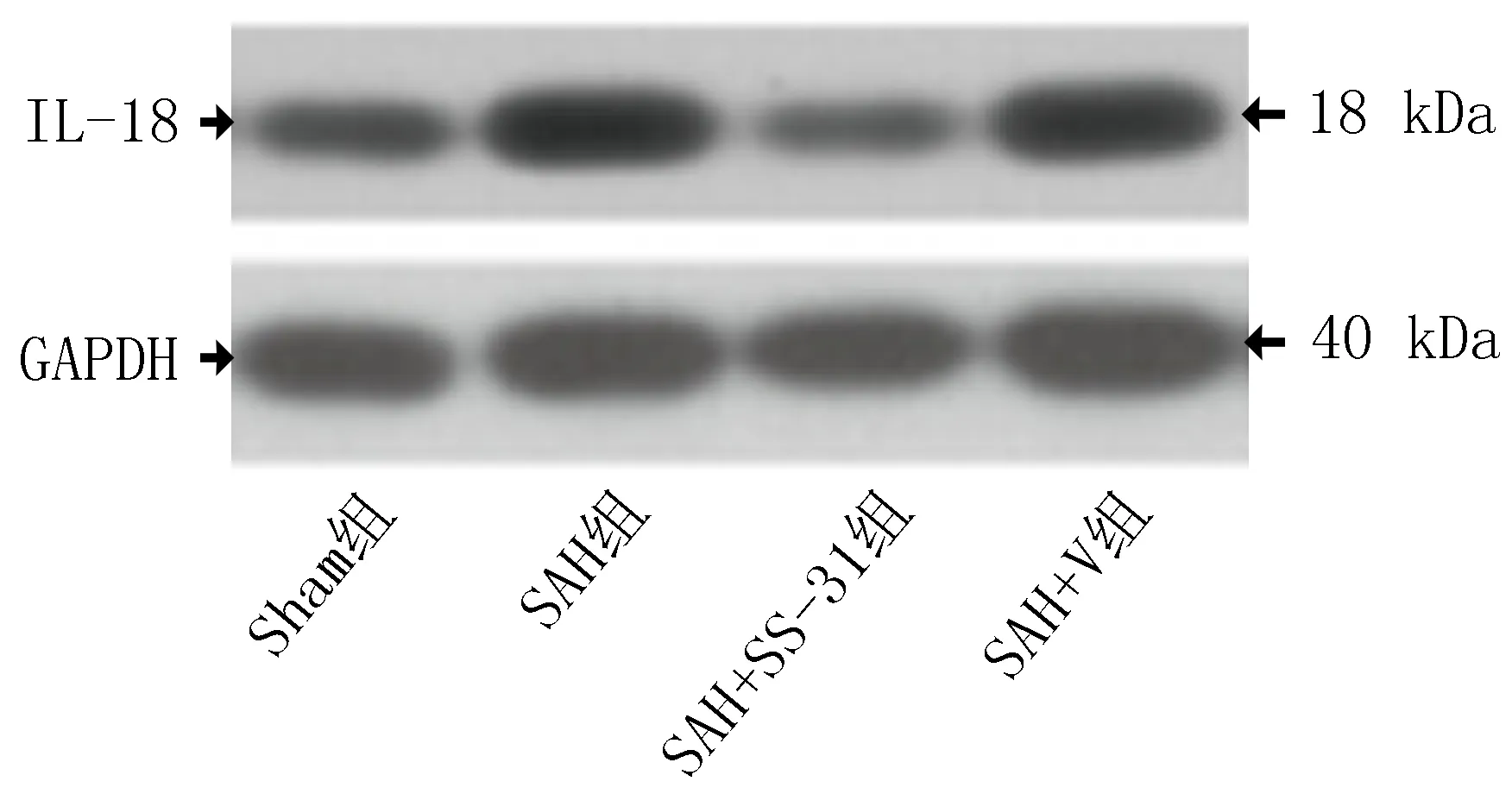
图3 IL-18蛋白免疫印迹
2.5 SS-31对SAH后神经细胞死亡的影响在Sham组大鼠中很少观察到Fluoro-Jade C阳性细胞,PANT阳性细胞和TUNEL阳性细胞,而与Sham组相比,SAH 组中阳性细胞的数量显著增加。SS-31治疗后可显著减少Fluoro-Jade C阳性细胞、PANT阳性细胞和TUNEL阳性细胞的数量(图4和表5)。
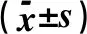
表4 各组大鼠IL-1β和IL-18含量比较
注: 与Sham组比较,*P<0.05; 与SAH+V组比较,#P<0.05; 与SAH+SS-31组比较,&P<0.05。
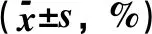
表5 各组大鼠神经细胞死亡情况比较
注: 与Sham组比较,*P<0.05; 与SAH+V组比较,#P<0.05; 与SAH+SS-31组比较,&P<0.05。

图4 SAH后24 h在同侧基底皮质中的TUNEL、PANT和Fluoro-Jade C染色
3 讨论
EBI是指SAH后的直接损伤,是SAH患者高死亡率和高发病率的主要原因。神经炎症反应对于SAH后的EBI有促进作用,激活的炎症细胞和增加的促炎性细胞因子是其主要的发病机制[8]。大量研究表明,炎症细胞和促炎性细胞因子均与中风后的脑损伤和神经功能障碍有关联[9]。在SAH后炎症反应中,NLRP3炎性体激活受到广泛关注。NLRP3可以受到内源性的刺激而被激活,如ROS和ATP[10]。已有研究表明,抑制NLRP3炎性体在SAH后的早期损伤中可发挥神经保护作用,这与促炎性细胞因子减少有关[11]。本研究制作大鼠SAH模型研究线粒体抗氧化肽SS-31对NLRP3炎性小体的影响以及对神经细胞的作用,结果表明SS-31治疗可以增加神经学评分,使SAH损伤后的大鼠脑水肿减少,线粒体抗氧化肽SS-31可以减少ROS的产生,从而抑制NLRP3炎性小体促进IL-1β和IL-18的成熟和分泌,使炎症反应降低,从而起到保护脑组织的作用。
本研究发现,抗氧化肽SS-31抑制SAH后炎性体介导的炎性反应,但尚不清楚抗氧化肽SS-31是否可以直接作用于NLRP3炎性小体及其作用机制。
线粒体对能量产生至关重要,对伤害很敏感。在SAH诱导的EBI中,线粒体通过停止三磷酸腺苷(ATP)合成,以及由于脑血流量的突然减少导致的ROS过量产生起关键作用[12]。Shi等[13]研究表明,抑制ROS诱导的氧化应激和炎症反应对SAH动物模型有益。缺血再灌注损伤后,ROS的形成和氧化应激促进组织炎症,并通过NLRP3炎性小体激活部分器官,如脑和心脏等的免疫反应[14]。本研究表明,抗氧化肽SS-31减少ROS产生与NLRP3炎性体激活抑制有关,与上述研究结果一致。
本研究表明,线粒体抗氧化肽SS-31对SAH后EBI的神经保护作用与NLRP3炎性体有关。本研究今后将使用ROS清除剂的抑制剂来进一步证实SAH后抗氧化肽SS-31的神经保护作用,SAH后ROS诱导的氧化应激也需进一步研究,不同药物在不同时间点给药的效果可能存在差异,应在进一步的研究中深入探讨。

