一株高效石油降解菌的筛选及降解性能研究
邢清朝,习彦花,单胜道,程辉彩,王宏伟,张丽萍
(1.河北省科学院 生物研究所,石家庄 050081;2.河北大学 生命科学学院,河北 保定 071000;3.浙江科技学院 环境与资源学院,杭州 310023)
石油是人类生产、生活中不可或缺的重要能源和工业原料。石油在开采、生产和运输过程中,常伴随由石油泄漏造成的环境污染。据估计,全世界范围内每年约有上千万吨的石油进入水体、土壤等自然环境中[1-3]。石油的主要成分是烷烃、苯、甲苯和二甲苯等复杂芳香烃,如进入食物链会对动物和人体造成损伤。因此,治理石油污染势在必行。石油污染处理常用的方法有物理、化学以及微生物修复法[4],物理、化学修复一般存在成本高、操作复杂、易造成二次污染等缺点,而微生物修复则具有操作简单、作用时间长、安全等优点[5]。微生物降解石油已成为当前石油污染生物修复的重要方法之一[6-7]。因此,本文拟筛选针对降解石油的微生物,以期为环境中石油污染生物修复提供新的菌种资源。
1 材料与方法
1.1 材 料
1.1.1 样品采集
石油污染样品采自石油污染的土壤。采集距地表10 cm左右土层的土壤,装入灭菌袋中,在实验室中除去杂物,低温保存,备用。
1.1.2 石 油
石油样品取自唐海冀东油田,室温下为黑色黏稠状物,密度为0.824 g/mL,50 ℃时黏度为8.75 mm2/s,正构烷烃含量50.52%。密封保存。
1.1.3 培养基
牛肉膏蛋白胨培养基(简称PB培养基):蛋白胨10 g/L,NaCl 5 g/L,牛肉膏5 g/L;pH值7.0~7.2(固体培养基加1.2%琼脂粉)。Luria-Bertani培养基(简称LB培养基):蛋白胨10 g/L,NaCL 10 g/L,酵母粉10 g/L,pH值7.0~7.2。石油培养基:无机盐基础培养基(简称MSM培养基)[8]加石油5 g/L;pH值7.0~7.5。
1.1.4 主要仪器与设备
电子分析天平A210P型,德国赛多利斯公司(Sartorius);BIO-RAD凝胶成像系统,美国伯乐公司(Bio-Rad);OLYMPUS光学显微镜,日本奥林巴斯公司(Olympus);752型紫外可见分光光度计,上海光谱仪器有限公司;DSQⅡ气相色谱-质谱联用仪,美国赛默飞世尔科技公司(Thermo);SIGMA2-16PK型高速台式离心机,美国西格玛有限公司(Sigma)。
1.2 方 法
1.2.1 石油降解菌的筛选
将5 g土壤样品加入100 mL石油培养基中,30 ℃、150 r/min摇床培养7 d,连续富集培养3次。采用平板划线法进行分离,30 ℃培养箱培养48 h。选择不同形态的单菌落,分别接种于PB固体平板,30 ℃培养箱培养48 h。对平板细菌进行涂片观察,确认无杂菌后,接种到PB固体斜面进行保存。
将纯化的单菌株于PB液体培养基中活化,吸取10 mL菌液加入到100 mL石油培养基中,对照组直接加入10 mL灭菌后的PB液体培养基,每株菌3个平行,25 ℃、180 r/min培养7 d,期间观察石油形态的变化,并于第7天测石油的降解率。
1.2.2 石油降解菌的鉴定
1.2.2.1 形态学观察 将菌株在细菌生长固体平板培养基上培养48 h,经番红染色后,用显微镜观察细胞形态[8]。
1.2.2.2 生理生化鉴定 参照《常见细菌系统鉴定手册》[9]进行鉴定。
1.2.2.3 分子生物学鉴定 利用Ezup柱式细菌基因DNA抽提式试剂盒进行基因组总DNA的提取。将提取的DNA用于16S rDNA PCR扩增,正向引物Pf5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物Pr5’-ACGGCTACCTTGTTACGACT-3’。PCR反应条件:95 ℃变性4 min;95 ℃ 1 min,52 ℃ 1 min,72 ℃ 3 min,32个循环;72 ℃延伸10 min。PCR产物回收、连接、转化测序由金唯智公司完成。将测序结果在GenBank上进行比对,采用MEGA6.0软件构建系统发育树。
1.2.3 石油降解性能
1.2.3.1 菌株XS -2生长曲线 将体积分数为5%的种子液接入LB培养基中,30 ℃、200 r/min摇床培养,每2 h取一次样,用分光光度计测定吸光度值(OD600),3个重复。
1.2.3.2 石油标准曲线测定 在0.250 g石油中加入少量正己烷,溶解、定容至50 mL,配成5 000 mg/L的标准溶液。将标准液梯度稀释成质量浓度0、10、20、30、40、50、100、150、200 mg/L。在分光光度计的200~300 nm,对中间质量浓度标准液进行光谱扫描[10],以确定最大吸收峰所用波长。在最大吸收峰波长下测定不同质量浓度标准液的吸光度,以吸光度值为纵坐标,石油质量浓度(mg/L)为横坐标绘制标准曲线。
1.2.3.3 样品预处理 降解后的残油用正己烷进行萃取,在标准曲线测定条件下测定吸光度。
1.2.3.4 石油去除率计算 石油去除率=[(石油初始质量浓度-培养液石油质量浓度)/石油初始质量浓度]×100 %。
1.2.3.5 残油GC分析 在预处理残油中取1 mL用于GC检测。检测条件参照王婧[4]研究中的GC条件。
1.2.4 菌株XS -2降解石油的影响因素

图1 菌株XS -2对石油的降解作用Fig.1 Petroleum degradation by strain XS -2
分别对环境温度、石油质量浓度和培养基初始pH等影响因素进行研究,于第7天测石油的降解率,选出XS -2在各项指标中的最佳值,作为红球菌降解石油的最佳条件。
2 结果与分析
2.1 石油降解菌筛选结果
通过连续富集传代培养的方法在样品中筛选出高效石油降解菌XS -2,该菌株对石油降解作用明显,如图1所示,24 h内石油完全为絮状物,形成油水混合物。
2.2 石油降解菌筛选结果
2.2.1 形态学观察
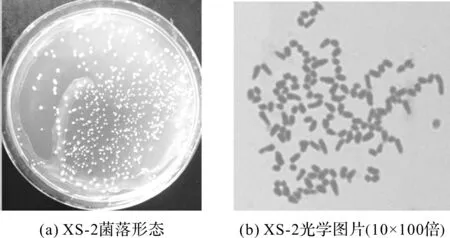
图2 XS -2菌落形态与菌体光学图片Fig.2 Colony morphology and optical photograph of strain XS -2
XS -2菌株在PB平板培养24 h,如图2(a)所示,其菌落特征为:菌落圆形、边缘整齐、不透明、表面凸起、干燥、颜色为橙红色。图2(b)是XS -2放大1 000倍菌体图片,生长前期菌体为杆状,随培养时间延长,菌体长度差异较大,变为椭球形。
2.2.2 生理生化鉴定
参照《常见细菌系统鉴定手册》[9]中操作方法对菌株XS -2进行以下试验项目的检测,结果如表1所示。细菌XS -2为好氧菌,不产芽孢,革兰氏染色阳性,甲基红反应阴性,V-P反应阳性,氧化酶阳性,接触酶阳性,不能液化明胶,能利用环糊精、柠檬酸盐、核糖、α-D-葡萄糖、D-果糖、丙酮酸、甘露糖,不能利用阿拉伯糖和棉子糖。这与孙磊等[11]分离的赤红球菌(Rhodococcusruber)S6-2的生理生化特性基本上一致。

表1 菌株XS -2生理生化鉴定结果Table 1 Physiological and biochemical tests of strain XS -2
注:“+”表示阳性,“-”表示阴性,“ND”表示未做检测。
2.2.3 分子生物学鉴定
通过16S rRNA测序,得到序列长度为1 500 bp左右的的基因片段,将测序结果上传GenBank,登陆号为MK380013,并与GenBank上的序列进行Blast比对,与红球菌属同源性最高,相似度达到99%。根据细菌形态、生理生化特性、16S rRNA测序结果构建XS -2的系统发育树(图3),综合分析,鉴定该菌株为赤红球菌。
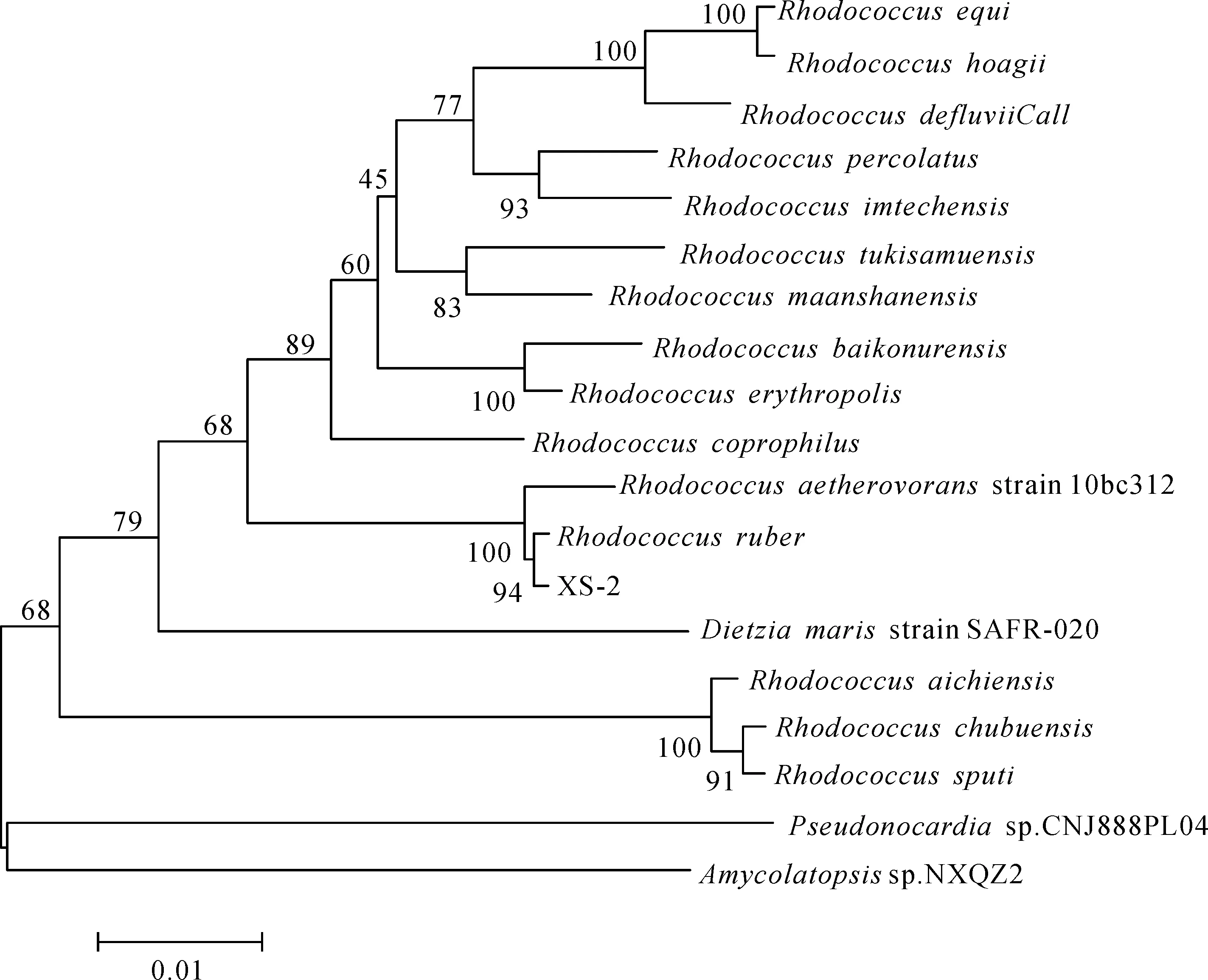
图3 菌株XS -2的系统发育树Fig.3 Phylogenetic tree of strain XS -2
2.2.4 菌株XS -2的生长曲线
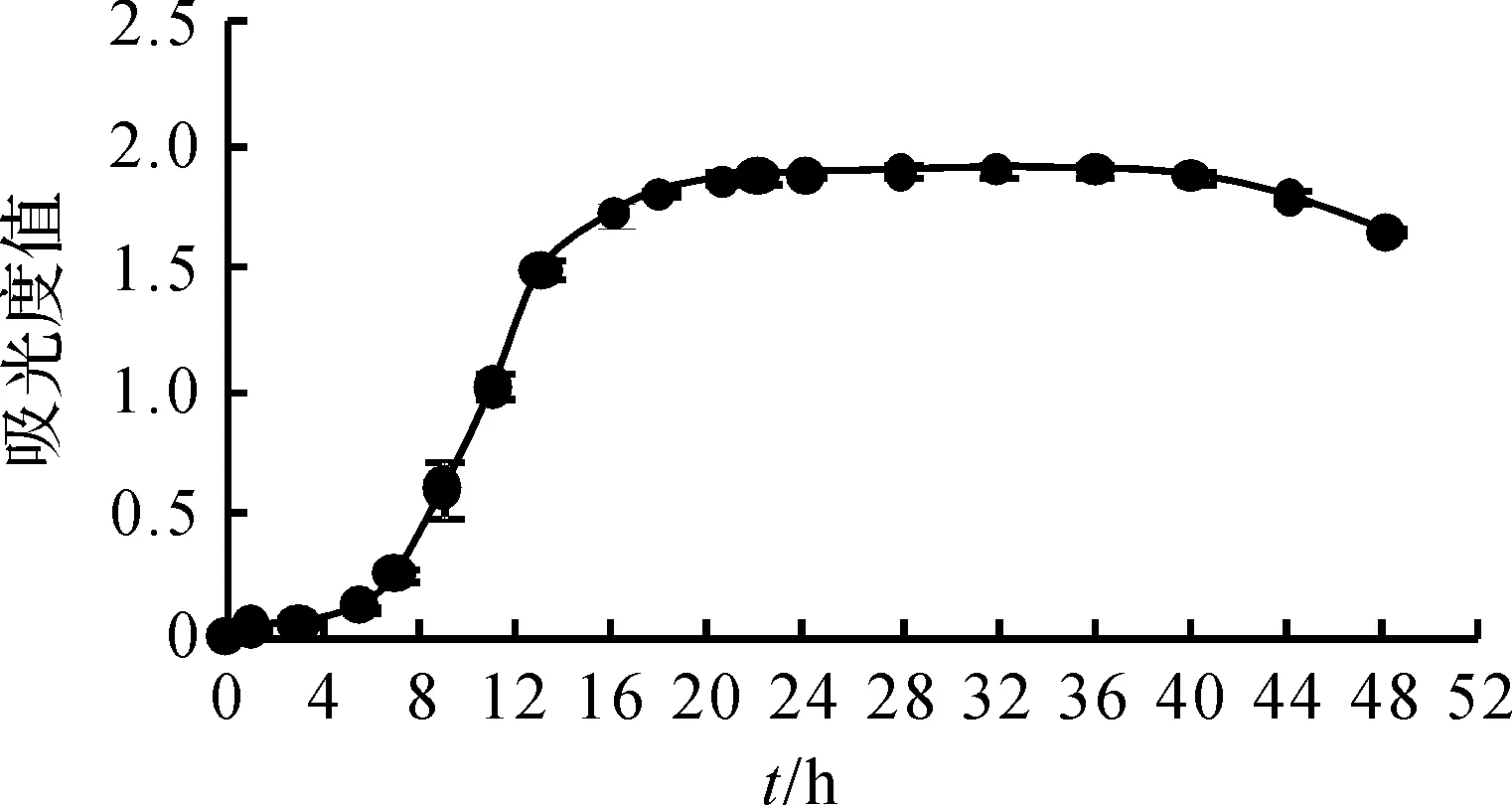
图4 菌株XS -2生长曲线Fig.4 Growth curve of strain XS -2
如图4所示,测定了XS -2在LB培养基中培养48 h内的生长量。结果表明,在LB培养基中,0~6 h为细菌生长的延滞期,6~16 h为对数生长期,16~44 h为生长稳定期,44 h以后细菌进入衰亡期。因此,后期试验采用培养16 h的菌液活性最高。
2.3 石油降解菌XS -2降解性能
2.3.1 最大吸收波长和标准曲线
通过紫外分光光度计进行光谱扫描发现,最大吸收波峰在224 nm处,在OD224分别测定不同标准液吸光度值,标准曲线如图5所示,相关系数R2为0.999 1,表明曲线拟合度很好。
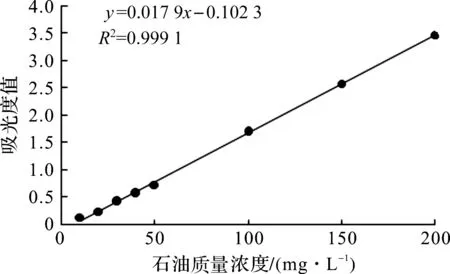
图5 石油标准曲线Fig.5 Standard curve of petroleum
2.3.2 降解菌XS -2对石油的降解情况
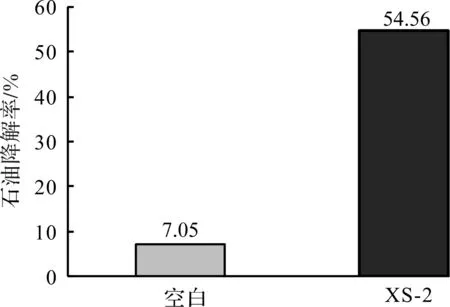
图6 XS -2石油降解率 Fig.6 Petroleum degradation rate of strain XS -2
取培养16 h的XS -2菌液,按体积分数5%接种量接入LB培养基,30 ℃、200 r/min培养,在前期表现出很好的降解作用,并且与对照组相比(图6),XS -2试验组锥形瓶瓶壁上没有明显的油膜。通过紫外分光光度法测得XS -2对石油的7 d降解率达到54.56%以上,因此可以作为石油污染生物修复的降解菌株。
2.3.3 GC分析
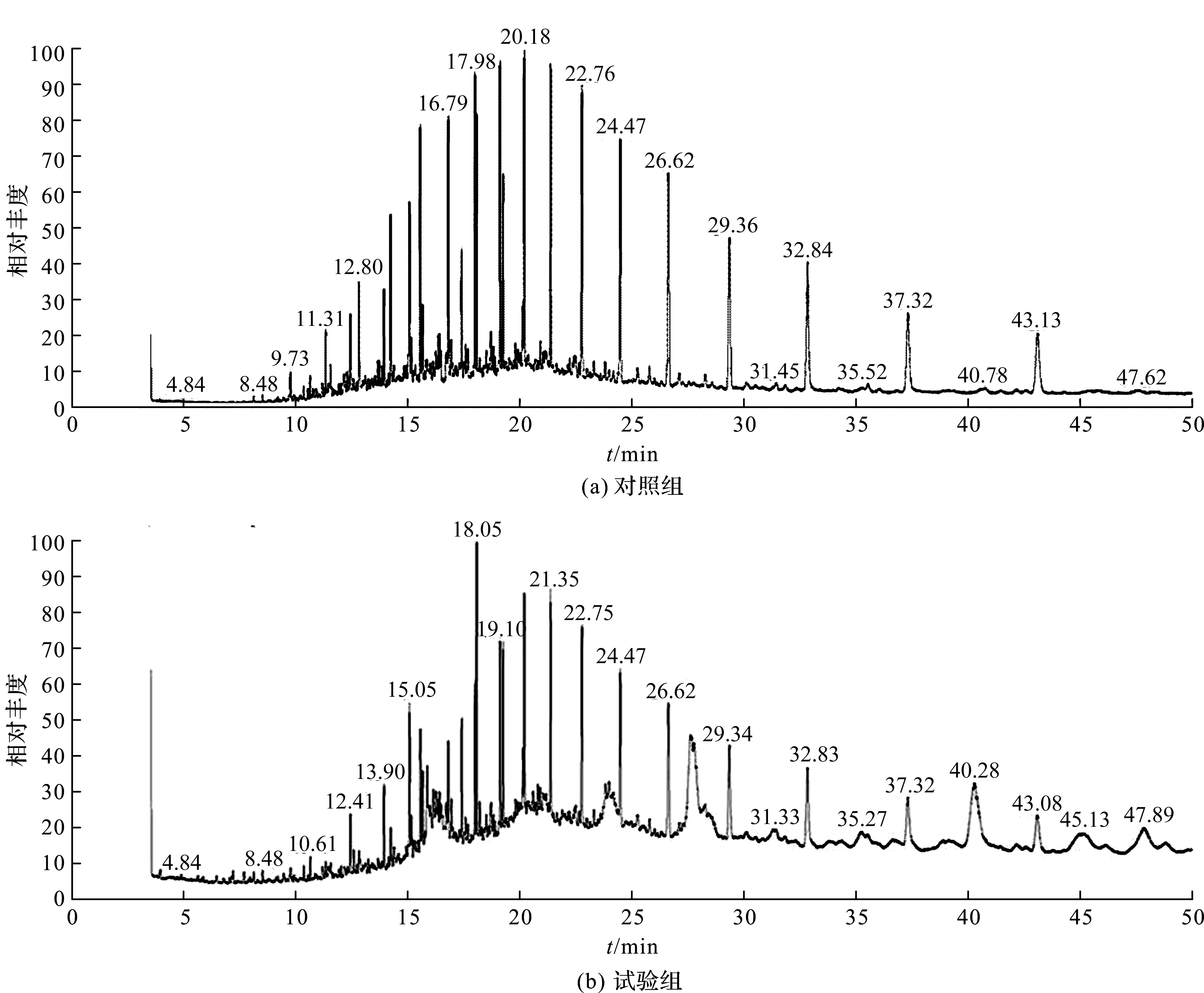
图7 石油GC谱图Fig.7 GC map of petroleum
如图7所示,菌株XS -2降解的石油组分在保留时间为12.80、13.91、14.21、16.79、43.12 min的波峰均出现空白缺失,这说明菌株XS -2对碳数为14、15、16和17的正构烷烃有很好的降解效果;保留时间为43.12 min的波峰缺失,但是多出保留时间为40.29 min峰面积相似的波峰,这可能是菌株XS -2将保留时间为43.12 min的物质进行了降解,具体机理有待进一步试验验证。
2.4 石油降解菌XS -2降解条件优化
2.4.1 培养温度对菌株XS -2石油降解性能的影响
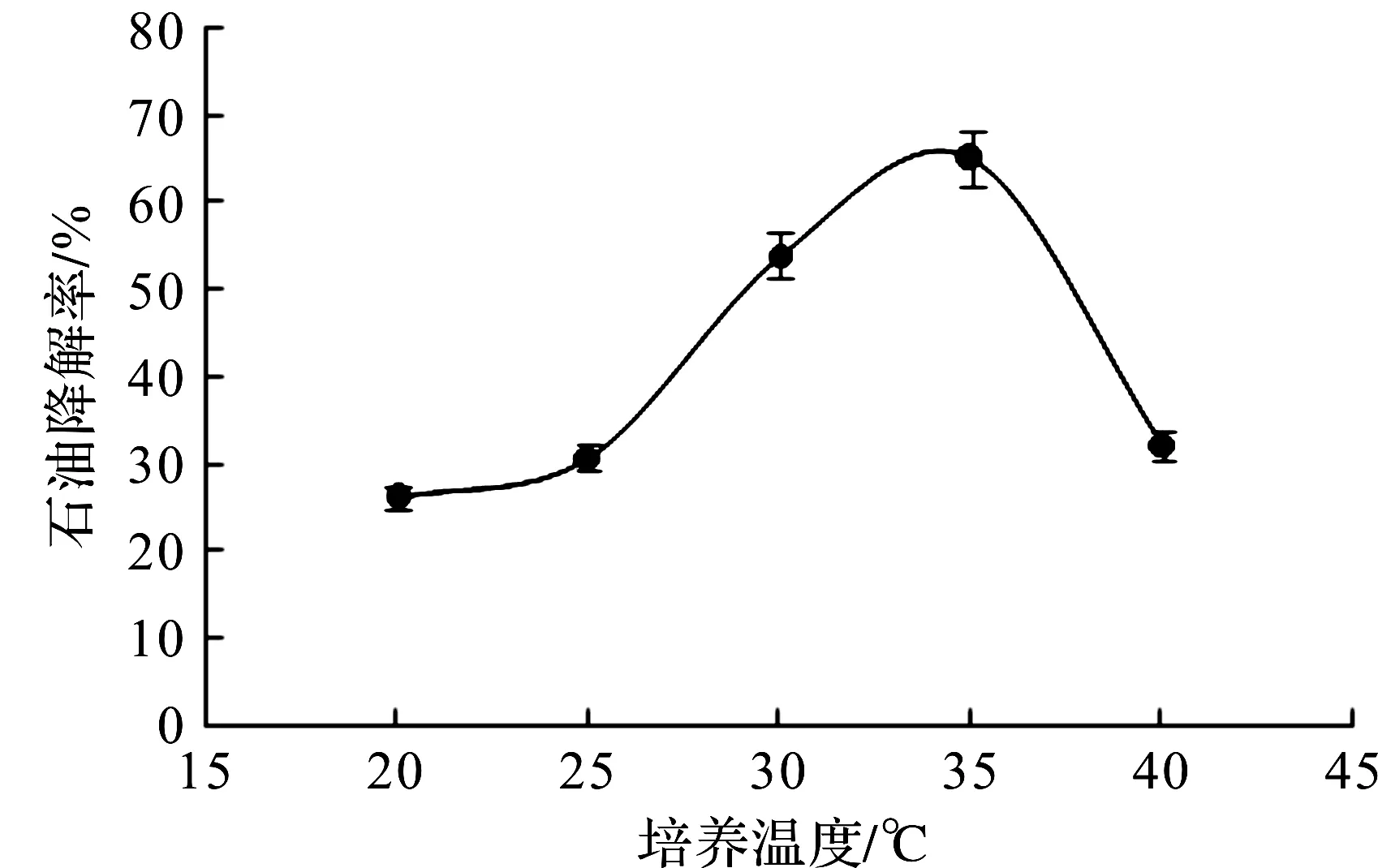
图8 培养温度对降解性能的影响Fig.8 Effect of culture temperature on degradation rate
培养温度与微生物的生长繁殖、代谢活性有密切关系[12-14]。如图8所示,20~25 ℃,第7天石油降解率为30%~40%,降解率相对较低。其原因是温度较低时,细菌代谢能力受到限制,导致其代谢产物活性较低,对石油降解性能不高。随着培养温度的升高,石油降解效率显著提高,在35 ℃时达到最大值,降解率为65.13%;之后随着温度的升高降解效果明显呈下降趋势。
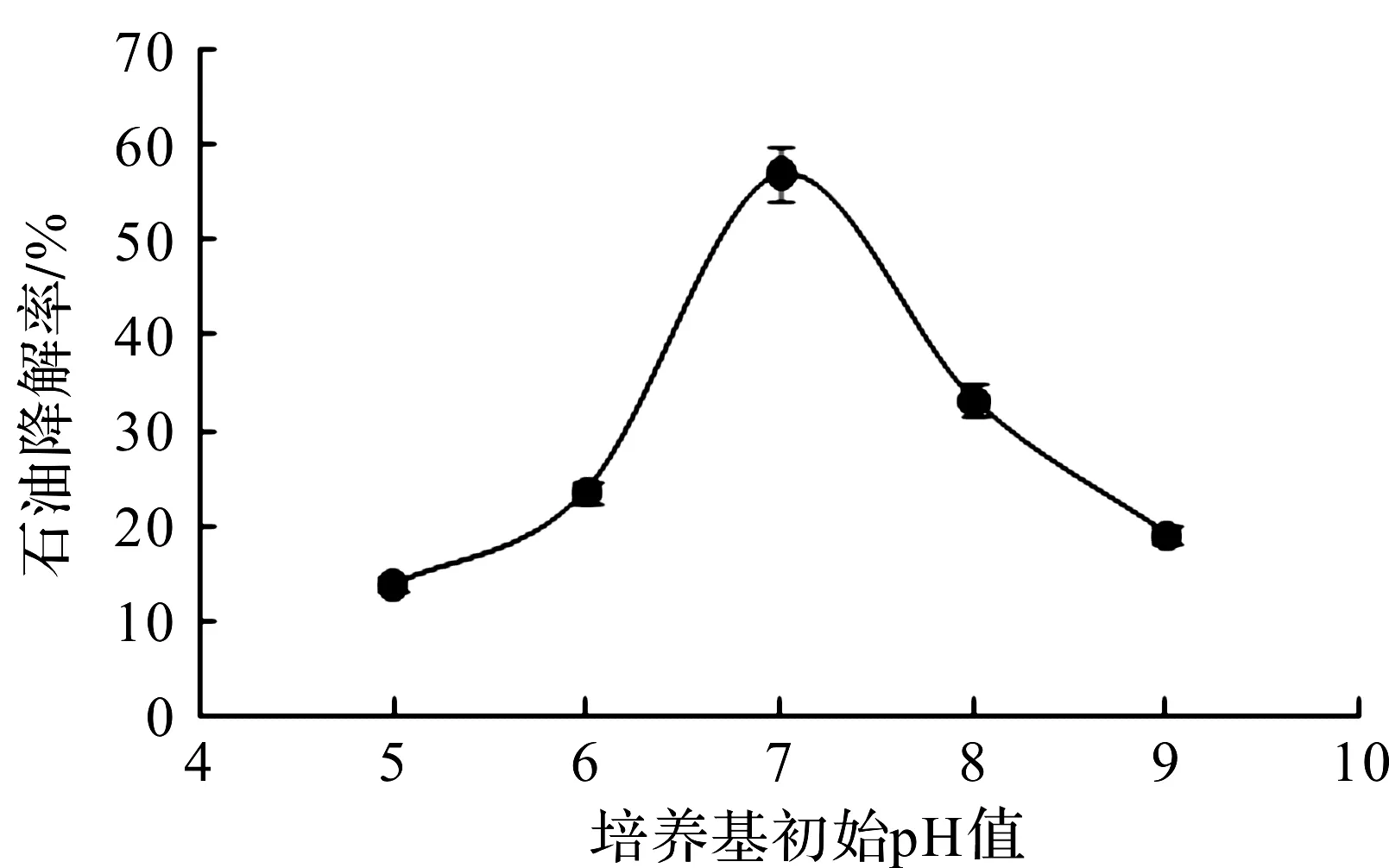
图9 培养基初始pH对降解性能的影响Fig.9 Effect of initial pH value on degradation rate
在35 ℃时降解效率最高,这与菌株最佳培养温度不完全一致,其原因是微生物对石油烃的降解,主要借助酶的催化作用,如环烷烃一般先被各种氧化酶氧化为醇,然后通过脱氢酶转化为酮,最后再被氧化为酯酶或脂肪酸,而酶的活性只有在一定温度范围内才能得以发挥[15],所以石油降解温度与菌株XS -2的最适培养温度略有差异。
2.4.2 培养基初始pH对菌株XS -2石油降解性能的影响
pH过高或过低对微生物生长代谢都是不利的。如图9所示,pH值在5.0~7.0之间,菌株XS -2在第7天对石油的降解率呈上升趋势。在pH值为7.0时降解率最高达60%;之后,随着pH升高,石油降解率明显下降。这与申圆圆的研究结果一致[16]。初始pH可以影响微生物细胞内的酶活性,进而影响其生物化学过程。因此,菌株XS -2降解石油的最佳pH值为7.0。
2.4.3 石油质量浓度对菌株XS -2石油降解性能的影响
石油作为微生物生长代谢底物,其质量浓度的高低对微生物降解性能有一定的影响。由图10可知,随着石油质量浓度的升高,菌株XS -2对石油降解率呈先上升后下降的趋势,当石油质量浓度为5 g/L时,第7天降解率最高为65%。

图10 石油质量浓度对石油降解性能的影响Fig.10 Effect of petroleum mass concentration on degradation rate
石油质量浓度较低时,菌株生长底物不足,导致细菌生长缓慢,石油降解率较低,该现象与朱杰等[1]的研究结果一致。随着石油质量浓度增加,底物充足,菌株生长代谢能力旺盛,其降解率也随之提高。但并不是石油质量浓度越高越好,当石油质量质量浓度过高时,底物碳氮比失调,菌株生长受到抑制,进而使微生物对石油降解的效果显著下降。
3 结 语
微生物修复无残毒、低成本、见效快,成为解决石油污染的有效途径。本试验从石油污染的土壤样品中分离到高效石油降解菌XS -2,以石油作为唯一碳源,能有效快速地清除瓶壁上的油污,使得培养基中的石油形成油水混合物,这说明它能够快速将大分子的石油烃降解,在石油污染领域开展生物修复有较高的研究价值和较好的应用前景。经菌体及菌落形态、生理生化特性和16S rRNA基因序列同源性分析,鉴定菌株XS -2为赤红球菌。
微生物作为环境修复的主体,其降解效率决定修复水平[17]。因此分别对菌株XS -2的培养温度、培养初始pH和石油质量浓度进行优化,确定在培养温度30 ℃、初始培养pH值7.0、石油质量浓度5 g/L时,赤红球菌XS -2对石油的降解率最高达到65%。经GC分析,该菌可有效降解碳原子数量为14、15、16、17的烷烃。赤红球菌XS -2对石油的降解机理以及具体效果还有待进一步深入研究。

