PMA-qPCR方法检测陕西猕猴桃溃疡菌优势病原菌活菌的研究
肖 妍 刘芸宏 高贵田,2 曹 凡 马燕萍 赵武奇 雷玉山
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710119;2.陕西省猕猴桃工程技术研究中心,陕西 西安 710404;3.陕西省农村科技开发中心,陕西 西安 710054)
猕猴桃溃疡病是由丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa)引起的细菌性病害[1],严重影响猕猴桃产业的发展。目前,该病菌的检测主要采用PCR技术,但是常规的PCR技术不能区分样品中病原菌的生活状态,在对活菌DNA进行扩增的同时,也会扩增自由状态的DNA或者死菌的DNA[2],检测产生假阳性,无法确定Psa的生活状态,无法对溃疡病的发生趋势作出科学预测,也无法对消毒、防治效果做出科学判断。
叠氮溴化丙锭(propidium monoazide,PMA)是一种能和DNA共价交联的荧光染料。PMA可以通过死菌损伤的细胞膜进入死菌细胞,并且光照可使PMA的光敏基团转化为氮宾自由基,与死菌DNA发生共价交联,从而抑制后续DNA扩增[3-6];活菌细胞膜完整,PMA不能进入细胞内;剩下的少量游离在溶液中的PMA则可与溶液中的水分子结合形成羟胺(—NH—OH),失去与DNA结合的活性;PMA-qPCR技术就是利用这一特性,实现了只扩增活细胞的DNA,而不扩增死细胞的DNA[4]。
近年来,PMA-qPCR技术已被广泛应用于多种微生物活死菌的鉴别检测[7],但该技术用于鉴别陕西猕猴桃溃疡菌优势病原菌仍鲜见报道。于小龙等[8]建立的PMA-qPCR方法,能有效对包括VBNC状态在内的青枯菌活菌进行检测;温书香等[9]通过优化PMA处理条件,实现了对结核杆菌活菌的快速检测;於颖等[10]在PMA浓度30 μg/mL下,曝光5 min,可实现对金黄色葡萄球菌活菌筛选的作用。
世界Psa主要分为三大类群,中国流行的猕猴桃溃疡病的Psa与最近在意大利、新西兰、西班牙、法国、葡萄牙等国流行的Psa为同一类群[11]。由于其同属的Pseudomonassyringaepv.theae和Pseudomonasavellanae与Psa的亲缘关系非常近,常规的分子标记技术很难将它们区分开[12]。Gallelli等[13]根据猕猴桃溃疡菌的hrpW基因保守区,设计P3F/P5R1引物,不仅能区分Pseudomonassyringaepv.theae和Pseudomonasavellanae,也可以准确区分出强致病力菌株(Psa-V)与弱致病力菌株,朱丹等[14]克隆了陕西猕猴桃优势Psa的hrpW基因保守区,其序列与Psa-V同源性为99%。
因此本研究拟利用陕西猕猴桃优势Psa的hrpW的P3F/P5R1为引物,建立PMA-qPCR检测方法,研究PMA浓度、暗孵育时间及曝光时间等对Psa扩增的影响,并将死菌和活菌按一定的比例混合,对PMA-qPCR方法在实际检测中的可行性进行分析。为陕西猕猴桃溃疡病的快速检测、准确诊断及病情预测提供参考。
1 材料和方法
1.1 材料与仪器
丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa):为陕西猕猴桃溃疡病优势病原菌[15],西北农林科技大学植保学院黄丽丽教授惠赠;
PMA:美国Biotium公司;
Psa质粒标准品:生工生物工程(上海)股份有限公司;
Ezup柱式基因组DNA抽提试剂盒、即用PCR扩增试剂盒:上海生工生物工程有限公司;
SYBR Green I试剂盒:天根生化科技有限公司;
卤素灯:500 W,飞利浦灯具有限公司。
1.2 方法
1.2.1 Psa菌悬液的制备 挑取Psa单菌落于King’s B液体培养基,24 ℃、190 r/min恒温震荡12 h,无菌水调节菌悬液浓度为1×107CFU/mL。
1.2.2 Psa菌膜损伤时间的确定 吸取500 μL菌悬液于1.5 mL的离心管中,沸水浴(98.3 ℃)分别处理10,11,12,13,14,15 min后立即在冰上冷却至室温,对照组未经沸水浴处理。吸取100 μL涂布于King’s B固体培养基上,24 ℃培养,3 d后统计单菌落数,无菌落生长视为全部是死菌,该时间为膜损伤菌的处理时间。
1.2.3 DNA提取 吸取500 μL菌液,8 000 r/min离心2 min 弃上清,按照DNA Ezup柱式基因组DNA抽提试剂盒的说明书提取DNA。
1.2.4 qPCR检测 qPCR引物根据Gallelli等[13],修改如下,引物序列为:GGTTTCGGACACCGCAGGTTCTACCGAG和CTTCCTGATCCCCGTTACCCATCGA-C,由生工生物工程(上海)股份有限公司合成。反应总体系为10 μL,DNA模板1.0 μL,SYBR PCR premix 5.0 μL,引物P3F、P5R1各0.6 μL,ddH2O补足至反应总体积。反应程序为95 ℃预变性10 min,95 ℃变性10 s,72 ℃退火20 s,30个循环,72 ℃延伸20 s。
1.2.5 PMA处理的条件
(1)PMA工作液的制备:1 mg PMA于8 000 r/min离心2 min,加入20%二甲基亚砜(DMSO)溶液200 μL充分溶解,得到5 μg/μL PMA储备液,于-20 ℃避光保存。
(2)抑制死菌扩增的PMA最小浓度:分别吸取6份膜损伤的死菌悬液500 μL于1.5 mL离心管,加入PMA,使PMA的终浓度分别为0,90,95,100,105,110 μg/mL,颠倒混匀,暗孵育8 min,将样品置于冰上,离心管口朝上,置于距样品20 cm的500 W卤素灯下,曝光处理20 min,提取样品DNA,用qPCR检测,从而确定能够完全抑制死菌扩增的PMA最小浓度。
(3)不影响活菌扩增的PMA最大浓度:吸取4份活菌悬液500 μL于1.5 mL离心管中,加入PMA,使PMA的终浓度分别为0,105,110,120 μg/mL,颠倒混匀,暗孵育8 min,将样品置于冰上,离心管口朝上,置于距样品20 cm 的500 W卤素灯下,曝光处理20 min,提取样品DNA,用qPCR分别检测,研究不抑制活菌扩增的PMA最大浓度。
(4)暗孵育时间的优化:分别吸取5份膜损伤的死菌悬液500 μL于1.5 mL离心管,加入确定的最佳PMA工作液浓度,分别暗孵育5,6,7,8,9,10 min,将样品置于冰上,离心管口朝上,置于距样品20 cm的500 W卤素灯下,曝光处理20 min,未加PMA的样品作为阳性对照,提取DNA,用qPCR检测,研究完全抑制死菌扩增的最佳暗孵育时间。
(5)曝光时间的优化:分别吸取6份膜损伤的死菌悬液500 μL于1.5 mL离心管,用确定的最佳PMA工作液浓度和最佳暗孵育时间进行处理,将样品置于冰上,离心管口朝上,置于距样品20 cm的500 W卤素灯下,分别曝光处理5,10,15,20,25 min,未加PMA的样品作为阳性对照,确定能够完全抑制死菌扩增的最佳曝光时间。
(6)PMA对不同比例活菌/死菌样品的检测效果:将培养至107CFU/mL的活菌和死菌按照表1进行混合,经合适条件的PMA处理提取DNA,进行PMA-qPCR反应,以未加PMA处理的样品作为对照。
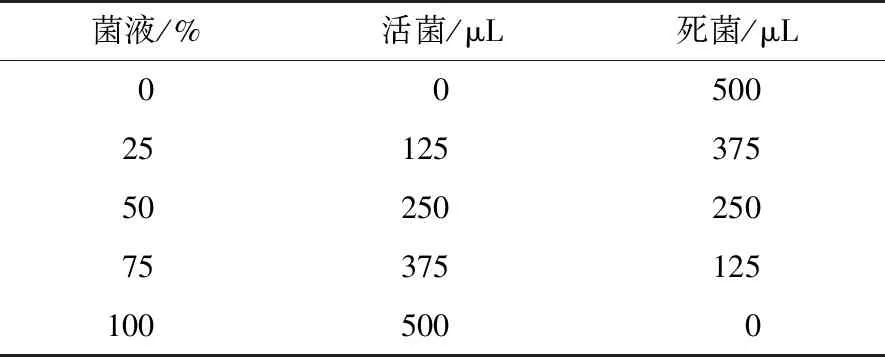
表1 不同比例的活死菌样品Table 1 Proportion of different live and dead bacteria
1.2.6 标准曲线的建立 取已知浓度的Psa质粒标准品(由生工生物工程〔上海〕股份有限公司完成),根据式(1)换算成基因拷贝数。
(1)
式中:
A——质粒DNA拷贝数,拷贝/μL;
C——DNA浓度,ng/μL;
M——片段大小;
NA——阿伏伽德罗常数,6.02×1023。
将Psa质粒标准品10倍梯度稀释至101,进行荧光定量PCR反应,以拷贝数对数值和所得Ct值为横、纵坐标建立标准曲线。
1.2.7 PMA-qPCR的灵敏度 菌液10倍梯度稀释至101,经合适条件的PMA处理提取DNA,进行PMA-qPCR的灵敏度分析。
1.2.8 猕猴桃枝条样品活菌检测
(1)枝条样品的染菌:取无菌的猕猴桃枝条,切成25 g 的小块,碾碎后放入无菌均质杯中,加入225 mL无菌水,8 000 r/min均质2 min,制成样品匀液。分别加入101~107CFU/mL的溃疡菌活菌悬液,作为人工染菌的样品。
(2)采用合适条件的PMA处理提取DNA,进行PMA-qPCR检测,根据标准曲线得到基因拷贝数,与平板计数的结果进行比较。
1.2.9 数据分析 采用DPS 7.05对试验数据进行显著性差异检验,P<0.05表示具有显著性差异。
2 结果与分析
2.1 Psa膜损伤时间的确定
本试验采用食品上较常使用的高温灭菌方式制备死菌悬液[16]。菌悬液浓度为1×107CFU/mL,热处理不同时间,稀释一定浓度后涂布,24 ℃培养3 d,计数结果如表2 所示,热处理时间越长,对活菌的灭活效率越高,当膜损伤时间为13 min时,无菌落生长,因此,以13 min的沸水浴处理作为活菌的全部致死时间。
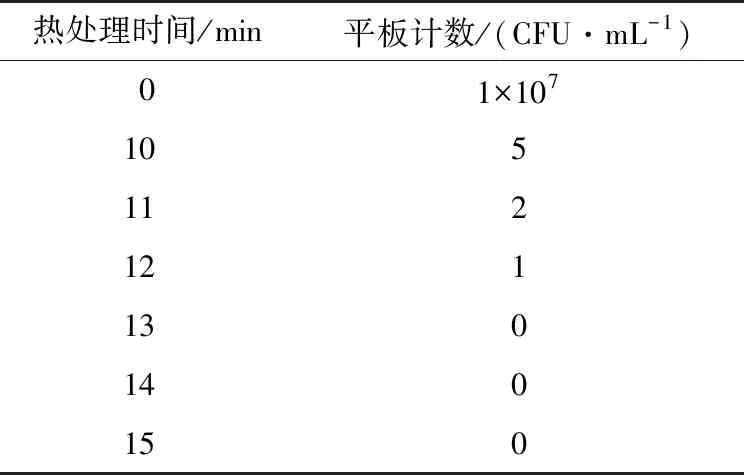
表2 时间对菌液灭活效率的影响Table 2 Effect of heat-treatment time on sterilizing rate
2.2 PMA处理条件的确定
2.2.1 PMA浓度的优化
(1)抑制死菌扩增的PMA最小浓度:由图1可知,随着PMA浓度的增大,Ct值逐渐增大,PMA的浓度为100 μg/mL时,Ct值增大比较小,当PMA浓度为105 μg/mL 时,对死菌DNA扩增抑制达到最大,PMA浓度为110 μg/mL时,Ct值几乎无变化,与PMA浓度为105 μg/mL相比,无显著性差异(P>0.05),因此,确定抑制死菌DNA扩增最小PMA浓度为105 μg/mL。
PMA是一种能和死菌DNA共价交联的荧光染料,活菌的完整细胞膜可阻止PMA进入,从而达到检测活菌效果。但是,PMA浓度过高可能对活菌的细胞产生影响,导致假阴性的检测结果[17]。赵丽青等[18]在PMA浓度2 μg/mL下,500 W卤素灯曝光15 min可达到检测金黄色葡萄球菌活菌的目的。曹梦琪等[19]在PMA浓度15 μg/mL 下,650 W卤钨灯曝光5 min,可达到检测青枯菌活菌的目的。於颖等[10]在PMA浓度30 μg/mL下,650 W卤素灯曝光5 min可达到筛选金黄色葡萄球菌活菌的作用,并且试验中的菌悬液浓度均在108CFU/mL。本研究得到的Psa的最佳PMA浓度为105 μg/mL,菌悬液浓度为107CFU/mL。细菌的细胞膜差异很大,革兰氏阴性菌比革兰氏阳性菌的细胞壁与细胞膜薄,对PMA的通透性好[20],PMA使用浓度应该较低,但本研究得到的Psa的最佳PMA浓度与已有文献相差较大,可能与陕西猕猴桃优势病原菌本身对外界环境的抵抗能力有关,其对PMA产生抵抗的详细机理还需更深层次的探究。
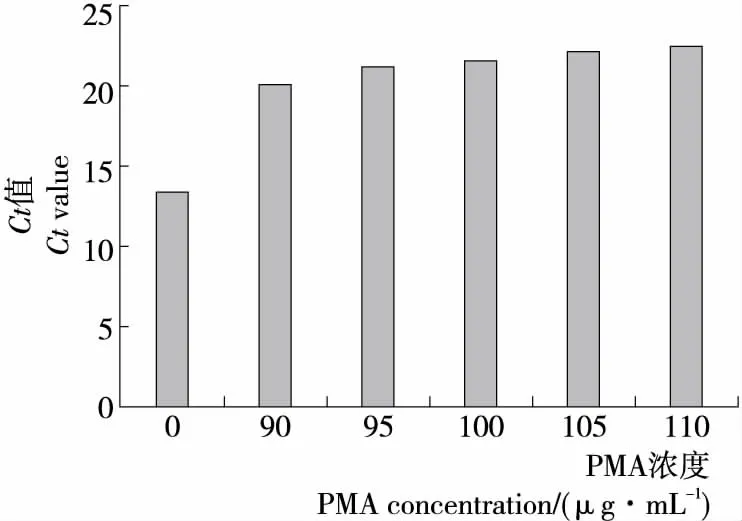
图1 PMA浓度对膜损伤菌的影响Figure 1 Effect of PMA concentration on heat-treated bacteria
(2)不影响活菌扩增的PMA最大浓度:由图2可知,活菌DNA的Ct值随PMA浓度的增大而增大,PMA浓度为105 μg/mL时,与未加PMA的Ct值无显著性差异(P>0.05),说明此浓度不会对活菌DNA的扩增产生较大影响,但是当PMA使用浓度>105 μg/mL时,与未加PMA的Ct值有显著性差异(P<0.05),说明PMA浓度>105 μg/mL对活菌有一定的影响,因此,选择PMA浓度为105 μg/mL作为不影响活菌扩增的PMA最大浓度。
2.2.2 暗孵育时间的确定 由图3可知,随着暗孵育时间的延长,Ct值逐渐增大,暗孵育时间为7 min,Ct值增大比较小,当暗孵育时间延长至8 min,对死菌DNA扩增抑制达到最大,暗孵育时间>8 min,Ct值几乎无变化,与暗孵育时间8 min相比,无显著性差异(P>0.05),8 min 的暗孵育时间可完全抑制死菌DNA扩增,因此确定最佳的暗孵育时间为8 min。
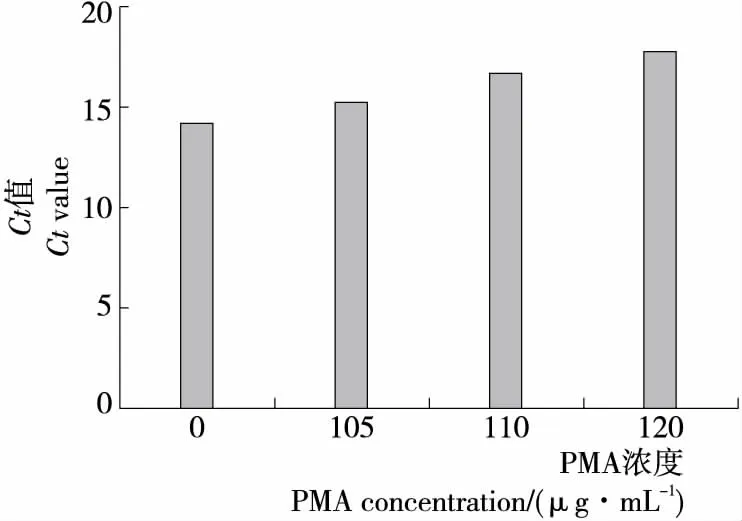
图2 PMA浓度对活菌的影响Figure 2 Effect of PMA concentration on live bacteria
抑制膜损伤菌DNA扩增除PMA浓度外,最佳的暗孵育时间也至关重要。PMA在光照条件下,与水分子结合生成羟胺,羟胺不能和DNA分子结合,从而无法抑制死菌的DNA,因此,在样品中加入PMA要避光处理合适的时间,而暗孵育时间的长短受样品菌浓度、PMA浓度、细胞膜结构等因素影响。结果表明,8 min的暗孵育时间可充分使PMA与DNA结合,曝光处理后与DNA结合形成不可逆的共价交联结构,抑制死菌DNA扩增。未与DNA结合的PMA曝光时可与水分子反应生成羟胺而失去活性[21-22]。
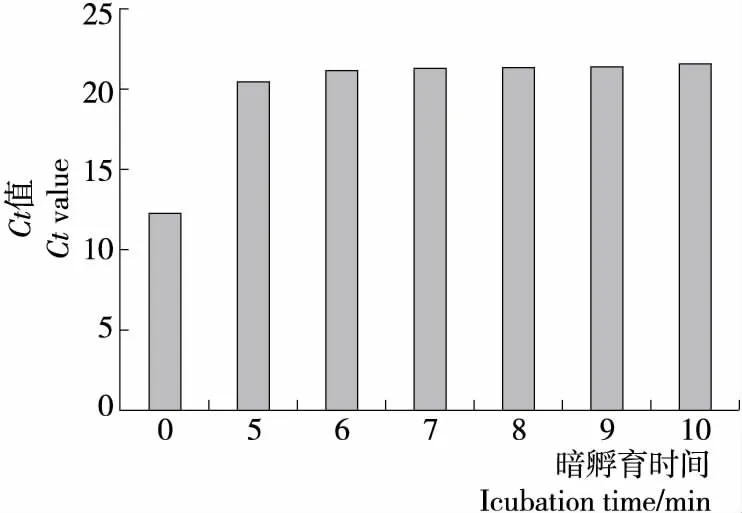
图3 暗孵育时间对膜损伤菌的影响Figure 3 Effect of incubation time on heat-treated bacteria
2.2.3 曝光时间的确定 由图4可知,随着曝光时间的延长,Ct值逐渐增大,曝光时间为15 min,Ct值增大比较小,当曝光时间延长至20 min,对死菌DNA扩增抑制达到最大,曝光时间为25 min,Ct值几乎无变化,与曝光时间20 min相比,无显著性差异(P>0.05)。因此,20 min 的曝光时间可完全抑制死菌DNA扩增,确定最佳的曝光时间为20 min。

图4 曝光时间对膜损伤菌的影响Figure 4 Effect of light exposure time on heat-treated bacteria
曝光时间是影响活菌检测的另一个重要因素,光照时间不充分,PMA不能完全被钝化,部分残留在菌悬液中,提取DNA时,活细胞的细胞膜被破坏,暴露出的DNA被PMA分子结合,使检测结果出现假阴性。卤钨灯的选择也会影响到曝光的时间,650 W卤钨灯虽然能降低耗时,但同时会产生大量的热量,有可能造成管口附近菌体的死亡。所以本研究选用500 W的卤钨灯距离20 cm,曝光20 min,一方面使与DNA结合的PMA与DNA分子进一步充分交联,同时使游离的PMA完全被钝化。
2.2.4 PMA对不同比例活菌和膜损伤菌影响 PMA对不同比例活菌和死菌的影响如表3所示,当样品全部为死菌时(活菌比例0%),未加PMA处理的Ct值为16.21,加PMA处理后Ct值为23.28,差异极显著(P<0.01),活菌的比例为25%,50%,75%,未加PMA处理的样品Ct值明显低于加入PMA样品的Ct值,说明PMA有抑制死菌DNA扩增的作用。当样品中活菌比例达到100%时,未加PMA样品的Ct值与加入PMA处理样品的Ct值无显著性差异(P>0.05),说明加入的PMA对活菌的扩增几乎无影响。同时,活菌比例的增大导致Ct值相应的减少,说明经PMA处理后死菌DNA被PMA抑制不能扩增,可以消除死菌对PCR的扩增,降低假阳性结果出现的可能性。

表3 不同比例活菌样品PMA-qPCR结果†Table 3 PMA-qPCR Results of different live bacteria proportion
† △Ct=PMA处理组-对照组。
2.3 质粒标准品的制备及标准曲线的建立
质粒标准品初始拷贝数为6.39×108拷贝/μL。将其进行10倍梯度稀释,使浓度范围在1×101~1×108拷贝/μL。以拷贝数对数值和所得Ct值为横、纵坐标建立标准曲线,见图5。可以看出两者存在对应线性关系,r2=0.995 5,斜率为-3.220 4,该方法最低能够检出6.39×102拷贝/μL的溃疡菌。
2.4 PMA-qPCR的灵敏度
菌液10倍梯度稀释至101,102,103,104,105,106,107,经合适条件的PMA处理提取DNA,进行PMA-qPCR反应。根据标准曲线得到定量结果见表4,PMA-qPCR方法最低可检出2.38×102拷贝/μL的溃疡菌见图6。
2.5 猕猴桃枝条样品活菌检测
染菌样品经PMA处理提取DNA,进行PMA-qPCR检测,根据标准曲线得到基因拷贝数,与平板计数的结果进行比较,显示两者无显著性差异(P>0.05)(表5)。
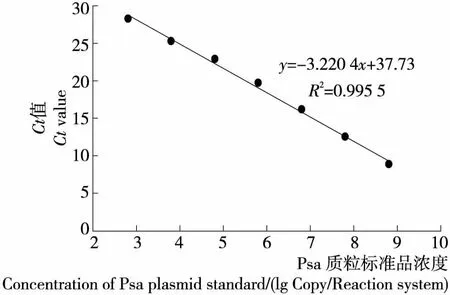
图5 Psa质粒标准曲线Figure 5 Plasmid standard curve
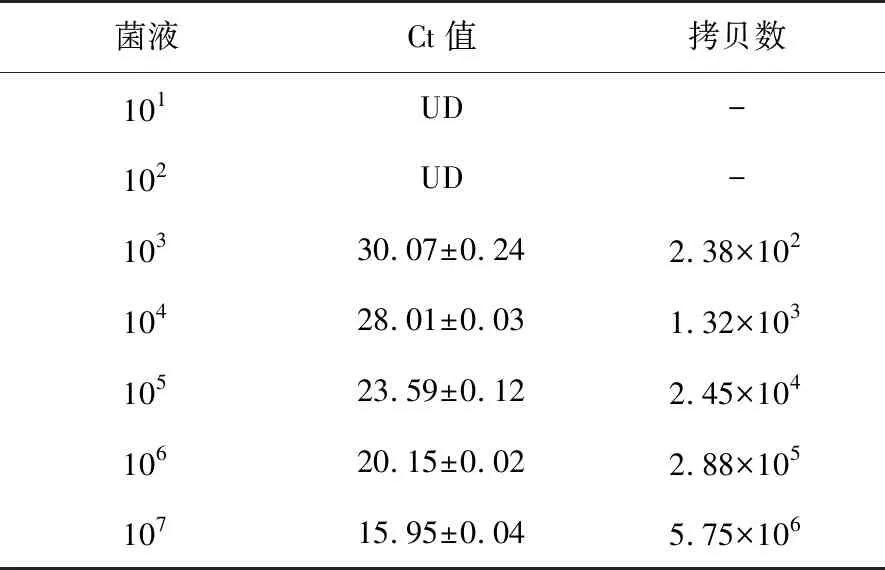
表4 不同稀释梯度菌液的PMA-qPCR结果†Table 4 PMA-qPCR results of different dilution bacteria
† UD表示未测得。
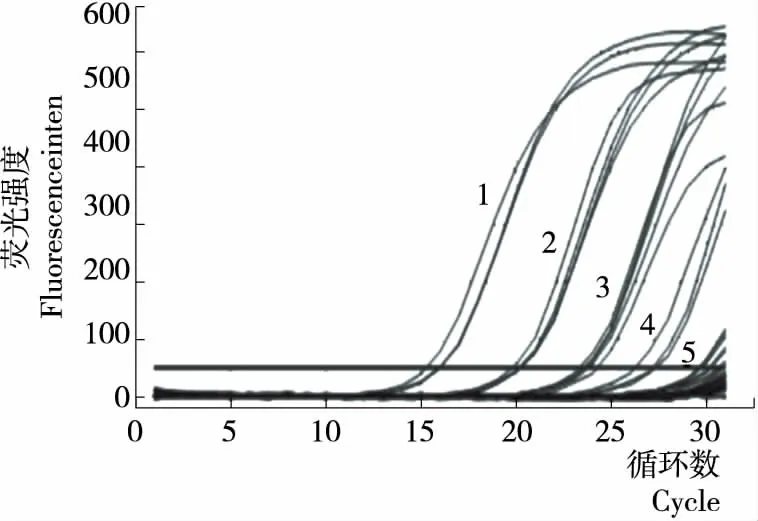
1~5分别为稀释至107,106,105,104,103的菌悬液扩增曲线,最低可检出2.38×102拷贝/μL的溃疡菌
图6 PMA-qPCR灵敏度分析
Figure 6 PMA-qPCR sensitivity analysis
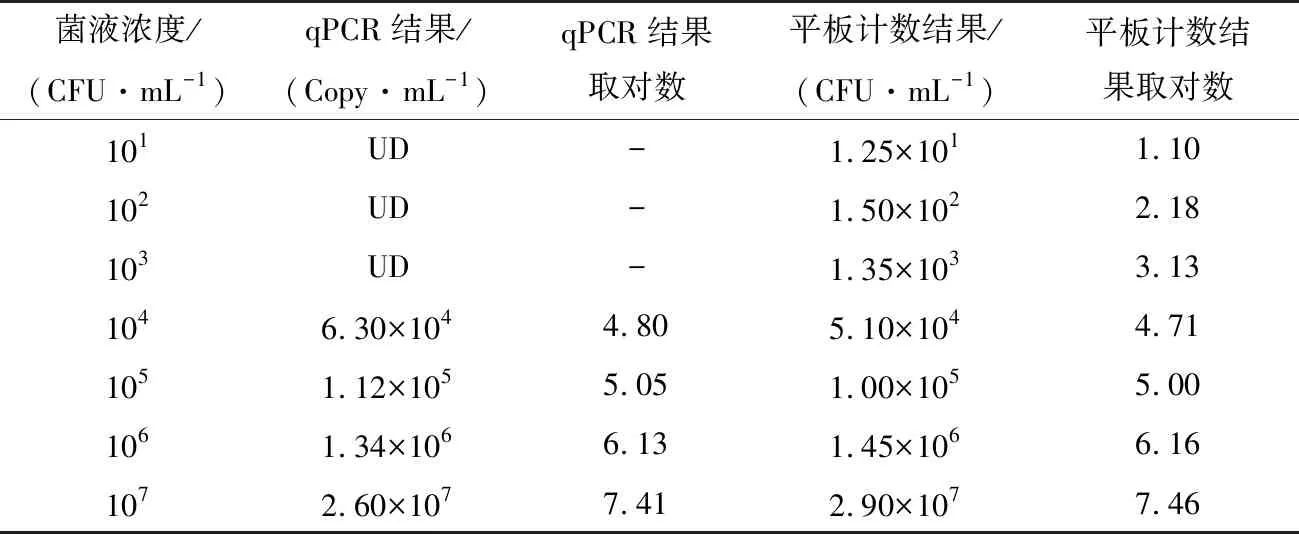
表5 染菌样品PMA-qPCR结果与平板计数结果比较†Table 5 Compare results of PMA-qPCR with plate count
† UD表示未测得。
3 结论
本试验以猕猴桃溃疡菌为研究对象,通过优化PMA处理条件,实现检测陕西猕猴桃溃疡病优势病原菌活菌的目的。结果表明,PMA与死菌共价交联的最佳浓度为105 μg/mL,最佳暗孵育时间为8 min,最佳曝光时间为20 min,在此条件下,Psa死菌扩增被抑制,而活菌的扩增未受影响。同时,虽然优化后的PMA浓度对活菌的扩增未产生影响,但是该浓度相对此类文献而言还是偏高,所以对于陕西猕猴桃溃疡病优势病原菌是否对PMA具有更强的抵抗力,还需要进一步研究。

