弥罗松酚在大鼠脑核团内的分布
邵敏芳,曹桂云,范 瑛∗
(1.苏州大学附属第二医院,江苏 苏州 215000;2.山东宏济堂制药集团股份有限公司,山东 济南 250000)
弥罗松酚是从唇形科(如丹参、绒毛栗色鼠尾草、轮叶婆婆纳、淡黄香茶菜)或松柏纲(如日本雪松、罗汉松、香榧、侧柏叶)植物中分离得到的松香烷型三环二萜类化合物,具有多种生物活性,如抗菌[1]、抗氧化[2]、抗癌[3]、抗疟[4]、保肝[5]、胃肠保护作用[6],课题组前期研究表明静脉给药后该成分可快速进入脑组织进行分布,具有抗帕金森活性,但在脑核团内分布的动力学变化尚不明确,这对治疗脑部疾病具有重要的意义。因此,本实验对弥罗松酚的脑核团分布进行了研究。
1 材料
1.1 仪器 Agilent 1260 高效液相色谱仪(美国Agilent 公司),配置手动进样器、四元梯度泵、DAD 检测器;MIKRO 22R 台式冷冻离心机(德国Hettich 公司);FSH 匀浆机(常州恒隆仪器有限公司)。
1.2 试药 弥罗松酚由本实验室从绒毛栗色鼠尾草中分离得到,其结构经 HPLC、MS 法确认,含有量>98%。乙腈为色谱纯(国药集团化学试剂有限公司);水为娃哈哈纯净水(杭州娃哈哈集团有限公司)。
1.3 动物 雄性 Wistar 大鼠,体质量 230~250 g,购自扬州大学比较医学中心,动物生产许可证号SYXK(苏)2012-0029,置于(22±1)℃控温、光暗周期12 h 环境下,清洁级普通大鼠饲料饲养。实验前12 h 禁食不禁水。
2 方法
2.1 对照品溶液制备 精密称取弥罗松酚对照品2.00 mg,甲醇制成 1.0 mg/mL 贮备液,再稀释成系列质量浓度,即得,密封,置于 4 ℃ 冰箱中备用。
2.2 分组、给药及采样 60 只大鼠随机分为6组,其中 1 组为空白组,另外 5 组为给药组,按40 mg/kg 剂量尾静脉注射给药(溶于蓖麻油-乙醇-水溶液中,比例为 4 ∶10 ∶86),空白组给予相同剂量蓖麻油-乙醇-水溶液。各组于给药 8、23、45、60、70 min 后处死大鼠,冰盒上迅速取脑并分离海马、纹状体、丘脑、下丘脑、大脑皮层、小脑,-20 ℃下冷冻备用。
2.3 样品预处理 精密称取各脑核团组织,加入2 倍量生理盐水匀浆,匀浆液加入2 倍量乙酸乙酯后涡旋混合 1 min,4 ℃、8 000×g下离心 10 min,取上清液,重复操作 2 次,合并有机相,45 ℃下N2吹干,残渣溶于 100 μL 甲醇中,0.45 μm 微孔滤膜过滤。
2.4 色谱条件 YMC ODS C18色谱柱;流动相乙腈-水(85 ∶15);体积流量 0.8 mL/min;柱温25 ℃;检测波长 220 nm;进样量 20 μL。
2.5 方法学考察
2.5.1 线性关系考察和专属性试验 取新鲜空白脑核团匀浆液,加入适量弥罗松酚贮备液,精密配制系列标准曲线,每条设 6 个质量浓度点,按“2.3”项下方法处理后在 “2.4”项色谱条件下进样测定。以弥罗松酚质量浓度为横坐标(X),其峰面积为纵坐标(Y),加权最小二乘法进行回归,权重系数为1/x2,以相关系数r来评价相关性。
2.5.2 最低检测限(LLOD)、最低定量限(LLOQ)测定 取新鲜空白脑核团匀浆液,加入适量弥罗松酚贮备液,配制成标准曲线末端质量浓度,并逐渐降低,分别以检测成分信号与噪音信号比 3 ∶1、10 ∶1 时的质量浓度为 LLOD、LLOQ。
2.5.3 准确度、精密度试验 取新鲜空白脑核团匀浆液,加入适量弥罗松酚贮备液,配制成高、中、低 3 个质量浓度,平行 3 份,按 “2.3”项下方法处理后在 “2.4”项色谱条件下进样测定,每个质量浓度同1 d 内连续进样3 次测定峰面积,计算平均值和日内精密度;每个样品连续3 d 各进样1 次测定峰面积,计算平均值和日间精密度。
2.5.4 萃取回收率试验 取新鲜空白脑核团匀浆液,加入适量弥罗松酚贮备液,配制成高、中、低3 个质量浓度,平行 3 份,按 “2.3”项下方法处理后在 “2.4”项色谱条件下进样测定。
2.5.5 稳定性试验 取新鲜空白脑核团匀浆液,加入适量弥罗松酚贮备液,配制成高、中、低3 个质量浓度,平行3 份,将组织液置于-20 ℃冰箱中冷冻 24 h 后室温下放置 1 h 解冻,重复 3 次,按“2.3”项下方法处理后,在 “2.4”项色谱条件下进样测定。
3 结果
3.1 弥罗松酚波谱数据 白色固体,ESI-MSm/z:287.2[M +H]+,分子式 C20H30O。1H-NMR(600 MHz,CDCl3)δ:6.83(1H,s,H-14),6.61(1H,s,H-11),3.14(1H,sept,J= 6.6 Hz,H-15),2.84(1H,m,H-7β),2.77(1H,m,H-7α),2.09(1H,m),1.84(1H,m),1.67(2H,m),1.56(1H,m),1.46(1H,m),1.32(2H,m),1.23(3H,d,J=6.6 Hz,17-CH3),1.22(3H,d,J=6.6 Hz,16-CH3),1.14(3H,s,20-CH3),0.94(3H,s,19-CH3),0.91(3H,s,18-CH3);13C-NMR(150 MHz,CDCl3)δ:150.7(C-12),148.7(C-9),131.6(C-13),127.3(C-8),126.4(C-14),111.1(C-11),50.4(C-5),41.8(C-3),38.9(C-1),37.5(C-10),33.5(C-4),33.4(C-18),29.8(C-7),26.8(C-15),24.8(C-20),22.9(C-17),22.7(C-16),21.7(C-19),19.4(C-2),19.3(C-6)。以上数据与文献[7]报道基本一致,故鉴定为弥罗松酚。
3.2 方法学考察
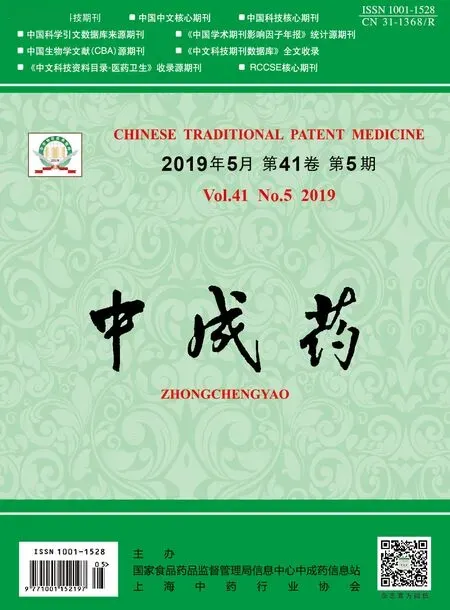
3.2.1 专属性试验 图1显示,在 “2.4”项色谱条件下弥罗松酚保留时间为11.4 min,内源性物质对其无干扰,方法专属性良好。
图1 弥罗松酚HPLC 色谱图Fig.1 HPLC chromatograms of ferruginol
3.2.2 线性关系考察 表1显示,各脑核团在各自范围内呈良好的线性关系(r>0.990 0)。

表1 弥罗松酚线性关系Tab.1 Linear relationships of ferruginol
3.2.3 LLOD、LLOQ 测定 两者分别为 0.02、0.06 μg/mL。
3.2.4 准确度、精密度试验 表2显示,弥罗松酚在各脑核团中的日内、日间精密度RSD 均小于15%,日间、日内准确度分别为98.26%~108.43%、97.38%~110.22%,表明该方法精密度、准确度良好。
3.2.5 萃取回收率 表2显示,弥罗松酚在大鼠脑核团中的萃取回收率在75%以上,符合生物样品检测相关要求。
3.2.6 稳定性试验 表2显示,弥罗松酚准确度在91.37%~103.74% 之间,具有良好的冻融稳定性。
3.3 脑核团分布 大鼠尾静脉注射给予40 mg/kg弥罗松酚,于给药 8、23、45、60、70 min 后分别取海马、大脑皮层、丘脑、纹状体、下丘脑、小脑6 个脑核团,HPLC 法测定各脑核团中弥罗松酚含有量,结果见图2。由图可知,静脉注射给药后弥罗松酚可透过血脑屏障,在脑核团内形成持续的分布过程;给药后45 min 左右,大鼠脑核团内该成分含有量达到峰值,之后很快下降,峰值浓度依次为纹状体>丘脑>海马>大脑皮层>小脑>下丘脑,达峰时间差异较小,仅从23 min 到45 min。
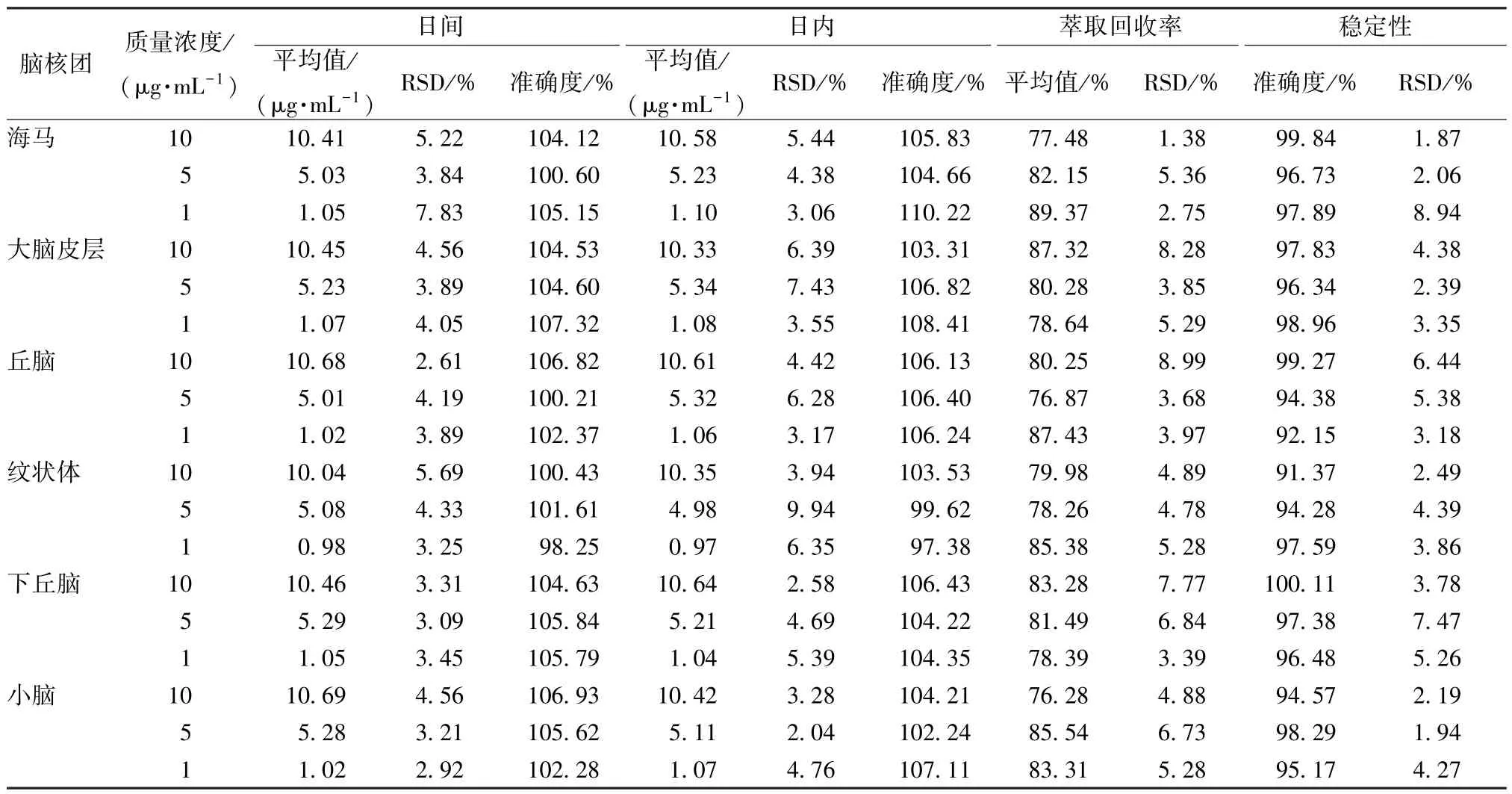
表2 弥罗松酚精密度、准确度、萃取回收率、稳定性试验结果(n=3)Tab.2 Results of precision,accuracy,extraction recovery and stability tests for ferruginol(n=3)
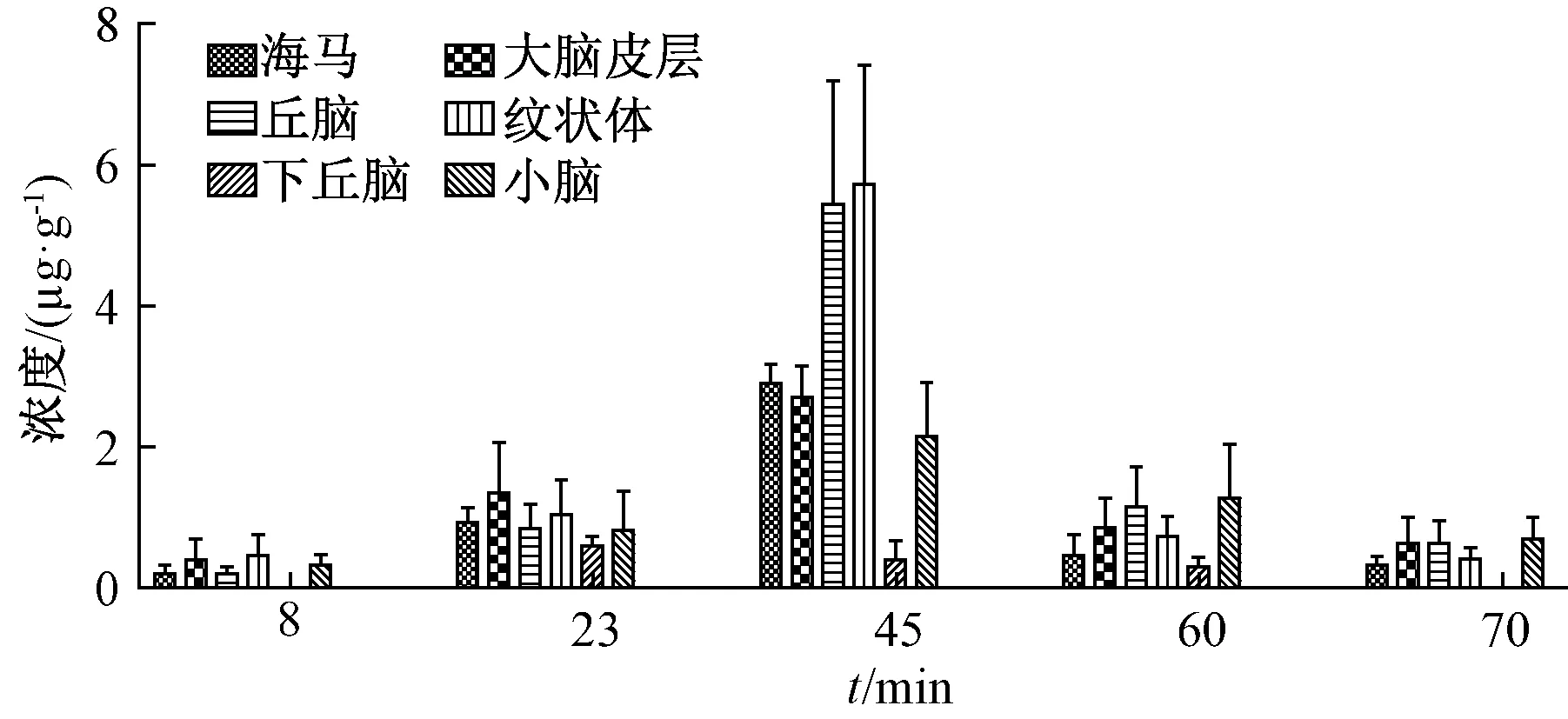
图2 弥罗松酚在脑核团中的峰值浓度Fig.2 Peak concentrations of ferruginol in cerebral nuclei
4 讨论
每个脑核团在脑功能中的作用不同,例如海马体主要负责学习、记忆、空间定位,日常生活中的短期记忆都储存在其中[8-9];大脑皮质是调节或控制躯体运动的最高级中枢[10];丘脑具有转运站的功能,从脊髓传来的神经冲动都先中止于丘脑,然后再分别传送至大脑皮质相关区域[11],其受损将导致感觉扭曲,从而无法正确了解周围世界;下丘脑为内分泌、神经系统的中心,能调节垂体前叶功能,合成神经垂体激素,控制自主神经和植物神经功能[12];纹状体与随意运动的稳定、肌张力的维持、肢体姿势的调节活动有关,此外还与对本体感受器传入的信息处理,即与无意识的运动反射控制有一定联系[13-14],根据临床、病理学观察,纹状体不同部位的损害可产生帕金森病[15-16]、舞蹈病、手足徐动症等[17-19],故动态观察药物在脑内不同核团内的分布对探讨其对脑功能的影响有着重要意义,也可指导相应药物开发。
本实验发现,弥罗松酚静脉注射后在海马、大脑皮层、丘脑、纹状体、下丘脑、小脑中均有分布,其中在纹状体、丘脑中有富集倾向。该成分对治疗脑部疾病可能有一定的作用,但对大脑的影响较复杂,提示在设计中枢治疗药物时要充分考虑具体脑核团分布规律,从而得到较好的药效和较低的副作用。