术前肾动脉栓塞联合腹腔镜下肿瘤剜除术治疗巨大肾错构瘤的初步探讨
曹益方 何屹 顾燕琴 赵凡 陈伟 吕伯东
肾错构瘤是肾脏最常见的良性肿瘤之一,占所有 肾脏肿瘤的0.3%~3%[1],女性患病率高于男性[2],其组织学构成包括脂肪、血管与平滑肌成分,又称为血管平滑肌脂肪瘤(renal angiomyolipoma,RAML)。巨大RAML可导致腰背部疼痛、肉眼血尿等症状,甚至发生破裂出血。目前对于巨大肾错构瘤的治疗,临床上主要采用肾部分切除术等方式进行干预,但常存在肾动脉阻断时间长、肾功能保护效果不理想等缺点。本文回顾性分析收治的接受术前肾动脉栓塞联合腹腔镜下肿瘤剜除术8例巨大肾错构瘤患者的临床资料,现报道如下。
1 临床资料
1.1 一般资料 选择嘉兴市第一医院泌尿外科2013年7月至2018年2月收治的接受术前肾动脉栓塞联合腹腔镜下肿瘤剜除术的8例巨大肾错构瘤患者作为研究对象。其中男3例,女5例;年龄34~67岁,平均47.2岁。肿瘤位于左肾3例、右肾5例。所有诊断均经增强CT检查结果证实。肿瘤最大径7.8~11.7cm,平均(9.54±1.31)cm。所有肿瘤均呈外生型,未侵犯集合系统。术前平均血清肌酐(Scr)为(79.5±14.96)μmol/L、患肾平均肾小球滤过率估算值(eGFR)为(39.0±4.63)ml/(min·1.73 m2)。 所有患者均在术前1d行肾动脉栓塞,采用后腹腔途径行腹腔镜下肿瘤剜除。
1.2 治疗方法 (1)超选择性肾动脉栓塞:嘱患者仰卧,以2%利多卡因局部麻醉后逆行穿刺股动脉,置入5F鞘管及造影导管。行腹主动脉及肾动脉造影,明确肿瘤供血动脉后通过微导管超选择至靶血管,再次造影确认后,注入栓塞微球及弹簧圈,复查造影显示碘油沉积良好、肿瘤染色消失后完成栓塞治疗(见图1)。(2)腹腔镜下肿瘤剜除术:腹腔镜下肿瘤剜除术在栓塞术后24h进行。患者取健侧折刀卧位。经后腹腔入路,充分游离腹膜外脂肪,打开Gerota筋膜,充分游离肾动脉备用,充分暴露肿瘤后,用超声刀沿肿瘤边缘逐步切除肿瘤,用吸引器彻底吸除参与肿瘤组织。最后,用3-0倒刺线缝合肾实质深部或集合系统,2-0倒刺线缝合全层肾实质创面并用hem-o-lock间断加固。
1.3 术后评估 术后3个月常规复查肾脏平扫CT、Scr和eGFR,此后每年复查肾脏超声检查。患者术后随访6~50个月,平均随访时间为24.75个月。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以(x±s)表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。
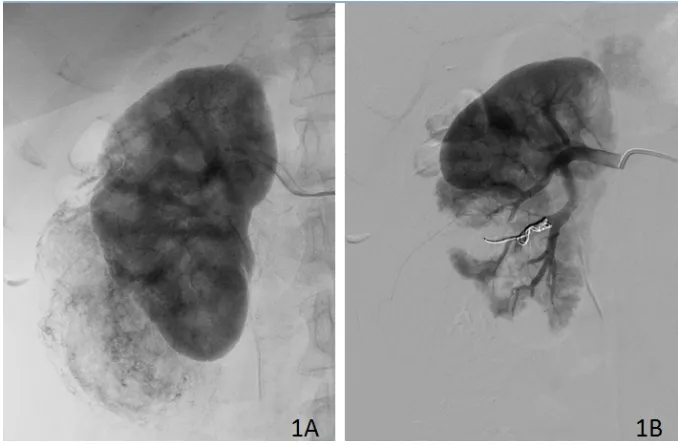
图1 肾动脉造影像图
2 结果
本组8例患者手术均获得成功,无中转开放手术。本组平均手术时间(105.13±16.63)min,术中平均出血量(77.5±43.67)ml,术后住院时间(7.75±1.28)d,5例患者未行肾动脉阻断,3例平均肾动脉阻断时间为26min,最长为36min。2例患者肿瘤剜除后未进行创面缝合。术中及术后均未输血,无术后出血及尿漏病例。术后3个月复查Scr为(83.88±13.11)μmol/L,患肾eGFR为(37.0±6.23)ml/(min·1.73m2),与术前相比差异均无统计学意义(P均>0.05),见表1。术后病理检查结果证实为肾血管平滑肌脂肪瘤,与临床诊断相符。平均随访24.75个月,随访期间复查CT或彩超均未见肿瘤局部复发。

表2 术前与术后Scr、eGFR比较分析(x±s)
3 讨论
RAML是肾脏最常见的良性肿瘤之一,且以女性较为多见,男女比例约为1∶4[3]。RAML具有丰富的血供且发育、走形畸形,极易形成动脉瘤和自发性破裂出血,尤其是直径>4cm者的破裂风险较高,所以以往国际上公认的治疗共识是对于>4cm的RAML需要采取临床干预[4],但是最新研究表明,并不主张所有的>4cm的RAML采取早期干预,对于散发的无症状的RAML可采取主动监测[3]。但是对于巨大肾错构瘤,通常需要采取临床干预,且以保留肾单位手术为首选,其目的是切除肿瘤病灶、消除临床症状并最大限度保护肾功能。
对于肾错构瘤的治疗,在1976年之前,93%的散发性肾血管平滑肌脂肪瘤采用开放性全肾切除术治疗[5]。随着现代影像技术的提高以及泌尿微创技术的发展,开放手术逐渐被取而代之。目前临床上治疗肾错构瘤的主要手段有腹腔镜下肾部分切除术和栓塞治疗、射频治疗。
动脉栓塞是一种有效的技术,可以预防性地或在紧急情况下治疗RAML,可以治疗出血和缩小肿瘤大小,且复发率低和具有可接受的并发症。其优点是可以保留未受累的肾实质,从而尽可能多的保留肾单位,尤其是对于结节性硬化症的患者,肾动脉栓塞是一个较好的选择。对于巨大RAML,尤其是肿瘤与肾组织分界不清,无法辨别肿瘤滋养血管,选择性肾动脉栓塞可能会使治疗不够彻底,导致二次栓塞或转为开放手术[6]。
射频消融术是另一种肾错构瘤的治疗方式。2003年,Jacomides等[7]首次将射频消融(RFA)辅助技术与传统的腹腔镜肾部分切除术(LPN)相结合,也有研究结果均表明了消融技术辅助LPN 的优势在于完整切除肿瘤的同时最大限度地保护肾功能[8]。近期也有学者[9]报道了15例腹腔镜下射频消融联合肿瘤剜除治疗外生性肾错构瘤,利用术前薄层增强CT定位肿瘤基底部血管,将射频消融的探针封闭肿瘤血管蒂,再在无阻断情况下进行肿瘤剜除,也取得了满意的效果,但是此方法所选取的肿瘤直径在4~8cm,且符合低R.E.N.A.L.评分,否则会增加一定的难度,目前利用射频消融联合肿瘤剜除治疗直径>8cm的巨大肾错构瘤鲜有报道。
腹腔镜肿瘤剜除能够彻底切除病灶,保留部分患侧肾单位,是当前临床治疗RAML的主流术式。虽然腹腔镜下肿瘤剜除术避免了患者切除,但由于RAML具有丰富的血供,保留肾单位手术(NSS)操作中易发生难以控制性的大出血,甚至被迫切除患肾。研究表明,肾脏可以耐受30min以内的热缺血而肾功能不受影响,更长时间的肾缺血可能会造成肾脏功能的不可逆性损害,也有学者提出每分钟的热缺血时间都会影响患者术后的肾功能[10]。之前有学者报道了在开放肾部分切除体积较大的RAML之前进行选择性的肾动脉栓塞,以减少手术出血,降低手术难度,取得了不错的效果[11]。近期也有学者对肿瘤直径在4~8cm的RAML行术前选择性肾动脉栓塞联合腹腔镜下肿瘤剜除进行了报道,不仅可以减少术中出血量,缩短热缺血时间,而且更大限度的保护了肾功能[12]。作者认为肾动脉栓塞联合腹腔镜下肿瘤剜除治疗巨大肾错构瘤是安全可行的,本研究中8例患者均获得成功,包括手术时间、出血量及术后住院时间都在可控的范围内。作者认为,术中需根据肿瘤深浅、剜除过程中出血情况决定是否阻断肾动脉,如果肿瘤表浅且栓塞完全,可以考虑不阻断肾动脉,但是对于肿瘤较深或栓塞不完全,则需常规阻断肾动脉。本研究中5例患者未阻断肾动脉。对于创面是否需要缝合,需考虑肿瘤的深浅、基底宽窄和栓塞的效果,如果肿瘤比较浅,可以不缝合,创面可以用电灼或者双极电凝进行止血。对于肾动脉阻断与否以及创面缝合问题,术者需根据腹腔镜下缝合技术熟练程度以及患者的整体情况综合判断,尽量以缩短热缺血时间和减少出血量为宜。平均随访24.75个月,未见肿瘤复发。术前血肌酐和eGFR与术后3个月比较并无显著差异,治疗效果满意。
巨大肾错构瘤破裂出血的风险大,一旦确诊,需尽早干预。术前肾动脉栓塞联合腹腔镜下肿瘤剜除术是治疗巨大外生型肾错构瘤的有效措施,安全可行,能够使部分患者在不阻断肾动脉的情况下剜除肿瘤,短期随访结果显示治疗效果满意,值得临床推广。

