利用流式分选技术富集空载质粒转染特定巨噬细胞的方法及条件优化
吴昊,王敏,罗贤强,郭建春,郑斌娇,2
(温州医科大学,浙江 温州 325035,1.浙江省医学遗传学重点实验室;2.Attardi线粒体生物医学研究院)
现阶段常用于细胞分离的方法主要有密度梯度离心法、磁珠分离法和流式细胞分选技术。密度梯度离心法操作简单,但分选细胞效率低;磁珠分离法只能进行单因素分离,且会对细胞产生免疫刺激或机械损伤[1]。而流式细胞术不但能做到无菌分选,而且可多因素正选或负选,具有定量、高通量、分选纯度高等特点。近年来流式细胞分选技术越来越广泛地应用于目的细胞或粒子的快速分离,如外周血原代单核细胞、精子、蛋白聚合体、肿瘤细胞等[2-5]。闵智慧等[6]用不同的喷嘴分选Raji等细胞,发现使用不同的喷嘴对细胞的得率、活性有影响。黄莹莹等[7]使用流式分选技术分选CD8+T细胞,发现流式细胞技术分选法较免疫磁珠法效率更高,更能得到高活性细胞。VOROBJEV等[8]通过评估滤光片的性能对流式分选条件进行优化,用优化后的条件分选受寄生虫感染的红细胞,分选纯度比只用普通标准滤光片提高了50%~150%。本研究以J774A.1细胞株为实验对象,使用携带GFP报告基因的PX458空载质粒转染J774A.1细胞,以GFP荧光强度、7-AAD进行双因素分选,旨在建立富集PX458 空载转染J774A.1细胞的最佳方案,确立用于筛选J774A.1细胞的最佳条件。
1 材料和方法
1.1 材料 BD FACSAria II流式细胞分选仪(美国BD公司);多功能酶标仪(美国MD公司);PX458购自北京普如汀生物技术有限公司;QuickShuttle-Su perfast购自北京博奥龙免疫技术有限公司;7-AAD Viability Staining Solution购自美国Biolegend公司;GFP(D5.1)XP®Rabbit mAb购自美国CST公 司;辣根过氧化物酶标记山羊抗兔IgG(H+L)购自上海碧云天生物技术公司;J774A.1细胞株购自ATCC。
1.2 方法
1.2.1 脂质体转染:J774A.1细胞是来源于BALB/cN 小鼠网织细胞肉瘤的巨噬细胞株,通过脂质体转染法将PX458空载质粒转染J774A.1细胞株,加入10% FBS 1640培养基(不添加青霉素及链霉素),置于 37 ℃,5% CO2培养箱培养,1~2 d传代1次。
1.2.2 Western blot鉴定:提取细胞蛋白,恒量上样蛋白20 μg,并在SDS-聚丙烯酰胺凝胶中电泳。随后,将蛋白质转移到PVDF膜。膜用5%的脱脂奶粉封闭2 h,然后孵育相应的一抗[GFP(D5.1)XP®Rabbit mAb]和二抗[辣根过氧化物酶标记山羊抗兔IgG(H+L)]。应用ECL显色系统曝光,检测蛋白信号。
1.2.3 细胞上机前处理及染色:用胰酶消化细胞,1 500 r/min,4 ℃离心5 min。使用10% 1640培养基重悬,计数5×106个细胞,悬浮于500 μL培养基。加入1 μL 7-AAD后,常温避光孵育15 min。
1.2.4 流式细胞仪调试:BD FACSAria II流式细胞分选仪以BD FACSDiva Software为操作软件,以1%无菌PBS为鞘液。开机后启动液流,选择合适的喷嘴及相应鞘液压力,再打开主液流,调节液滴频率、振幅。待主液流调节至适合且稳定的状态,选中主液流框的“Sweet Spot”键,仪器会自动调节液滴频率、振幅使液流稳定在设定状态。打开侧液流高压,可见分选框内出现光斑。配制Accudrop微球,选中“Auto Delay”键,使仪器自动调节液滴延迟时间,侧液流偏转以99.5%以上为佳。更换分选模式只需在分选开始前,选中分选设置窗口,依次更换single cell、4-way purity、purity、yield、initial或fine tune模式即可。
1.2.5 流式细胞分选与分选效率检测:准备J774A.1 阴性对照管、GFP阳性管、7-AAD单染管、样本管4组细胞样本。用阴性对照管设门,进行流式分析和分选参数调试。将样本管细胞上机进行分选,将分选所得的细胞重新上机回测分析,测定其GFP阳性率。
1.2.6 细胞培养与冻存:分选所得的细胞以1 500 r/min,4 ℃离心5 min,弃上清。用3 mL 10% FPS 1640细胞培养基重悬,转至6 cm细胞培养皿培养。细胞生长状态良好时,进行冻存,保存于液氮中。
1.3 统计学处理方法 采用SPSS20.0软件进行统计分析。计量资料以±s表示,进行单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养 原代J744A.1细胞培养镜下观察见图1,细胞形态饱满且贴壁牢固,提示细胞生长状态良好。分选后所得细胞培养3 d后,荧光显微镜下观察见图2,细胞贴壁良好,GFP阳性率约90%,提示分选所得细胞可继续培养且GFP持续表达良好。
2.2 GFP蛋白表达鉴定 将构建的PX458空载质粒转染的J744A.1细胞用Western blot进行GFP蛋白表达的定性鉴定。如图3所示,经PX458空载质粒转染的J774A.1细胞已携带GFP报告基因,提示构建成功。
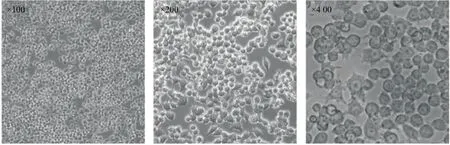
图1 原代J774A.1细胞生长状态图

图2 经PX458空载质粒转染的J744A.1细胞培养3 d荧光镜下图(×100)
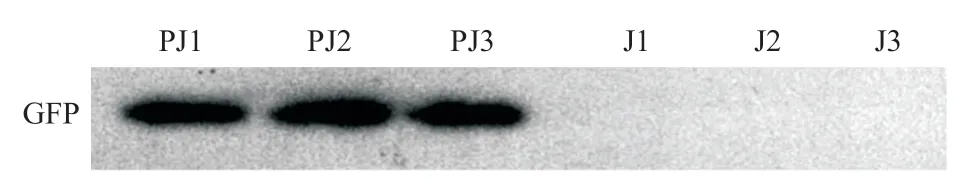
图3 Western blot定性鉴定GFP蛋白表达结果
2.3 主液流调试 100 μm喷嘴的主液流Gap带适合位置是液流框的上1/3处,以主液滴各滴形状规则,小卫星点少于6个且融入液滴良好为佳(见图4A)。若Gap带的位置过低或过高都将引发卫星点及液滴分布异常,导致分选效率降低或无法进行分选(见图4B-D)。
2.4 分选模式与分选纯度 分选前,带GFP的J774A.1细胞株(GFP阳性细胞)被分成6大组,每组3个样本,经单因素方差分析,分选前各组GFP阳性率差异无统计学意义(P=0.85)。将各大组样本分选后得到的GFP阳性细胞重新上机进行回测,得到回测GFP阳性率。经单因素方差分析,分选后各组GFP阳性率差异有统计学意义(P<0.01)。由表中可知,分选回测阳性率最高的分选模式为purity模式,可达95.7%±1.0%。回测阳性率达90%以上的有single cell和fine tune模式,分别为91.0%±0.2%和92.0%±0.4%。见表1和图5。
3 讨论
流式分选技术是指在流式分析技术基础上,快速准确判断目标细胞所在的液滴并加以特定电荷,使目标细胞在电场中发生偏转从而进行回收的一种现代细胞分选技术。分选后的细胞能直接用于培养、移植、核酸提取、单细胞PCR扩增或原位杂交等。
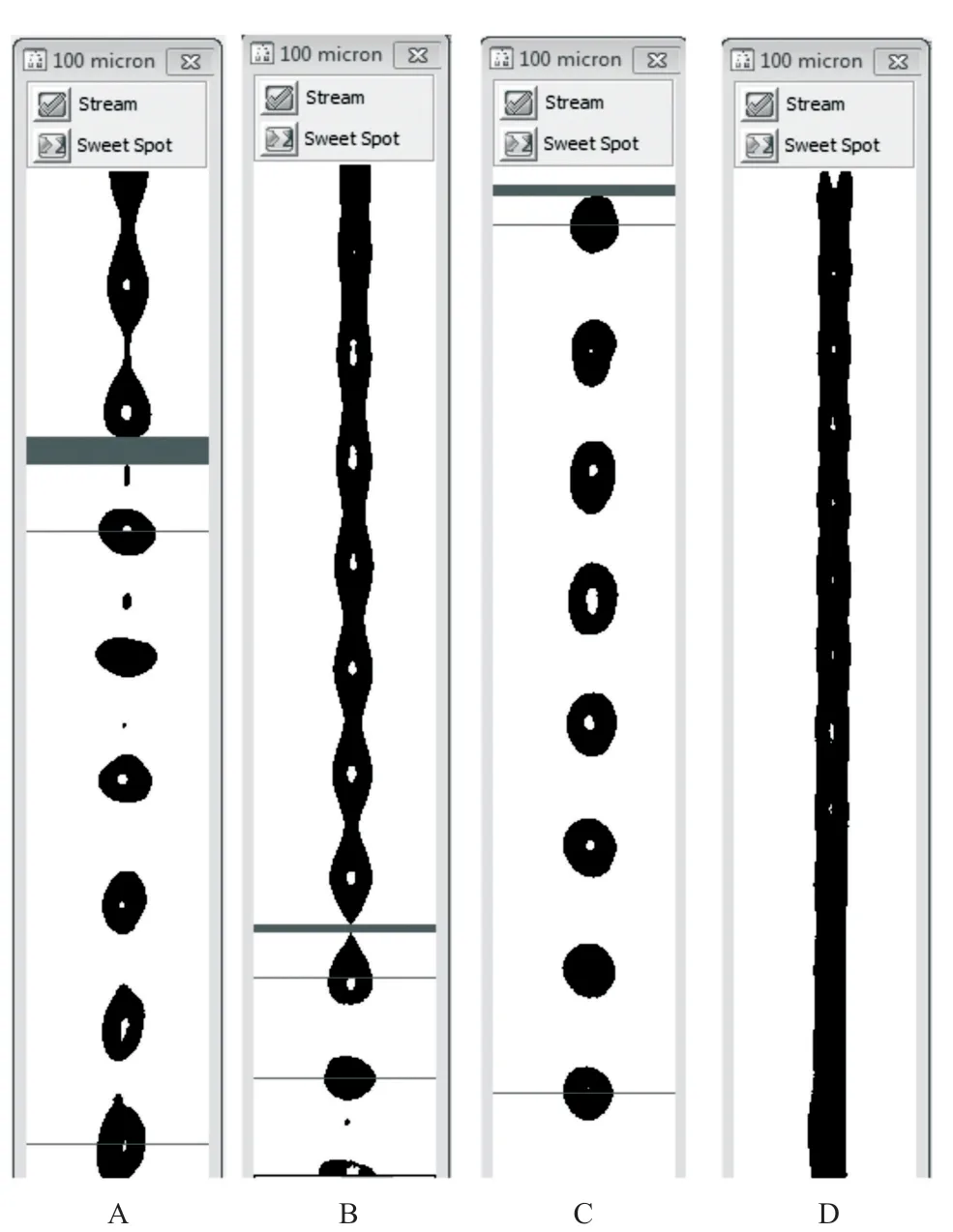
图4 BD FACSAria II流式分选仪主液流调试
表1 不同分选模式下分选前后GFP阳性率(每组n=3,±s,%)

表1 不同分选模式下分选前后GFP阳性率(每组n=3,±s,%)
分选模式 分选前GFP阳性率 分选后回测GFP阳性率purity 4.0±1.8 95.7±1.0 single cell 3.9±1.4 91.0±0.2 4-way purity 4.1±1.6 86.4±1.1 yield 3.6±1.4 80.0±0.3 initial 5.1±0.2 82.7±1.5 fine tune 4.0±1.4 92.0±0.4 F 0.38 141.11 P 0.85 <0.01
流式细胞分选的关键在于参数的设定与调试。细胞分选的效率、纯度直接受参数设定的影响,如果不能很好地掌握仪器的参数和条件设置技巧,将会对细胞分选的得率、纯度和细胞活性产生较大影响[9]。如仪器的状态(包括液流的稳定性、激光激发的程度、激光的稳定性),样品的状态(包括样品的处理方式、样品的浓度、样品的质量)以及分选时使用的喷嘴孔径大小,分选时选择的分选模式(BD FACSAria II流式细胞分选仪可使用single cell、4-way purity、purity、yield、initial和fine tune 6种模式进行分选)等[10]。此外,细胞的流速,荧光蛋白的强度、荧光素的组合也会影响分选的结果[5]。

图5 分选前GFP阳性率及不同分选模式分选后回测GFP阳性率
本研究的实验对象J774A.1细胞是来源于BALB/cN 小鼠网织细胞肉瘤的巨噬细胞株,主要用于宿主对病原菌免疫应答的研究。PX458是一种携带GFP报告基因的空载质粒,将目的基因载入PX458质粒并转染J774A.1细胞能够构建含有GFP报告基因的BALB/cN小鼠巨噬细胞株,筛选之后用于后续功能研究。目标细胞的富集对后续的功能研究起着至关重要的作用。本研究使用BD FACSAria II流式细胞分选仪70 μm、85 μm和100 μm喷嘴对PX458空载转染的J774A.1细胞进行分选。但选用70 μm和85 μm喷 嘴分选所得细胞细胞活力低下,无法存活。可能的原因是喷嘴孔径太小,鞘液包裹的细胞经过喷嘴孔时受到挤压,影响细胞的正常形态和生理功能,致使分选后培养时出现大批量死亡。选用100 μm喷 嘴分选后,细胞能够正常存活并传代。因此本实验选用100 μm的喷嘴进行分选调试。喷嘴大小也会影响主液流窗口形状,选定100 μm喷嘴后,通过调节振幅和频率调节主液流形状,以维持适合分选的液流。若液流调节不当,则会导致仪器无法正确抓取目标细胞,大大降低分选的纯度。为确保主液流的稳定性和连续性,需把握以下3个方面:超声清洗喷嘴避免喷嘴小孔堵塞;保证O圈的密封性,在安装O圈时避免大幅上下移动;准确调整适当的振幅和频率[11]。
刘锡娟等[12]通过优化流式分选相关参数,分选SMMC7721细胞,GFP阳性细胞群的分选纯度达99.6%。SABATH等[13]用流式分选技术替代药物筛选法分离Flp介导的GFP标记的重组细胞,结果显示,分选后GFP阳性细胞的比例比未分选前提高了5~30 倍。在本研究中,6 种分选模式分选效率不同,所得的PX458空载质粒转染的J774A.1细胞GFP阳性率从80.0%至95.7%不等,与J774A.1原代细胞相比,分选所得J774A.1细胞浓度提高了16~24倍。其中选用purity模式进行分选,分选效率最高,可达到95.7%。但该模式下虽分选纯度高,却会使得机器丢弃黏连的目标细胞而导致细胞得率的下降。而yield模式注重得率,因此会导致非目标细胞的误选,分选所得细胞GFP阳性率相对较低,仅为80.0%。一般来说,细胞分选实验以实验目的为准,高富集实验以目标细胞分选纯度为指标。因此,本研究认为,当使用100 μm的喷嘴对J774A.1细胞株进行分选时,以purity模式进行分选较合适。
本研究调试优化相关参数后,分选所得细胞阳性率较未分选前提高了16~24 倍,分选纯度可达95.7%,符合后续功能研究的要求。综上,本研究通过流式分选技术,建立了富集PX458空载转染的J774A.1细胞的新方法,可为流式细胞分选技术在其他细胞的分选应用上提供良好的参考。

