孔雀石绿对整合子捕获耐药性基因盒频率的影响
杜怡青,胡 敏,申 斌,梁转霞,罗晓旭,杨泽华
(1山西医科大学第一医院检验科,太原 030001;2山西医科大学第六医院检验科;*通讯作者,E-mail:zehuay026@163.com)
目前细菌耐药性问题已成为全球的公共卫生问题。细菌产生耐药性的主要原因是通过基因转移以及基因突变,但基因点突变的发生率很低,仅通过细菌自身的基因突变无法解释目前细菌耐药性如此广泛迅速出现这一现象,因此耐药基因在菌种内以及菌种间的水平传播是目前细菌获得新耐药性的重要途径[1]。整合子是细菌获得新耐药性的一种重要基因原件,它通过捕获、储存和重新排列由外来基因盒携带的新功能,赋予细菌在不断变化的环境中快速适应的能力[2]。细菌获得耐药性就是其中适应环境的一个很好的例子[3]。如果能够弄清影响整合子整合频率的因素,找到一种有效的方法抑制整合子的整合频率,就可以有效抑制细菌耐药性的传播,减缓多重耐药菌的出现,降低院内感染的发生,更有效地治疗临床微生物感染。
目前已有研究表明饥饿应激和高温等不利环境可以提高1类整合子的整合频率[1,4],但尚未发现任何可以降低整合频率的方法。消毒剂对细菌的生长是一种不利因素,而孔雀石绿是一种常见而廉价的染料和消毒剂。本实验旨在通过测定添加与不添加孔雀石绿影响的大肠杆菌BL21(DE3)中整合子的整合频率,研究消毒剂孔雀石绿对整合子捕获耐药性基因盒频率的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 工程菌株大肠杆菌BL21(DE3)。4个重组质粒:含有整合子的重组质粒pACIN、高表达整合酶的重组质粒pUCINT、含有aadA2基因盒的质粒pACADA、同时含有整合子和aadA2基因盒的重组质粒pACINAD,以上菌株及质粒均由本实验室保存。将同时含有质粒pACINAD和pUCINT的大肠杆菌BL21(DE3)命名为HS2。
1.1.2 试剂与培养基 氨苄青霉素、孔雀石绿购自上海生工生物工程技术服务有限公司,甲氧苄啶购自Sigma公司。酵母提取物、胰蛋白胨购自英国OXOID公司,氯化钠购自BBI公司。实时荧光定量聚合酶链反应(RT-PCR)试剂盒购自大连Takara公司,质粒提取试剂购自杭州博日科技有限公司。
1.1.3 PCR引物 PCR引物购自上海赛百盛生物公司(见表1)。
表1 实时荧光定量PCR引物
Table 1 Real time-PCR primer sequences

引物名称 序列说明DHFQ5′-TAGCACCCACTGAAACCCAG-3′总整合子测定上游引物ORFQ5′-CTGCGCAGCCCATGCAGGCGA-3′总整合子测定下游引物5CS5′-GGCATCCAAGCAGCAAGC-3′发生整合的整合子测定上游引物AAFQ5′-CATCCACTGCGGAGCCGTAC-3′发生整合的整合子测定下游引物
1.1.4 主要仪器 美国BIO-RAD CFX96荧光定量PCR仪,上海博迅气浴恒温振荡器,德国Eppendorf高速离心机。
1.2 实验方法
1.2.1 RT-PCR标准曲线的制备 按照质粒提取试剂盒说明书提取过夜培养的菌株中含有整合子的重组质粒pACIN,测定最终产物的吸光度(A)和纯度,结果为A260=0.080,A280=0.046,经过换算,提取到质粒的含量为40 μg/ml。根据其相对分子质量可计算出具体拷贝数,即可表示总整合子拷贝数。用灭菌去离子水对提取物作10倍的倍比稀释,共稀释得5个不同浓度标准品后,进行荧光定量PCR测定,根据测得的Ct值和标准品浓度对数值绘制总整合子拷贝数标准曲线。以相同方式提取过夜培养菌株含有aadA2基因盒的pACADA质粒,测量最终产物吸光度(A)和纯度,结果为A260=0.224,A280=0.115,换算含量为112 μg/ml。根据其相对分子质量计算出拷贝数,可用于表示发生整合的整合子拷贝数。用灭菌去离子水作10倍倍比稀释后测定Ct值,得5个不同浓度标准品,根据测得的Ct值和标准品浓度的对数值绘制发生整合的整合子拷贝数标准曲线。
1.2.2 用RT-PCR法测定整合频率 取40株HS2菌株平均分为两组,试验组20株HS2菌株接种于含有20 μg/ml孔雀石绿的LB液体培养基中37 ℃培养16 h,对照组20株HS2菌株接种于普通LB液体培养基中在37 ℃下培养16 h。每株菌株均以如下方式制备PCR模板。取培养的菌液2 ml以10 000g离心3 min,用1 ml去离子水洗涤2次,然后加入200 μl去离子水彻底悬浮,100 ℃沸水浴10 min后,再以10 000g再次离心3 min,最后取上清液为模板。测定其发生整合作用的整合子拷贝数和总整合子拷贝数,两者比值即为该菌株整合频率。
测定总整合子的RT-PCR体系共10 μl,具体为:灭菌去离子水3.6 μl、SYBR Premix Ex Taq 5 μl、制备完毕的细菌模板1.0 μl、上游引物DHFQ 0.2 μl、下游引物ORFQ 0.2 μl。测定发生整合作用整合子的体系基本相同,仅将引物更换为上游引物5CS 0.2 μl和下游引物AAFQ 0.2 μl。试验采用BIO-RAD CFX96实时荧光定量PCR仪,反应条件为95 ℃预变性10 s,随后进行40个循环95 ℃变性5 s,58 ℃退火8 s,72 ℃延伸10 s,在每个循环的延伸步骤结束后读取一次荧光信号。扩增结束后温度从50 ℃升至95 ℃,上升速度为每秒0.1 ℃用于测量扩增产物的熔解曲线。预计测定总整合子拷贝数的扩增产物长度为121 bp,测定发生整合作用整合子的拷贝数扩增产物长度为238 bp。
1.3 统计学方法
2 结果
2.1 荧光定量PCR法测定标准曲线
测定总整合子拷贝数的标准曲线对应于回归方程y=-3.43x+51.70,测定发生整合作用的整合子拷贝数的标准曲线对应于回归方程y=-3.99x+56.52,其中y代表荧光定量PCR测定出的Ct值,x代表实际整合子拷贝数取10的对数。根据斜率可知两者均具有较好的扩增效率(见图1)。
2.2 荧光定量PCR结果
试验组与对照组大肠杆菌HS2整合子捕获基因盒频率见表2。经正态性检验后,数据服从正态分布,其整合频率差异有统计学意义(P<0.01)。

图1 荧光定量PCR标准曲线Figure 1 Real-time PCR Standard curve
表2 荧光定量PCR法测定的大肠杆菌HS2及其在孔雀石绿影响下的整合频率
Table 2 The integration frequency ofE.coliHS2 added with and without malachite green determinated by real-time PCR
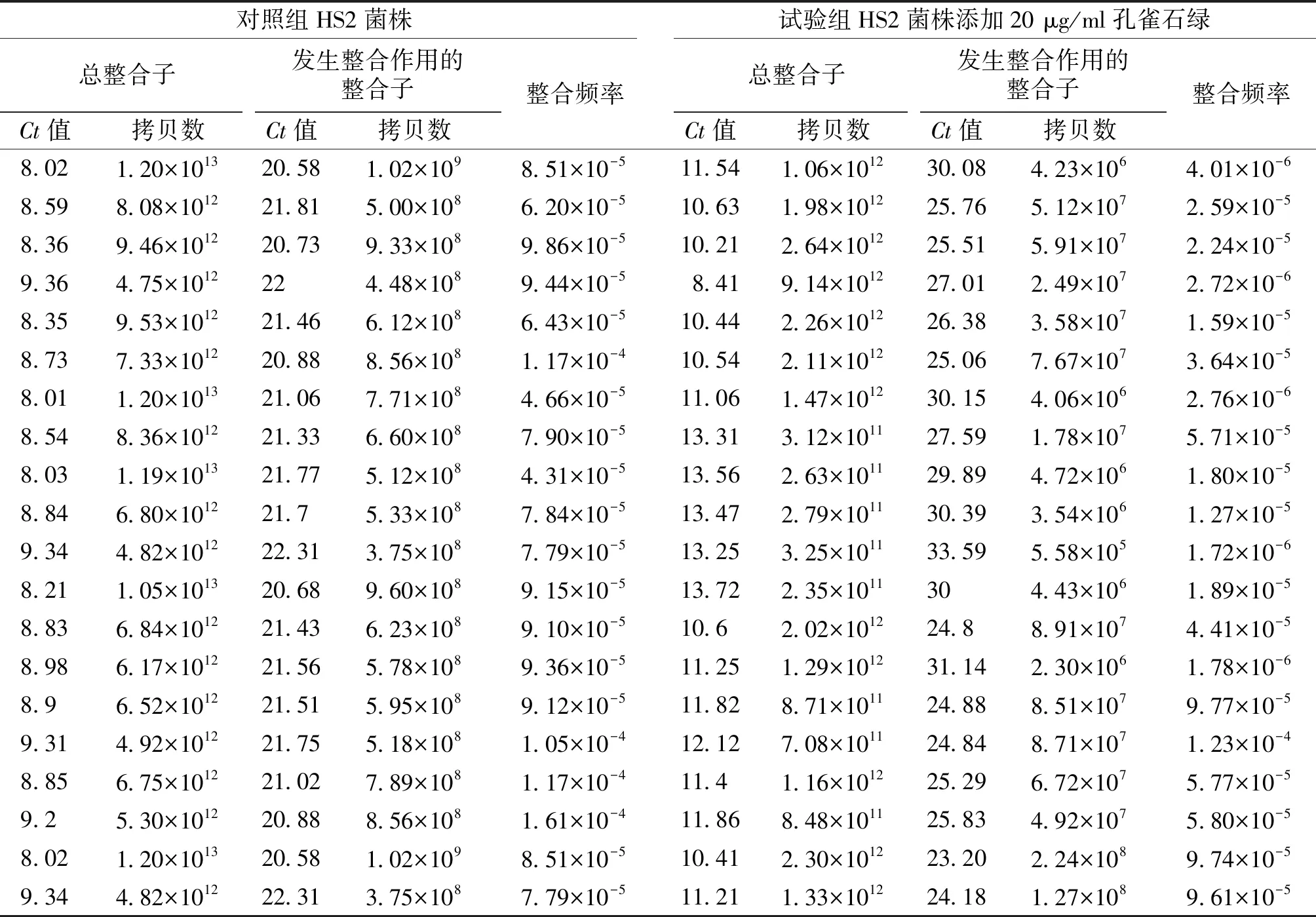
对照组HS2菌株试验组HS2菌株添加20 μg/ml孔雀石绿总整合子发生整合作用的整合子Ct值拷贝数Ct值拷贝数整合频率总整合子发生整合作用的整合子Ct值拷贝数Ct值拷贝数整合频率8.021.20×101320.581.02×1098.51×10-511.541.06×101230.084.23×1064.01×10-68.598.08×101221.815.00×1086.20×10-510.631.98×101225.765.12×1072.59×10-58.369.46×101220.739.33×1089.86×10-510.212.64×101225.515.91×1072.24×10-59.364.75×1012224.48×1089.44×10-58.419.14×101227.012.49×1072.72×10-68.359.53×101221.466.12×1086.43×10-510.442.26×101226.383.58×1071.59×10-58.737.33×101220.888.56×1081.17×10-410.542.11×101225.067.67×1073.64×10-58.011.20×101321.067.71×1084.66×10-511.061.47×101230.154.06×1062.76×10-68.548.36×101221.336.60×1087.90×10-513.313.12×101127.591.78×1075.71×10-58.031.19×101321.775.12×1084.31×10-513.562.63×101129.894.72×1061.80×10-58.846.80×101221.75.33×1087.84×10-513.472.79×101130.393.54×1061.27×10-59.344.82×101222.313.75×1087.79×10-513.253.25×101133.595.58×1051.72×10-68.211.05×101320.689.60×1089.15×10-513.722.35×1011304.43×1061.89×10-58.836.84×101221.436.23×1089.10×10-510.62.02×101224.88.91×1074.41×10-58.986.17×101221.565.78×1089.36×10-511.251.29×101231.142.30×1061.78×10-68.96.52×101221.515.95×1089.12×10-511.828.71×101124.888.51×1079.77×10-59.314.92×101221.755.18×1081.05×10-412.127.08×101124.848.71×1071.23×10-48.856.75×101221.027.89×1081.17×10-411.41.16×101225.296.72×1075.77×10-59.25.30×101220.888.56×1081.61×10-411.868.48×101125.834.92×1075.80×10-58.021.20×101320.581.02×1098.51×10-510.412.30×101223.202.24×1089.74×10-59.344.82×101222.313.75×1087.79×10-511.211.33×101224.181.27×1089.61×10-5
2.3 荧光定量PCR曲线
试验组与对照组大肠杆菌HS2扩增曲线见图2。由于添加孔雀石绿后对细菌生长有一定抑制作用,虽然测定时取菌液总量相同,但细菌总数不一定相同,故使用测定总整合子拷贝数结果进行校正(见图2)。测定结果为试验组添加20 μg/ml孔雀石绿后整合频率为(3.97±3.79)×10-5,对照组不添加孔雀石绿整合频率为(8.80±2.61)×10-5。说明添加孔雀石绿后,HS2菌株整合子整合频率降低,孔雀石绿对整合子整合频率有抑制作用。

图2 添加与不添加孔雀石绿的大肠杆菌HS2扩增曲线Figure 2 The amplification curve of E.coli HS2 added with and without malachite green
两组大肠杆菌HS2扩增产物熔解曲线见图3。测定总整合子扩增产物熔解曲线峰值为83 ℃(见图3A),测定发生整合作用的整合子扩增产物为86 ℃(见图3B)。熔解曲线均出现单峰,与预计目标扩增产物熔解曲线峰值一致,说明扩增产物为目标产物。
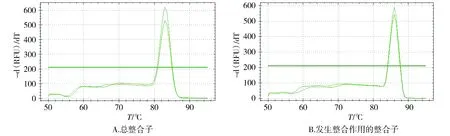
图3 添加与不添加孔雀石绿的大肠杆菌HS2扩增产物熔解曲线Figure 3 Melting curve of E.coli HS2 added with and without malachite green
3 讨论
整合子是细菌耐药基因的储存库,在细菌产生多药抗性中发挥了重要作用[5]。目前,人们已经发现超过100种不同的1类整合子基因盒,其中大部分为抗生素的耐药基因[6]。这些基因盒编码的蛋白质可以赋予细菌对目前临床应用的所有抗生素的耐药性。
有研究发现,临床分离的耐多药大肠杆菌中1类整合子的携带频率约为66.67%[7],有文献发现某些医院中的携带频率甚至高达88.73%[8]。大量文献报道表明医院常见多重耐药菌中,出现1类整合子的频率非常高,可见医院感染的多重耐药菌中有很多是在患者长期大量使用多种抗生素的环境下,细菌整合子捕获了多种不同的耐药基因盒而产生的。如果我们使用一种药物可以有效降低细菌整合子的整合频率,就可以有效降低多重耐药菌的产生。
本研究使用遗传背景清楚的工程菌株大肠杆菌BL21(DE3)作为研究对象。在通常情况下,由于宿主菌中的整合酶表达水平受到抑制,处于整合子中的基因盒保持稳定状态。当宿主菌处于应激状态的情况下,SOS反应被激活,整合酶表达水平升高[9],从而使整合子捕获外来基因盒水平升高。孔雀石绿是一种常用消毒剂,环境中孔雀石绿的存在对细菌生长是一种不利因素,并且我们选择的浓度接近MIC值。但在普通LB培养基中加入20 μg/ml孔雀石绿后,可见整合子捕获aadA2基因盒的整合频率并没有出现升高,反而降低约1倍左右。说明孔雀石绿可以在一定程度上抑制整合子捕获基因盒效率。
孔雀石绿是一种对革兰氏阳性和革兰氏阴性细菌均具有广谱抗菌活性的二氨基三苯甲烷染料,在生产中被广泛应用作为廉价高效的消毒剂、抗真菌剂和杀藻剂[10]。文献报道MG等三苯甲烷类染料通过多种途径实现杀菌作用,它可以破坏细菌含巯基酶的结构和功能[11],还可以抑制细菌mRNA与核糖体的结合,抑制拓扑异构酶Ⅱ的功能[12]从而产生强大的杀菌作用。但对其系统的抗菌活性及抗菌谱研究尚无详细报告。当培养基中加入孔雀石绿后,三苯甲烷的大分子结构可抑制细菌内多种蛋白的合成,可能同时抑制了整合酶的合成,从而降低整合频率。孔雀石绿在培养过程中会被细菌逐渐降解,转化为无色孔雀石绿和苯甲酸类化合物[12],可以明显观察到培养基中的绿色逐渐变浅,也可能对整合频率产生影响,具体机制有待进一步研究。
本实验结果表明孔雀石绿可以抑制整合子的整合效率。抑制了整合效率,就是抑制了整合子捕获新的耐药基因的频率和速度,在一定程度上抑制了细菌多重耐药的产生。目前还没有报道任何药物可以降低整合子的整合频率,孔雀石绿这种降低1类整合子整合频率的新作用为我们提供了一个崭新的研究方向,从延缓细菌多重耐药产生这一方面辅助治疗细菌感染。

