肺部超声在重症疾病中的临床应用进展
李敏 朱惠铭 王辉 宋军
近年来,损伤的肺泡及间质由于气-液比例发生变化,产生与正常肺部超声“黑影”不同的征象,使超声在肺的应用成为可能。随着超声技术的发展,逐渐发现肺部超声在诊断急性呼吸窘迫综合征、肺水肿、肺炎、气胸、肺栓塞等方面的重大价值,并可监测肺通气变化,指导临床液体的管理,评估预后,成为慢性疾病患者高风险事件的预测因子,尤其适用于重症疾病。而胸部X线片与CT检查搬运不便,暴露辐射,等待时间长,可重复性差,体位限制,成本高等缺陷使其不适于危重疾病的快速诊断[1-2]。为了更好地了解肺部超声在重症疾病鉴别的成像要点和新进展,笔者进行了详细论述。
一、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)
ARDS是一个连续的病理过程,主要表现为肺间质和肺泡水肿、低氧血症和呼吸困难,由多原因引起,如休克、创伤、感染、药物过量等,发病率、病死率、经济成本都较高[3-4]。因此,早期诊断并预测ARDS风险能够降低病死率,减少并发症,减轻费用负担[5]。目前,临床诊断ARDS的标准仍是柏林定义[6],即动脉血气试验和计算机断层扫描。肺部CT移动和放射风险的增加,使其不适用于重症患者,肺部超声可移动、简便、快速、可重复性强,诊断ARDS有较高灵敏度、特异度和准确性(分别为93%~98%,78%~100%,90.31%),对重症疾病具有很大价值[7-11]。Ma等[12]在大鼠模型中发现,肺部超声检测急性肺损伤(acute lung injury,ALI)或ARDS,与显微显微正电子发射型计算机断层显像(positron emission computed tomography,PET)或电子计算机断层扫描(computerized tomography,CT)扫描高度一致。
(一)ARDS在肺部超声中的成像模式
根据2012年国际共识指南,ARDS在肺部超声的主要成像模式为:(1)肺实变:胸膜下回声不足,轻者表现为碎片状,重者呈现组织样回声,类似肝脏样外观,内有高回声点状、分支状的空气或液体支气管征。(2)胸膜线异常:不规则增厚的碎片样。(3)双侧白肺:双肺多条弥漫性非均匀分布的≧3条B线密集形成。(4)A线消失或减少:肺滑动的消失,严重患者会出现胸腔积液(图1)[13-14]。值得注意的是,胸膜线异常、“白肺”、肺实变以及A线消失或减少并不是ARDS的特有表现,还可以出现在其它肺部疾病,如肺炎,出血、气胸和新生儿短暂性呼吸急促(transient tachypnea of newborn,TTN)等,只有这些表现同时存在,灵敏度和特异度才均为100%[15]。
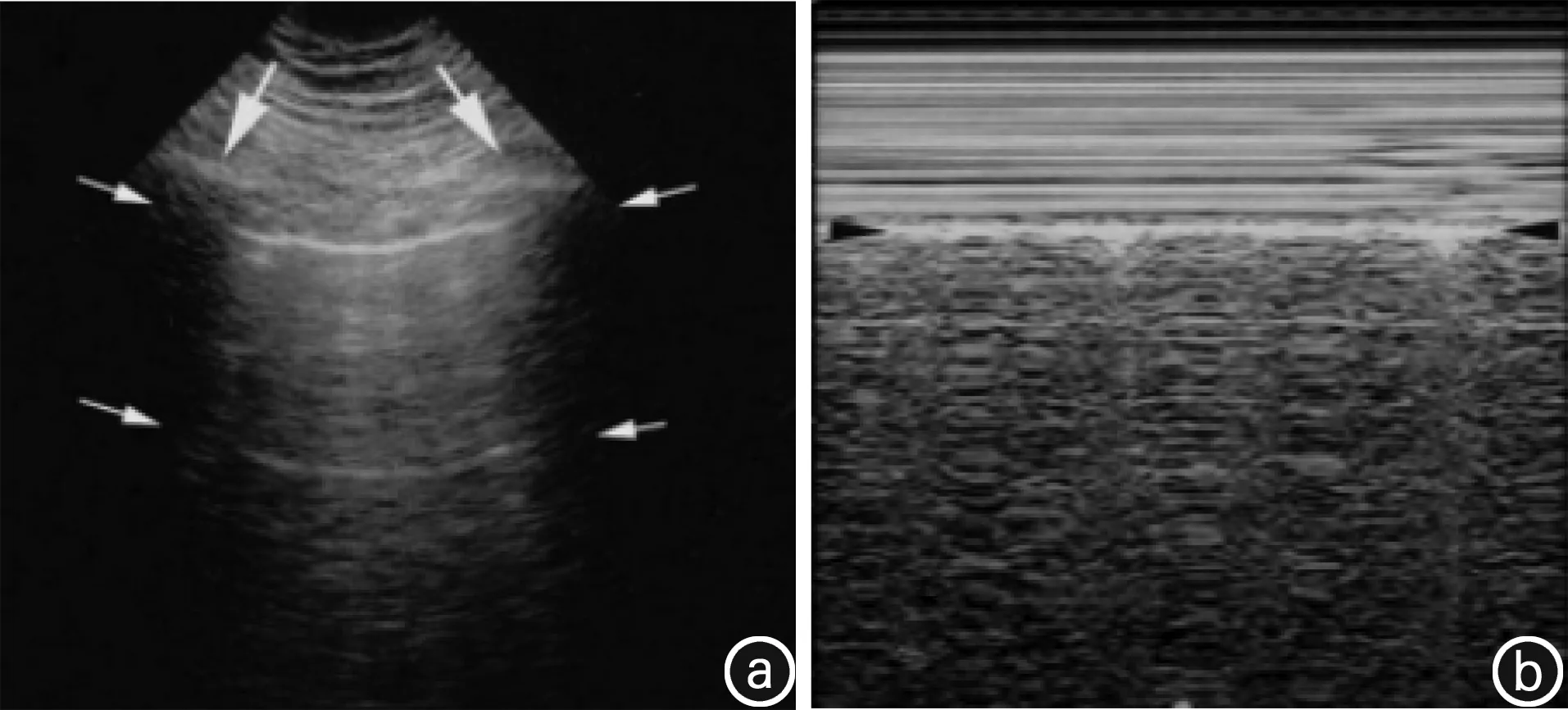
图1 表示正常的肺部超声成像
注:a.纵向箭头表示相邻的肋骨,两肋骨中间向下0.5 cm处高回声线为胸膜线(PL)(横向箭头所示),与胸膜线平行的横向箭头所指的高回声线为A线,其随呼吸左右摆动,称肺滑动;b.正常肺组织的M型模式,称海滨征,纵向箭头指胸膜线
(二)肺部超声预测ARDS患者俯卧位(prone positioning,PP)氧合反应的有效性
ARDS的另一种重要的治疗方法是俯卧位[16]。研究显示,俯卧位治疗ARDS具有可行性,可以改善氧合作用并可降低ARDS患者28 d病死率,但是仍存在一些风险,如意外拔管和血流动力学紊乱等[17-21]。高达80%的患者通过PP氧合改善,因此在PP期间监测床旁通气改善和预测氧合反应显得尤为重要[19]。CT一直是观察ARDS患者依赖区通气状况的有效手段,但其不利于日常监测[22]。最近,多项研究表明,简单而短暂的肺部超声检查已成为评估肺通气并预测氧合反应的有用工具[23-24]。研究人员在H0、H3和H6(PP后0、3和6 h)肺的16个区域进行PP肺部超声检查,根据肺通气的超声表现,进行肺部超声评分,并与7 d时动脉血氧分压与吸入氧分压之比(P/F)对比,最终得出PP阳性组(P/F>300 mmHg)(1 mmHg=0.133 kPa)的肺部超声评分低于PP阴性组(P/F<300 mmHg),并且H3与H0之间通气评分变化最大,但H3与H6之间无差异,表明在LUS可有效预测俯卧位氧合治疗[14]。Prat等[24]强调床旁LUS可有效评估ARDS患者的PP氧合反应,仰卧位左侧和右侧基底区域的正常肺部超声模式可用于预测PP的早期和晚期氧合改善,并有很高的特异度(可达100%)。
(三)肺部超声在新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)中的成像模式及新进展
新生儿呼吸窘迫综合征是新生儿进入ICU的常见原因[25]。NRDS主要是由于肺组织生理结构不成熟,缺乏肺泡表面活性物质水平,致使肺泡表面张力失调,肺泡塌陷致肺不张,肺顺应性降低,最终影响气体交换[26]。研究表明,床旁肺部超声安全可靠,在诊断NRDS方面具有很高的灵敏度(97%)和特异度(91%)[14,27]。
Liu等[14]认为NRDS的超声模式包括胸膜线异常,肺实变,双侧白肺,A线消失,空气支气管征,胸腔积液及间质综合征。肺实变,胸膜线异常,双侧白肺和A线消失总是能够观察到,同时存在的灵敏度和特异度为100%。文献报道,肺脉对于呼吸窘迫综合征(respiratory distress syndrome,RDS)有很大确诊价值,其灵敏度为20%,特异度为100%[14]。肺实变是NRDS最重要的指标,程度和范围随RDS等级而变化,轻度RDS主要位于胸膜下区域,严重的RDS可延伸到深部肺组织,并出现空气支气管影[14,27-29]。见表1。

表1 各指标诊断RDS的灵敏度和特异度
注:RDS为呼吸窘迫综合征
新生儿短暂性呼吸过速(TTN),是新生儿呼吸窘迫常见的原因之一,为胎儿肺液吸收延迟所致[30-31]。肺部超声可早期诊断TTN,双肺点100%的特异度增加了肺部超声对TTN诊断的准确性,结合其它征象可鉴别呼吸窘迫的病因,如肺炎、胎粪吸入综合征、呼吸窘迫综合征和气胸等[32]。 Copetti等[33]描述了双肺点的特征:即正常的胸膜线和肺滑动,肺部下部和上部的回声出现差异,下部表现为局限彗星假象。见表2[32]。

表2 肺部超声诊断TTN的指标,灵敏度及特异度
注:TTN为短暂性呼吸过速
在一项纳入54名婴儿研究中,通过对患有呼吸窘迫的患儿进行肺部超声检查,并分为I型(白肺)、Ⅱ型(B线患病率)或Ⅲ型(A线患病率),表明肺部超声可以预测RDS患儿无创通气能否成功并指导是否需要插管改善呼吸[34]。使用支气管肺泡灌洗和全肺灌洗治疗某些疾病如新生儿前白蛋白急速降低,肺部超声可用于监测是否有显著疗效,及时发现胸腔积液等并发症[35]。此外,肺部超声也可用于评价早产儿表面活性剂替代治疗[36]。但目前没有证据表明肺部超声在新生儿漏气综合征中的价值,能否用于纵隔气肿和心包气肿的诊断仍是学者争议的论点[27]。
(四)肺部超声在肺通气变化的监测和指导
肺部超声在ARDS的早期诊断,严重程度,预后,病死率的评估方面有很大作用[3,37]。通过肺部超声评分能够预测创伤患者中72 h内ARDS的发生,评估ARDS的严重程度,6分是预测ARSD的最佳阈值(使用胸壁8区划分法定义每个区域的肺部超声评分:0为该区域没有挫伤,1为该区域的一部分挫伤,2为整个区域的挫伤,评分为0~16分)灵敏度为58%,特异度为96%,准确度高于临床检查结合胸部摄影[38]。国际共识指出,肺部超声通过量化B线可监测多种急性肺部疾病肺通气的变化[13]。研究表明肺部超声可用于ARDS患者肺复张效果的评估和预测,由于ARDS患者肺通气不足,需要机械通气缓解呼吸困难,改善低氧状态,临床常运用呼气末正压通气(positive end expiratory pressure,PEEP)改善氧合,肺部超声可通过监测PEEP期间非充气区域的通气变化,评估PEEP诱发的肺复张效果[40]。临床中病毒或细菌及一些呼吸机相关性肺炎患者在抗生素治疗中常引起ARDS,ARDS液体复苏时,肺部超声可准确监测肺复氧,尤其是在资源环境较差的情况下[41]。当多种疾病共存时,肺部超声可鉴别ARDS同时伴发的其他疾病,并显示出比胸部摄影更好的诊断性能[40]。Soummer等[42]观察到呼吸窘迫的患者肺通气损失更多,肺部超声评分更高,并由此认为肺部超声评分可作为肺通气评估一项标准。
肺部超声为评估ARDS有效工具的证据是充足的,从ARDS早期诊断、预测发生风险,评估PP氧合反应疗效到监测肺复张疗效,预测预后等方面,肺部超声都优于其他胸部摄影,甚至可以取代。已修改的柏林定义中认为,肺部超声可以评估ARDS患者的发病率和预后,尤其在资源受限的环境下,已经将肺部超声作为诊断胸部不同病理疾病的基础工具[43]。
(五)紧急情况下的床旁肺部超声检查(bedside lung ultrasound in emergency,BLUE)
2012年的国际共识指南中,提出了8区肺部超声检查方案,这适用于非紧急情况下[13]。为了在紧急情况下快速找出异常区域,Lichtenstein等[44]提出了BLUE方案,指出了胸壁中的三个特定的位置,即“BLUE点”(上部BLUE检查点,下部BLUE检查点和PLAPS检查点)(图2),BLUE点主要用于急性呼吸窘迫病因的诊断,其联合静脉超声,准确率可达90.5%,能够在几秒内排除气胸、ARDS、肺栓塞等危重疾病,PLAPS 点在BLUE方案的第三阶段有意义,当双侧肺前部(即上BLUE点与下BLUE点)超声表现正常,PLAPS点出现异常,提示肺炎;若存在静脉血栓,则提示肺栓塞[10,44]。
二、血管外肺水(extravascular lung water,EVLW)
(一)血管外肺水
血管外肺水过量积聚在临床上被称为肺水肿,其主要病理变化是肺毛细血管静水压增高和血量过多,使毛细血管通透性增加,导致液体以及蛋白质成分从毛细血管内皮细胞间隙溢出[45]。液体过度施用、围手术期中全身炎症反应、肾衰竭、输血产品、心力衰竭等因素都有助于EVLW的液体渗出,影响正常的肺通气功能[46-47]。肺水肿是呼吸衰竭最常见的原因之一,据统计,肺水肿常发生于在ICU中,常导致病死率增加,并且肺水过量对于ICU患者来说是一个巨大负担[48-49],因此及时快速地检测肺水状态并进一步指导治疗至关重要。临床中,常用于获取肺水含量的方法有胸部X线片、CT,中心静脉压或肺毛细血管楔压测量以及经肺热稀释测量,X线片与CT使患者增加了运输、等待的不便和辐射的风险,肺动脉导管的插入和中心线的放置具有侵入性[50]。而肺部超声,无创、精确,快速的优势使其迅速成为评估肺水肿的一种极具吸引力的方法,其主要的可视化表现是B线,由超声束被增厚的小叶间隔或肺泡隔膜反射产生,B线是垂直的高回声伪影,起于胸膜线,一直延续到屏幕边缘而不衰减,其擦除A线,并随呼吸而滑动[13,51],B线作为增加的EVLW的标准,与其它方法相比,表现出很高的灵敏度和特异度(分别为97%,98%),还可预测EVLW患者肺通气状态,明显优于胸部X线片[51-53]。
注:a.将手置于患者前胸部,拇指叠加,左手小指位于锁骨下缘,右手小指边缘平肺下界。上BLUE点位于拇指之间上方三四指根部,下BLUE点位于右手掌中央,这两点主要体现前胸部的病变;b.右小指边缘向后延伸与腋后线的交点为PLAPS点,体现后外侧的病变,这种命名方式避开了心脏
(二)B线评估肺水肿
肺部超声通过识别B线可对肺水积聚进行半定量,即记录在胸骨旁、腋前线、腋中线、腋后线B线的数量,用B线总和表示肺水肿的分数[13,54-55]。有研究表明,重症患者前胸壁肺动脉阻塞压力阈值为18 mmHg时,A线转为B线[55]。Enghard等[51]将50名患者纳入研究,对患者分别进行四区肺部超声方案和经肺热稀释测量,肺部超声检查时,基于每个肋间隙的单个和汇合B线的数量进行超声评分,分数用于量化肺过度水合状态,同时记录50例患者中40例的扫描时间,在操作者和患者对超声图像不知情的情况下,使用PiCCO系统对重症患者EVLW测量,检查者直接计算的超声评分与用其它评估水合状态的方法获得的结果进行比较,包括使用经肺热稀释测量数据计算的血管外肺水指数(extravascular lung water index,EVLWI)和胸内血容量指数,结果显示,超声评分与经肺热稀释测量的EVLWI密切相关(R=0.91,P<0.0001),超声评分>1.5诊断EVLWI高于正常值7 mL/kg的灵敏度和特异度分别为92.1%和91.7%。超声评分>18.5诊断EVLWI>15 mL/kg的严重患者,灵敏度为92.3%,特异度为94.6%。而超声评分与PaO2/FiO2、中心静脉压及胸腔内血容量指数均显示较弱的相关性。因此肺部超声是检测肺水肿一种有效且可靠的工具,四区方案同样是有效的(图3a)。在危重患者肺水肿中,超声通过增厚的肺泡隔膜反射产生特征性回响,表现为B线模式,正常肺组织也会出现B线,一般不超过三条,且多孤立存在,在前区B线三条以上视为异常[13],当多条B线间隔≧7 mm,并相对较规则时,为间质水肿,由增厚的小叶间隔引起(图3b);相反,当多条B线间隔≦3 mm,并拥挤合并时,为肺泡水肿,由肺泡内液体反射形成(图3c),随着肺水的增加B线数量更多,相互融合,呈现一片弥漫性白色状态,称为“白肺”(图3d)[13,56-57]。B线数量反应肺水肿的程度,并从胸部基底部开始按比例上升到顶点[3,58-59]。
(三)终末期肾病(end stage renal disease,ESRD)患者透析前后体液量的管理与评估
在重症监护中经常发生体液超负荷,最近研究表明,体液超负荷将会对预后产生不良影响,甚至与病死率有关增加[60]。因此,控制体液平衡在重症患者管理中至关重要。体液超负荷常常发生于急性肾损伤患者,并且是ESRD患者心血管死亡的主要隐性风险因素[61]。而流体超负荷不良反应最明显的器官之一是肺,可导致肺充血,进一步发生肺水肿[62]。在ESRD患者中普遍存在肺充血同时伴有充血性心衰[63]。在左心功能受损情况下,体液超负荷引起肺充血的发生率增加[64]。此外,肺充血也常发生在ESRD血液透析治疗中,主要是由于肺泡-毛细血管通透性增加,轻-中度的肺充血常常无任何临床症状,增加了患者危重情况的发生,一项未经选择的75名ESRD患者验证研究显示中度-严重充血也会出现在无症状HD患者中,多达57%,这些无症状充血将会影响ESRD患者的生活质量[58,65-66]。

图3 四区超声检查区域与肺水肿超声图像
注:a.四区肺部超声检查的区域;b.B线间隔≧7 mm,称为B7线,提示间质水肿;c.B线间隔≦3 mm,称为B3线,提示肺泡水肿;d.更多B线数量,呈现弥漫性白色状态,称为“白肺”
目前,监测体液体积的方法包括体重变化、生物阻抗谱、B-利尿钠以及下腔静脉直径的测量和肺部超声等。肺部超声是ESRD患者诊断并监测透析前后肺充血的有效工具[67]。在一项研究中,71名接受血液透析的患者在透析前后立即接受肺部超声和IVC超声和生物阻抗光谱检查,肺部超声检查中,在左右半胸的胸骨旁,中锁骨,前腋窝和腋中线的每个区域(共28个区域)肋间隙进行纵向扫查,同时记录每个区域B线数量并计算总和,同时对每个患者均使用身体成分监测仪进行生物阻抗光谱和下腔静脉(IVC)直径测量,以及记录患者透析前后体重变化,结果显示,在透析期间,B线的数量和IVC直径显著缩小,透析前和透析后B线数量变化较大,且B线数量与体液量显著相关。Frassi等[68]通过对每个肋间隙扫并记录B线数目对肺充血进行分级,即缺失<5个B线;轻度≥5到<15个B线;中度≥15到≤30个B线;重度>30个B线。由此可见,肺部超声的另一优势是可以实时动态的方式监测透析过程中B线的变化,这一点优于其它的监测方式。B线也是腹膜透析肺充血的早期标志[69]。慢性血液透中病死率和心血管事件也可通过B线评估充血来预测[70]。
此外,多数学者认为双肾切除以及肾移植术后也会通过全身炎症反应影响肺部毛细血管而导致肺充血[71],通过B线数量变化可早期发现。肺部超声也可用于肺移植后肺水状态的评估,这一结果在一项大鼠试验中得到验证[72]。因此B线可早期发现透析患者的肺充血,进一部监测指导液体管理,并对充血进行分级,辨别严重程度,改善预后,这将对重症监护病房患者管理很有价值。
(四)肺部超声在心力衰竭中的价值
最近研究表明心力衰竭已经成为高患病率,高病死率,高成本的一种疾病[56]。在心力衰竭中常常会发生肺充血[73]。研究观察到无症状的肺充血如果没有适当的控制和治疗,平均将会在4 d后发展为临床充血即肺水肿,最终出现呼吸困难[74]。一项系统性分析显示心力衰竭中肺水肿发生率为51~100%,并指出肺水肿是急性心力衰竭的指标[75]。肺部超声通过B线可作为一种无创、半定量的工具早期检测肺充血,灵敏度与特异度均比胸部摄影高[55,62-64,76-77]。B线的分布与数量联合超声心动图可以鉴别心源性肺水肿与非心源性肺水肿,心源性肺水肿诊断特征是:双侧弥漫性B线均匀分布,胸膜线光滑,肺滑动正常,射血分数降低,左心室舒张末期容积增大[13,78]。在一项研究中[77],笔者统计了近一年的132名心力衰竭患者,所有患者都在常规临床检查后,进行超声心动图和肺部超声检查,肺部超声检查时,在前区和侧区,沿胸骨旁线、锁骨中线、腋前线和腋中线扫描共28区,分别记录每区B线数目(1~10条),汇总B线总数(0~280条),作为超声评分,并随访3个月,记录期间因失代偿及肺水肿入院情况。结果分析显示,B线≥15为肺充血明显的截止值,B线≥30条的患者在120 d内急性肺水肿发生率显著增高,而B线<15条的患者120 d内很少有高风险事件发生。Dwyer等[79]的前瞻性队列研究中,将心力衰竭分为不同表型,即保守性射血分数或减少性射血分数,同高血压患者B线和超声心动图比较,与高血压患者对比,保守性射血分数或减少性射血分数患者表现出更多的B线,更差的心脏结构及心功能测量值,更易发生不良事件。因此,B线可作为慢性心力衰竭患者失代偿和不良事件发生的预测因子[77,79-80]。最近,有研究显示肺部超声联合超声心动图可指导急性心衰的治疗[78]。因此,肺部超声可作为超声心动图及临床有效参数的补助工具,能更全面地诊断心力衰竭患者肺水肿并指导治疗。
(五)肺部超声的补液治疗(fluid administration limited by lung sonography,FALLS)
FALLS是BLUE方案诊断呼吸衰竭之后在急性循环方面的发展和延续,主要用于指导急性循环衰竭(休克)的治疗,在FALLS中首先进行超声心动图检查,排除实质性心包积液及肺栓塞导致的右室扩张[2,81]。心源性休克常伴肺充血,结合BLUE方案,若未出现B线,则排除心源性休克,其余原因为低血容量或分配性休克,此时肺部超声表现为以A线为主,则补液开始,区域从A线为主变化到以B线为主,意味着补液必须终止[10,44,64,81]。因此,利用FALLS可以很好地控制补液量,避免了过度补液。
(六)对B线的分析
国际共识指南中提出[13],B线术语应称为B模式,而不是“肺火箭”或“彗尾”,正常的肺组织也可存在B线,起源于胸膜线,呈局限性、孤立性,或未达屏幕边缘,一般为三条以内,应注意的是,另一种伪像“Z线”易与B线混淆,Z线同样起自胸膜线,相对于B线回声较暗,较短,未达屏幕边缘,不随呼吸运动,A线存在(图4)[82]。通过B线数量总和产生的肺部超声评分可评估和预测呼吸窘迫患者肺通气的变化[38-42]。如前所述,B线可用于肺水状态的评估,需要注意的是,B线并不是肺水肿特有变化,还可见于ARDS、间质综合征,肺炎、肺不张等疾病中[13]。
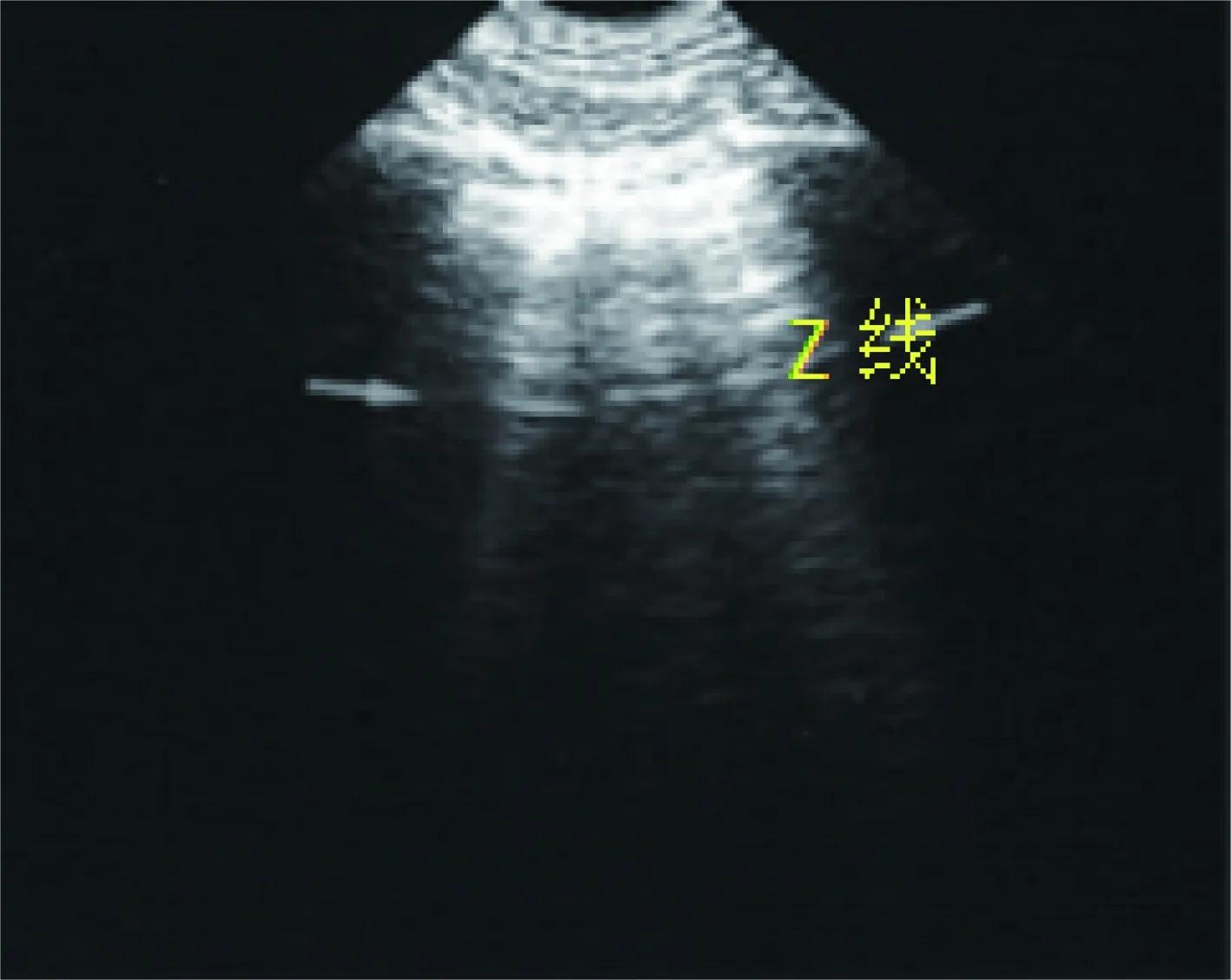
图4 两肋骨之间可见A线(箭头所示)及短小的
B线的分布特征和与其同时出现的征象可以鉴别这些病理变化。这三种超声成像特点即局限性单侧或双侧的B线,肺滑动消失;一侧肺前部明显B线,另一侧肺存在A线;肺前部实变(胸膜下低回声区域、碎片征或类组织样征),不规则的胸膜线均提示肺炎[10,13,81]。双侧三条以上弥漫性非均匀性分布的B线提示肺间质综合征,由于肺间质纤维组织增厚变化使B线呈现B7模式;若同时伴有肺实变,胸膜线异常,A线的减少或消失提示ARDS;前双侧B线均匀分布,胸膜线光滑、肺滑动正常,胸膜下实变缺失,伴有胸腔积液,提示心源性肺水肿,灵敏度97%,特异度95%,结合对利尿剂、硝酸盐等治疗的反应,血液中NT-pro-BNP水平以及超声心动图参数可明确鉴别心源性水肿与非心源性水肿(图5)[10,13,52,73,78]。在BLUE方案中B线的出现可迅速排除气胸,灵敏度与特异度为100%。肺前区正常则提示慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)或哮喘[7,10,13,44]。

图5 心源性肺水肿与ARDS超声图像
注:a.心源性肺水肿,胸膜线光滑,B线均匀分布,无胸膜下实变;b.ARDS,可见B线非均匀弥漫性分布,内见支气管影(箭头所指),胸膜线异常
三、肺炎
肺炎指的是发生于终末支气管、肺泡和肺间质的炎症,大量炎性分泌物充填于肺泡和肺间质中,影响肺部气体交换。肺炎仍然是导致全球死亡的主要原因,尤其在不发达国家,肺部超声在资源有限环境中成为诊断肺炎的有效工具,灵敏度、特异度和准确性分别为94.6%、98.5%、96.1%,高于CXR的77.7%、94.0%、83.8%[83-84]。肺炎在肺部超声的成像特征为:(1)肺实变,表现为胸膜下低回声区域,内见点状或分支状高回声,呈碎片征,随呼吸而运动,此为动态空气支气管影,随着病情变化,可出现类组织样征,这主要取决于空气损失的程度和流体优势。(2)局限性单侧或双侧B线。(3)胸膜下病变,表现为胸膜下低回声结节,形态多样,可为三角形,圆形、线形或多边形。(4)胸膜线粗糙或断裂,肺滑动消失,这与炎性渗出粘连胸膜有关,有时伴有胸腔积液(图6)[13,84-85]。需要指出,首先,肺实变是肺炎的主要特点(灵敏度98%,特异度91%),也是多种肺部病理变化的终点,如ARDS,肺间质综合征,肺不张等[13,84-85]。其次,肺部超声并不能排除未累及胸膜的病变,但有研究指出任何部位的肺实变都会影响胸膜,覆盖率达到98%[13,82]。研究发现,动态空气支气管影提示肺泡实变,特异度为94%,灵敏度为61%,静态空气支气管影提示肺不张[86]。肺部超声的安全性可靠性使其在诊断新生儿(灵敏度86%,特异度100%),婴幼儿及儿童(灵敏度93%,特异度96%)社区获得性肺炎(community acquired pneumonia,CAP)中优于CXR,CAP在超声的可视化特征与成人无差异[85,87]。最近的一项对273例艾滋病病毒阳性患者的回顾性分析显示:肺部超声能够诊断HIV阳性患者的肺孢子虫肺炎,超声均有B线,胸膜下实变和囊性变的特征,前两种灵敏度100%,但特异度均较低,分别为45%,60%,合并囊性变对PCP具有诊断价值,其特异度高达100%,但灵敏度较低57%[88]。此外,一项研究发现,B线评分可鉴别肺部感染与急性LVHR患者肺部感染,作者指出,8分是其阈值,8~12是诊断急性LVHR患者肺部感染的适当范围,显著高于肺部感染患者,>12分不能排除肺间质疾病[89]。

图6 肺炎的超声图像
注:a.可见胸膜线不规则,胸膜下低回声区域,内可见空气支气管影;b.实变区与充气肺之间的碎片征;c.可见大量肺组织实变,回声与脾(S)相似,称为类组织征;d.可见胸腔积液并伴有局限性B线

图7 气胸的超声图像
注:a.可见A线,未见肺滑动;b.为M型模式,由海滨征变为平流层征;c-d.可见出现肺点
四、气胸
正常胸膜腔只有少量液体使壁层与脏层胸膜之间相互滑动,其内出现气体,形成气胸。气胸是急诊医学中常见的危急疾病之一。多项研究已经证实肺部超声在诊断气胸中的有效价值[90-91]。气胸在肺部超声中的可视化征象为:(1)肺滑动消失,灵敏度特异度均为100%。(2)胸膜线与A线存在。(3)B线消失,特异度100%,应注意,大多数正常的新生儿也不具有B线。(4)无肺实变和空气支气管影。(5)出现肺点,存在于正常肺与塌陷肺之间的边界处,在M型模式中,表现为正常肺滑动的海滨征与肺滑动消失的平流层征或条码征之间的交替点,轻-中度气胸存在肺点,重症气胸则肺点消失,这是肺滑动完全消失的结果。(6)肺脉消失,心脏搏动节律通过胸壁组织在超声中的可视化征象,肺脉的存在可以排除气胸,但其消失并不能诊断气胸(图7)[2,13,91-92]。肺滑动消失和无B线高度提示气胸,但也存在于肺气肿,肺大泡中[13]。肺部超声在用于新生儿气胸的诊断中优于胸部X线,灵敏度88%,特异度99%[92]。超声检查气胸的时间2~3 min,明显比CXR快速,因此,在紧急情况下,肺部超声的检查极其重要,有利于患者的预后[93]。
五、肺部超声在其它肺部疾病中的应用
如前所述,静态支气管影、较少的B线、肺脉的出现提示肺不张,与肺泡实变的动态支气管影相区别[89,94]。在Lichtenstein等[10]提出的BLUE方案中,指出双肺前部超声检查正常,结合静脉血栓可诊断肺栓塞,灵敏度81%,特异度99%。目前,超声诊断胸腔积液已经成熟,提供了半定量数据,二维成像模式为四边形征,M型模式为正弦标志,是由呼吸时内脏胸膜或膈膜与胸膜线之间相互运动形成[2]。另外,肺部超声可作为评估术中低氧血症的一线工具,并且肺部超声能够比胸部X线更早发现心胸外科术后及临床术后肺部的并发症[95-96]。最新研究表明,肺部超声表面波弹性成像技术可测量肺组织的弹性特性,以此来评估间质性肺病[97]。
六、总结与展望
肺部超声诊断危重疾病是一个简便准确的工具,BLUE方案和FALLS方案能够快速确诊呼吸窘迫的原因,指导液体循环的治疗,快速改善患者危急状态,在急诊科和ICU中起到重要作用[2,10,44]。但肺部超声也有其本身的局限性,对操作者的依赖是其误差产生的固有来源,对通气变化的监测则需要花费超声医师更多的时间,对新生儿长期的生物效应尚不明确。目前,尚未有研究表明肺部超声在肺气肿、肺大泡以及纵膈气肿方面的诊断价值[14,27]。此外,许多病理变化的超声成像模式之间具有交叉性,在诊断中必须与多种成像模式相结合[13,84,90]。尽管如此,肺部超声即时、简便、快速、安全、经济、可靠,实时动态的优势将会使其成为评估肺部疾病的必要工具,并应用于重症疾病。

