典型农田退耕后土壤真菌与细菌群落的演替
张露琪,张志明,张丽梅,王军涛,*
1 云南大学生态学与环境学院云南省高原山地生态与退化环境修复重点实验室,昆明 650091 2 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085
我国西南地区以山地、丘陵为主,其地形破碎、山地坡度大、土层薄。在该区域进行耕种不仅粮食产量低,而且频繁引发水土流失、山体滑坡甚至泥石流等一系列生态问题[1]。鉴于此,我国于2002年开始在该地区全面实施退耕还林工程以恢复生态环境。云南省作为退耕还林工程的重要省份之一,其退耕强度在西南地区乃至全国都占据了较大比重。随着退耕还林工程的开展,亟需对退耕还林工程的生态效益进行评估,以期为进一步的生态建设工程决策提供科学依据[2-3]。在诸多评价指标中,生物群落的恢复状况是一个重要方面[4]。普遍认为,农田退耕并撂荒以后,地上部植物群落会由草本阶段开始,经灌木群落时期演替到早期森林群落阶段,并最终演替为森林群落后期[5]。而植物群落构建与恢复的这一过程中伴随着生态系统功能的恢复,包括土壤碳固持增加、水土保持能力增强以及栖息地恢复带来的动物种群重建等[6-7]。
作为地下生态系统的重要组成部分,土壤微生物(特别是真菌和细菌)驱动着元素在整个陆地生态系统中的生物地球化学循环[8],在养分元素的获取、致病性与抗逆性等方面与地上部的植物群落存在着极其密切的联系[9-10]。鉴于其重要的生态功能,土壤微生物的群落变化也被认为是评价生态恢复成功与否的重要指标[11]。由于土壤微生物肉眼不可见的特点以及方法学的限制,早期的研究往往以酶活性、生物量等分辨率不高的群落整体指标作为测度参数[12-13]。事实上,无论是功能还是对环境变化的响应,真菌和细菌均存在着明显的差异:前者通过菌丝、菌根等与植物建立更为直接的联系,后者对于根际环境和土壤养分更为敏感;在较大的空间尺度上,真菌和细菌群落都会不同程度地响应地上部植物群落的变化,比如在全球尺度的草原生态系统中,真菌和细菌都随着植物的多样性增加而增加,但真菌与植物的相关性比细菌更强[14]。在冰川前缘随土壤发育过程的初级演替中,真菌和细菌也表现出不同的群落构建策略,前者比后者更易受植物和非随机过程的影响[15]。因此,真菌和细菌的生态位分化可能会影响到对生态恢复的评价结果,应引起足够的重视。
农田退耕后,地上植物群落的演替过程与其在土壤发育过程中的初级演替类似,都是由草本植物群落开始经灌木演替到森林的过程;但不同的是,土壤发育过程中的初级演替是以贫瘠的“岩石-裸地”作为起点,而农田退耕后的演替起点是发育完全、养分丰富的成熟土壤。大量研究表明,农田管理措施如施肥、单一种植等显著改变了土壤微生物的群落组成及多样性[16-17]。这也意味着农田退耕后土壤微生物群落的演替起点是经历了长期人为扰动的群落:失去了肥料的持续供给,对速效养分敏感的土壤细菌可能最先产生响应;不再进行单一种植后,植物的多样性开始增加,真菌可能与植物建立更为密切的联系。而对于这一过程中,土壤真菌和细菌在不同植物群落演替阶段的变化及其最终达到的稳定状态,仍然缺乏足够的了解。因此,本研究在我国西南退耕的典型区域——云南省迪庆州设置退耕还林监测样地,研究农田退耕后土壤真菌和细菌对植物群落演替的响应。通过高分辨率、免培养的高通量测序方法分析土壤总DNA中18S rRNA基因和16S rRNA基因,比较了农田退耕还林后不同演替阶段土壤真菌和细菌群落组成和多样性随着植物群落的变化规律,以期为全面而准确地评价退耕还林的生态效益提供数据支撑。
1 研究区域与研究方法
1.1 研究区域概况
云南省迪庆州地处低纬高原区,气候类型为亚热带与温带季风高原山地气候,平均气温在15℃左右,全年无夏,春季秋季相连,冬季漫长。自然植被以亚热带常绿阔叶林为主,研究区植被以生态保护林和生态经济林为主,其优势树种包括云南松(Pinusyunnanensis)、槲栎(Quercusaliena)及银木荷(Schimaargentea)等。由于地势陡峭加之河水冲刷和自然风化,地形常被分割形成典型的“V”型地貌,高山、河谷、山间盆地交错。坡地开垦为农田后,由于水土流失严重造成土质贫瘠、粮食产量低下,滑坡和泥石流等自然灾害频发。为恢复生态环境,地方政府于2003年起实行逐步退耕还林的措施。
1.2 研究方法
1.2.1样方设置与土样采集
监测样地位于迪庆州维西傈僳族自治县保和镇西北部34公里的白济汛乡澜沧江峡谷(27°21′6″N,99°5′15″E),海拔1700 m左右,土壤类型为红壤。2003年以前,该区域土地利用方式主要为由天然林开垦而来的农田;退耕还林政策实施后,逐步对原有农田进行退耕。由于退耕年限不同,在同一海拔段相邻的区域(约2 km2范围内)同时存在着处于不同植被群落恢复阶段的农田、撂荒草地(退耕2年)、撂荒灌丛(退耕8年,i)、边缘灌丛(ii)等样地,各样地地势均较为平缓,最大海拔差不超过20米;同时,该区域内还存有未经砍伐的天然林(林地i)以及人工林(林地ii),可作为演替顶级对照(表1)。2011年11月,分别在不同植被下设置样方,其中农田设置3个5 m×5 m的样方,每个样方间距10 m;撂荒草地设置3条2 m×10 m的样带,每条样带间距5 m;撂荒灌丛设置3个10 m×20 m的样方,每个样方间距大于10 m;林地内各设置3个20 m×20 m样方。样方内使用“M”形5点采样法,取0—10 cm的表层土壤并混为1个土样,每种植被3个重复,共得到18个土壤样本。剔除根系及石砾等杂物后装入封口袋并用4℃保温箱运抵实验室。新鲜土样带回实验室后充分混匀并过2 mm的筛后放到-20℃冰箱保存,用于土壤总DNA提取。

表1 农田退耕后不同演替阶段地上部植物群落组成
1.2.2土壤总DNA提取、真菌18S rRNA基因与细菌16S rRNA基因扩增
使用MoBio Power Soil土壤DNA提取试剂盒(MOBIO laboratories, Carlsbad, California, USA)提取土壤总DNA。除了细胞破碎步骤替换为“使用FastPrep- 24核酸提取仪在4.5强度下破碎30s(MP Biomedicals, CA, USA)”之外其他所有操作均按照试剂盒标准流程进行[18]。提取出的DNA使用NanoDrop® ND- 2000c UV-Vis分光光度计(Thermo Fisher Scientific, Wilmington, DE, USA)检测浓度与质量后,置于-80℃冰箱保存。
DNA提取液稀释10倍后,使用ABI GeneAmp®9700型PCR仪 (ABI, Foster City, CA, USA)对真菌18S rRNA 基因与细菌16S rRNA基因进行扩增。真菌18S rRNA基因扩增使用的引物为NS1(5′-GTAGTCATATGCTTGTCTC- 3′),NS8(5′-TCCGCAGGTTCACCTACGGA- 3′)[19],20 μL反应体系中包括4 μL 5× FastPfu 缓冲液、2 μL dNTP (2.5 μmol/L),前后引物各0.4 μL(5μmol/L)、0.4 μL FastPfu DNA聚合酶和10 ng 模板DNA(最后加水补至20 μL)。PCR扩增条件为:95℃预热2min,95℃解链30s,55℃退火30s,72℃延长30s(细菌25个循环,真菌30个循环),最后72℃保持5 min。细菌16S rRNA基因扩增使用的引物为563F (5′-AYTGGGYDTAAAGNG-3′),907R (5′-CCGTCAATTCMTTTRAGTTT- 3′)[20],反应体系及条件与真菌的一致。PCR产物经切胶回收和定量检测,加接头建库、等摩尔混合后在454 GS FLX Titanium测序仪上进行测序。
1.2.3生物信息分析及统计分析
原始数据使用QIIME[21]去除barcode、引物及嵌合体(identify_chimeric_seqs.py)后,得到的fasta格式数据以97%的序列相似度聚合为OTU(Operational Taxonomic Unit,可分类操作单元)。细菌和真菌分别获得了280952和115403条高质量序列。OTU 表格转换为biom格式后导入QIIME进行重取样和多样性分析;OTU代表序列使用Silva数据库[22]进行注释和比对。为消除系统误差导致的样本序列数不均匀对多样性统计的影响,使用single_rarefaction.py命令进行重取样,真菌和细菌的重取样深度分别为5826和11124条序列。群落组成分析及多样性分析均在重取样之后97%序列相似度的OTU水平上进行。使用Shannon指数H′表征alpha多样性指数,Bray-Curtis相异性指数BCij表征beta多样性,公式分别如下所示:
(1)
(2)
式中S表示总的微生物OTU数,pi表示第i个OTU占总数的比例;Si和Sj分别代表群落i和群落j中所有OTU的总数量,Cij表示群落i和群落j共有OTU中较小值的总和。
使用QIIME中的upgma_cluster.py脚本对所有样本的Bray-Curtis矩阵进行非加权组平均法聚类(unweighted pair-group method with arithmetic means, UPGMA)。聚类树经由MEGA软件导出。真菌和细菌多样性的相关关系使用Pearson相关系数表征,其中Bray-Curtis矩阵之间的相关性基于Mantel分析实现(使用R软件中的vegan包[23],置换检验次数为999次),并在R软件(www.r-project.org/)中使用ggplot2包完成线性拟合(包含95%置信区间)。方差分析、柱形图及箱式图均在R中完成。
2 研究结果
2.1 农田退耕后不同演替阶段土壤真菌和细菌群落的变化
土壤真菌群落中的优势类群主要包括子囊菌(Ascomycota)和担子菌(Basidiomycota)两大类(图1)。子囊菌是相对多度最高的类群,其在所有样本中所占的平均比例为47.0%;其次为担子菌,在所有样本中的所占的平均比例为17.3%。农田退耕后随着演替的进行,不同阶段的真菌群落组成有较大差异,其中以子囊菌门下粪壳菌纲(Sordariomycetes)和担子菌门下伞菌纲(Agaricomycetes)的变化最为明显:前者相对多度由农田阶段的30%减至林地阶段的10%左右,后者相对多度由农田阶段的5%以下增加至林地阶段的20%以上。此外,子囊菌门下的座囊菌纲(Dothideomycetes)在演替前期的相对多度也明显高于后期。
土壤细菌群落中的优势类群主要包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)等(图1)。其中,变形菌所占比例最高,在所有样本中的平均比例达36.0%;放线菌和酸杆菌在所有样本中的平均相对丰度为16.1%和14.4%;其他类群的比例均在10%以下。除了酸杆菌在农田和林地ii(人工林)土壤中的比例明显低于草地土壤和灌丛土壤外,其他优势类群在不同演替阶段并无明显差异。
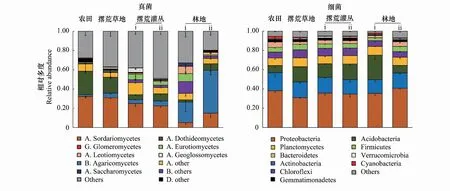
图1 农田退耕后土壤真菌和细菌在不同演替阶段的群落组成变化Fig.1 Succession of soil fungal and bacterial communities after farmland abandonment(phylum level)真菌图例中,A代表子囊菌门Ascomycota,B代表担子菌门Basidiomycota,G代表球囊菌门Glomeromycota,D代表双核亚界Dikarya
通过构建基于Bray-Curtis指数的UPGMA聚类树,进一步在OTU水平上比较了不同演替阶段真菌和细菌群落组成的差异。结果表明,真菌和细菌群落均随植物群落的演替而变化,同一植物群落下微生物群落更为相似,但整体而言真菌群落与地上部植物群落的演替规律同步性更好(synchronism)(图2),即当地上植物群落类型发生更替时,相应地地下土壤真菌群落组成也发生了显著改变。值得指出的是,林地i(天然林)土壤中的细菌或真菌群落均与其他植物群落下的存在较大的差异,表明人为扰动对微生物群落的影响可能在比较长的时间内持续存在。

图2 基于UPGMA聚类树的土壤真菌和细菌群落在退耕农田不同演替阶段的差异比较Fig.2 UPGMA clustering of soil fungal and bacterial communities along the chronosequences of abandoned farmland
2.2 农田退耕后不同演替阶段土壤真菌和细菌多样性的变化
以Shannon多样性指数为测度指标,比较了农田退耕后土壤真菌和细菌的alpha多样性在不同演替阶段的变化。可以看出,真菌多样性在不同的演替阶段之间的变化不甚明显,但整体而言在农田土壤中偏高而林地i(天然林)土壤中偏低(图3)。细菌多样性的变化与真菌相似且更为明显(图3):其在农田土壤中最高,而在林地i(天然林)土壤中显著(P<0.01)低于其他植物群落;农田撂荒后,细菌多样性呈现先急剧下降、然后随着演替过程的推移而缓慢上升的趋势。
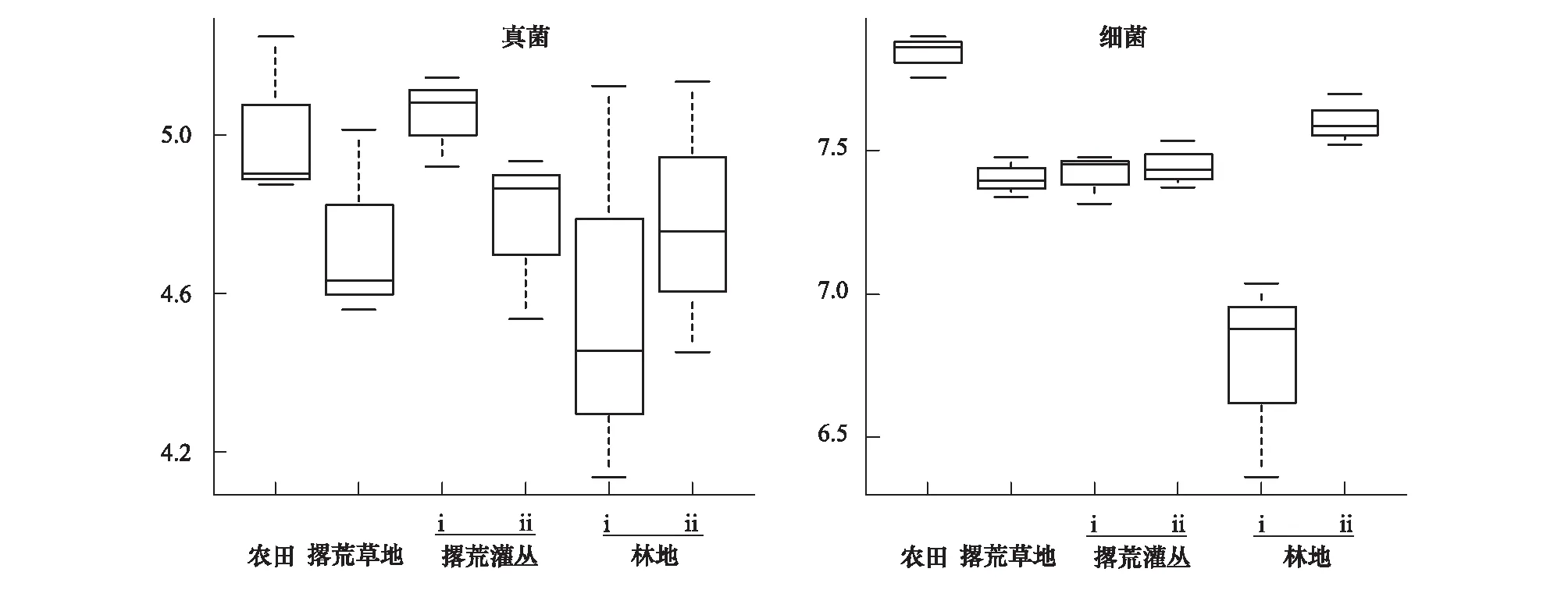
图3 农田退耕后不同演替阶段土壤真菌和细菌Shannon指数的比较Fig.3 Comparison on soil fungal and bacterial diversity at different successional stages of the abandoned farmland as measured using Shannon index
进一步的相关分析表明,细菌和真菌在随植物群落演替过程中多样性的变化趋势基本一致,即当细菌多样性增加的同时,真菌多样性也增加(图4)。其中,真菌alpha多样性和细菌alpha多样性之间呈显著正相关关系(图4,r=0.46,P=0.05),真菌beta多样性和细菌的beta多样性之间呈极显著正相关关系(图4,r=0.69,P<0.01)。
3 讨论
群落的恢复状况是评价退耕还林生态效益的重要指标。通过对土壤真菌和细菌群落组成和多样性的分析和比较,我们初步揭示了农田退耕后地下的微生物群落随着植物群落演替的变化特征。整体而言,农田退耕后土壤真菌的群落组成随植物群落演替的变化比细菌更为明显,其优势类群粪壳菌纲和伞菌纲随着演替的进行分别呈现出减少和增加的趋势。粪壳菌纲作为子囊菌门的重要类群,较担子菌相比具有更高的基因替代速率[24],研究也表明在连续耕种的土壤中粪壳菌纲的相对多度会随着连作年限增加而增加[25],因而其对长期的人为扰动环境可能具有更好的适应能力。而伞菌纲作为担子菌门重要的一类真菌,更多的依赖对木质组分的腐化来获取碳源并拓展生存空间或者通过形成外生菌根与植物共栖[26]。农田退耕之前的人为扰动不利于土壤中木质组分的累积以及植物群落的稳定,退耕后植物残体的累积以及木本植物多样性的增加更有利于伞菌的生长。
农田退耕之后,土壤真菌和细菌的多样性响应植物群落的变化而改变,证明了空间尺度上地上植物和地下微生物的协同变化在时间尺度上同样适用[27]。在随着地上部植物群落的演替过程中,真菌和细菌的alpha和beta多样性都呈现出较好的正相关关系,特别是beta多样性。这一结果说明真菌和细菌对于植物群落演替的响应具有一定的同步性,而土壤真菌和细菌的生态位分化可能导致了二者的差异性。土壤细菌的多样性呈现出明显的先降低再缓慢升高的趋势,与我们的假设基本一致:农田退耕并撂荒以后,人为干扰减弱,土壤养分、特别是N输入剧减,因而对速效养分敏感的细菌响应最为剧烈。真菌的多样性大体也呈现这种趋势,但比之细菌却又有所不同,比如在灌丛的不同阶段其多样性也有所差异,可归因于土壤真菌与地上部植被的联系更为密切。Li等在黄土高原的研究结果与本研究类似:在农田退耕后的演替过程中,真菌的数量随植物群落的演替呈现显著的增加趋势[28]。
值得注意的是,无论在群落组成还是多样性上,作为演替终点对照的天然林土壤中的真菌和细菌均明显区别于其它经历了人为干扰的演替阶段,即包括农药/化肥施用和单一种植在内的耕作扰动可能对土壤微生物群落产生了长期影响。在“历史-生态”的理论框架下[29],这意味着现在的耕种活动作为未来的“历史”,其“遗存”可在较长的一段时间内持续存在,而关于“黄土高原退耕农田土壤细菌的多样性在退耕15—20年后方得到部分恢复”的研究结果一定程度上支持这一假设[30]。通过基于“多样性-稳定性”理论的微生物群落构建模型则可将这一过程进一步细化[31]:微生物群落在扰动压力下较快地达到一个(中间)适应状态(事实上大量研究都表明微生物对外界变化的响应是非常迅速的);当扰动压力消除之后,群落有可能逐渐恢复为原来的初始状态,而这将会是一个漫长的时期,甚至可能滞后于地上植物的群落恢复过程。这一发现可能揭示了地下生态系统经历扰动之后恢复的脆弱性,也强调了在未来的生态保育工作中地下生态系统应引起我们的重视。
4 结论
通过比较农田退耕后不同植被恢复阶段的土壤真菌和细菌群落组成和多样性的变化,揭示了土壤真菌和细菌响应植物群落演替的特征,特别是真菌群落随着植被的变化比细菌群落更为敏感的特点。本研究补充了农田退耕还林后地下生物群落演替的相关内容,有望为准确而完整的评价退耕还林的生态效益提供数据支撑。

