不同表型杉木NIPAs基因的表达分析
王 培, 张家君, 吕蒙蒙, 马志慧, 陈 宇, 林思祖
(1.福建农林大学林学院;2.国家林业局杉木工程技术研究中心;3.福建农林大学生命科学学院,福建福州350002)
镁离子(Mg2+)是细胞中第二丰富的阳离子,对于生命活动具有重要的作用.在植物中,Mg2+参与多种生理反应,比如维持细胞酶活性、调节细胞内阴阳离子的平衡、参与核糖体的聚集、蛋白质合成、叶绿体色素合成和光合作用等活动[1-3].Mg2+作为叶绿素分子的中心原子,在植物缺镁时,最典型的症状就是叶片衰老和萎黄[4],此时植物体内会出现淀粉和蔗糖等物质的积累,同时光合作用减少CO2的固定,进而产生活性氧,活性氧则进一步损害叶绿素和叶绿体膜,导致植物生长发育受阻[5-6].镁的运输主要依赖于镁转运蛋白家族,目前已知的镁转运蛋白包括CorA类Mg2+转运蛋白、P型ATP酶Mg2+转运蛋白、MgtE类Mg2+转运蛋白、Mg2+/H+交换体、Mg2+通道转运体以及其他转运蛋白(MagT和NIPA等)[7].在植物体内,目前研究较深入的主要是CorA类Mg2+转运蛋白MGTs(MRS2s)和Mg2+/H+交换体MHX.有研究表明,在拟南芥中,At-MGT1 与 Mg2+离子结合的亲和力最高[8];而 AtMHX 与 Mg2+、Zn2+和 Fe2+等离子进行质子交换[9].NIPAs蛋白多在哺乳动物中有研究,Goytain et al[10-11]研究表明,NIPA1是与痉挛相关的镁转运蛋白,NIPA2则与镁代谢和肾脏保护有关,对Mg2+具有极高的选择性.
杉木(Cunninghamia lanceolata)是我国南方地区常用的一种经济用速生树种,分布范围较广,具有生长迅速、材质细致、易加工和用途广等特点,在全国林业生产中占有举足轻重的地位.本实验室在对杉木转录组数据进行分析时,发现有5条与镁转运蛋白有关核酸序列,保守域检测结果显示这5条序列属于EamA超家族,具有Mg_trans_NIPA结构域,经bastx在线分析,这些序列与拟南芥的NIPAs具有同源性,故分别命名为NIPA3、NIPA4、NIPA5、NIPA6和NIPA8.在对不同杉木家系进行调查时发现,52号家系有新叶黄化严重的植株,与正常的杉木相比,黄化叶植株长势较差,且植株矮小.镁作为关键的营养元素,在杉木中的研究却少之又少.为了丰富杉木在镁转运方面的研究,本试验以杉木52号家系不同表型杉木幼苗为研究对象,选择Y52(黄化苗)和G52(正常苗)幼苗不同部位的组织为材料,以杉木EF1α为内参基因,采用qRT-PCR技术对幼苗NIPAs基因进行相对表达量分析,同时测定幼苗新叶和老叶的叶绿素含量,探讨杉木镁转运相关的NIPAs基因在不同幼苗中的表达模式与幼苗叶绿素含量的关系,以期为杉木镁转运相关的试验提供依据.
1 材料与方法
1.1 材料
选择福建省尤溪国有林场杉木三代种子园中的52号杉木家系正常苗(G52)和黄化苗(Y52)种子为材料进行育苗,以1年生杉木幼苗(图1B)作为本研究的试验对象,选择幼苗不同组织部位作为试验材料.从顶尖自上向下截取3 cm,收集新叶和新茎;从绿色茎段和褐色茎段节点处自下向上截取3 cm,收集老叶和中茎;从根部与茎的节点处自下向上截取3 cm,收集老茎;所有根须收集备用(图1A).
1.2 方法
1.2.1 幼苗叶片叶绿素含量的测定 取长势基本一致的幼苗的新叶和老叶,分装于离心管中,将2株幼苗相同部位的样品混合均匀,作为1个生物学重复,共3个重复,利用浸提法[12]提取叶绿素.将0.2 g的鲜叶研磨至粉末,转移至5 mL离心管并加入3 mL的80%丙酮充分混匀,静置5 min后离心取上清液.在663和645 nm处测定上清液吸光值,代入公式计算叶绿素a、叶绿素b、总叶绿素含量和叶绿素a/b[13].
1.2.2 总RNA提取和cDNA的合成 分别取2种幼苗的新叶、老叶、新茎、中茎、老茎和根6个部位的组织作为材料进行qRT-PCR试验,将两株幼苗相同部位的样品混合均匀,作为1个生物学重复,共3个重复.按照天根多糖多酚RNA提取试剂盒的方法对0.1 g不同部位的杉木幼苗组织进行总RNA的提取,1%琼脂糖凝胶电泳检测.采用TransScript one-step gDNA Removal and cDNA Synthesis superMix试剂盒合成cDNA用于qPCR扩增.
1.2.3NIPAs基因实时荧光定量PCR分析 本实验室杉木转录组测序得到5条镁转运蛋白家族的编码基因NIPAs(nonimprinted in prader-willi/angelman)的转录本序列,根据此序列设计qPCR特异性引物,选择杉木EF1α为内参基因.以稀释10倍的cDNA为模板进行扩增,PCR反应程序为:cDNA 2 μL,PCR H2O 7.2 μL,superMix 10 μL,引物各 0.4 μL,总反应体系 20 μL;PCR 反应条件为:95 ℃预变性 600 s;95 ℃变性5 s,60℃退火30 s,反应45个循环;60℃延伸60 s.运用2-△△Ct计算方法进行NIPAs基因的相对表达量的分析.以上试验所用到的引物如表1所示.
表1 引物设计Table 1 Primer design
2 结果与分析
2.1 幼苗叶片叶绿素含量的分析
分别测定了黄化苗和正常苗的叶片叶绿素含量,结果表明(表2),黄化的Y52幼苗新叶的叶绿素a、叶绿素b和总含量均显著低于正常型;老叶的叶绿素a含量高于正常型,但叶绿素b和总含量显著低于正常型.与正常型相比,Y52幼苗新叶的叶绿素a减少76.09%,叶绿素b减少90.91%,总含量减少了83.33%;老叶的叶绿素a增加了4.44%,叶绿素b减少了50%,总含量减少了25.74%.以上数据表明,在Y52幼苗新叶中叶绿素a和b都显著减少,尤其是叶绿素b的含量在老叶和新叶中均显著减少,可能因为叶绿素的合成或者叶绿体的发育存在一定的异常.
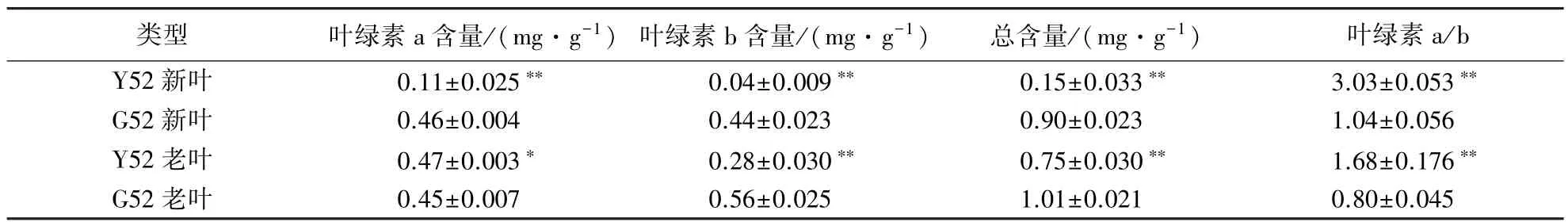
表2 幼苗叶片叶绿素含量1)Table 2 Chlorophyll content in new and old leaves of Chinese fir seedlings
2.2 总RNA提取和cDNA的合成
根据试剂盒试验方法提取杉木幼苗组织RNA,并采用1.0%琼脂糖凝胶电泳法和酶标仪法检测RNA的完整性和纯度.凝胶电泳结果显示,28S和18S条带清晰,说明RNA无降解,完整性良好;D260/280nm的测定值为1.8~2.0,说明无DNA污染.合成cDNA第一条链,以稀释10倍的cDNA为模板进行qPCR扩增.
2.3 NIPAs基因实时荧光定量PCR分析
图2A所示,在G52幼苗中,NIPA3在新叶和中茎部位的相对表达量最高,老茎和根部次之,老叶和新茎中最低;而Y52幼苗中,NIPA3相对表达量的高低顺序则依次是新叶、中茎>新茎>老茎、根>老叶.与G52相比,NIPA3在Y52幼苗的中茎、老茎和根中的表达模式并无明显变化;但在新叶、老叶和新茎中,NIPA3的相对表达量均显著上调,分别增加了56.19%、91.49%和200%,新茎的表达量增幅最大.
图2B所示,在G52幼苗中,NIPA4只在老茎中有较高水平的表达量,其他部位的NIPA4表达水平均较低且基本一致;在Y52幼苗中,NIPA4相对表达量的高低顺序依次是中茎、根>老茎>新叶、新茎>老叶.与G52相比,在Y52幼苗中,老茎中NIPA4的相对表达量显著降低,减少了62.18%,其他部位的相对表达量则无显著变化.
图2C所示,在G52幼苗中,NIPA5在老茎中相对表达量最高,中茎次之,其他部位则相对表达量最低;在Y52幼苗中,NIPA5在中茎和老茎中相对表达量最高,其他部位的相对表达量较低且无显著差异.与G52相比,Y52幼苗除了老茎的NIPA5相对表达量无显著差异,新叶、老叶、新茎、中茎和根部位的NIPA5相对表达量均显著增加,分别增加了129.41%、89.32%、123.71%、87.96%和69.78%.
图2D所示,在G52幼苗中,NIPA6的相对表达量按高低排序依次为中茎、老茎>新茎、根>老叶>新叶;在Y52幼苗中,其相对表达量高低顺序为老茎、根>中茎>新叶、新茎>老叶.与G52相比,NIPA6在Y52幼苗老茎和根的相对表达量异常显著,分别增加了535.68%和556.17%,其增加量高达约5倍,新叶和中茎的NIPA6相对表达量同样有显著增加,分别增加了140.78%和86.91%.
图2E所示,在G52幼苗中,NIPA8的相对表达量在中茎和老茎中最高,其次是根,最低的是新叶、老叶和新茎;在Y52幼苗中,NIPA8相对表达量的高低顺序则是新叶>新茎>老叶、中茎>老茎>根.与G52相比,Y52幼苗各个部位的NIPA8的相对表达量都存在显著性差异,新叶、老叶和新茎中NIPA8均出现上调表达,相对表达量分别增加了151.92%、53.33%和101.05%;中茎、老茎和根中NIPA8均出现下调表达,相对表达量分别减少了54.71%、66.45%和73.63%.
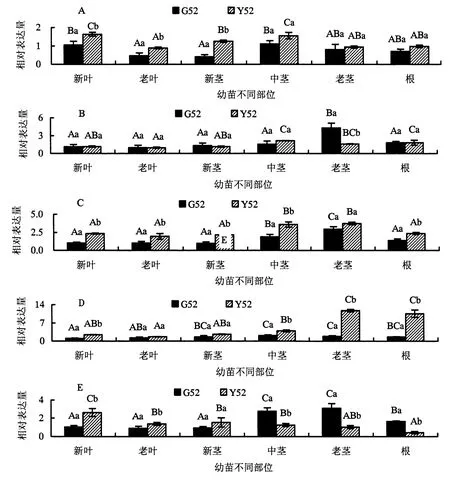
图2 杉木NIPAs基因的相对表达量Fig.2 Relative expression of NIPAs gene in different tissues of Chinese fir
3 结论
本试验为了揭示杉木52家系不同表型杉木幼苗的差异与镁转运蛋白家族基因NIPAs之间的关系,以Y52(黄化苗)和G52(正常苗)幼苗不同部位的组织为材料,选择杉木EF1α为内参基因,采用实时荧光定量PCR技术对幼苗NIPAs基因进行相对表达量分析,以及选择幼苗新叶和老叶进行叶绿素含量的测定.结果表明,Y52幼苗新叶中叶绿素a、b和总叶绿素含量都显著降低;老叶中,叶绿素a含量有所增加,但叶绿素b和总叶绿素含量仍显著降低,可能因为叶绿素的合成或者叶绿体的发育存在一定的异常.在叶绿素合成途径中,镁参与了该途径的酶催反应,而叶绿素b是由叶绿素a经叶绿素酸酯a加氧酶催化转化而成[14].有研究表明[15],镁转运蛋白MGT10对叶绿体的发育和光合作用起着至关重要的作用.所以Y52黄化叶叶绿素含量的减少可能是因为镁运输或者镁转运蛋白出现某种问题所致,而老叶叶绿素b减少,叶绿素a增加,可能是酶活性受到干扰.
实时荧光定量PCR结果显示,在G52幼苗中,NIPA3相对表达量在新叶和中茎中最高,NIPA4相对表达量在老茎中最高,NIPA5相对表达量在老茎和中茎中最高,NIPA6相对表达量在中茎和老茎中最高,NIPA8相对表达量在中茎和老茎中最高.因此,除了NIPA3在新叶中表达,其他的NIPAs基因主要在成熟茎中高表达.Davidassael et al[9]的研究表明,AtMHX在韧皮部高度表达,韧皮部主要的作用是输送营养成分.有研究表明[16],MGT6在维持植物体内镁稳态平衡中扮演着重要角色.所以杉木的NIPAs基因在茎中高度表达也可能是有助于Mg2+自下而上的运输,以维持地上部分的镁稳态.在Y52幼苗中,NIPA3相对表达量在新叶和中茎中最高,NIPA4相对表达量在中茎和根中最高,NIPA5相对表达量在老茎和中茎中最高,NIPA6相对表达量在老茎和根中最高,NIPA8相对表达量在新叶和新茎中最高.因此,NIPAs基因在Y52的不同部位都有高度表达.对G52和Y52幼苗的NIPAs表达差异进行分析,结果表明,NIPA3仅在叶片和新茎中表达量显著增加;NIPA4仅在老茎中表达量显著降低;NIPA5则除了在老茎中表达量无显著变化外,其他部分均显著增加;NIPA6除了老叶和新茎表达量无显著变化外,其他部分均显著增加;NIPA8在叶片和新茎中表达量显著增加,中茎、老茎和根中的表达量显著降低.综上所述,杉木NIPAs具有一定的组织特异性,两种幼苗叶片的差异可能与NIPA3、NIPA5、NIPA6和NIPA8具有一定相关性.而NIPA4和NIPA8在幼苗下半部表达量的降低极有可能会影响Mg2+的吸收与运输,所以导致部分NIPAs在幼苗上半部的高度表达,促使Mg2+向绿色组织运输,维持正常的生命活动.

