紫化茶树UDP-糖基转移酶启动子的克隆及其生物信息学分析
唐秀华, 陈志丹, 陈祖枝, 林子琪, 曹士先, 孙威江,, 谢 凤,3,4
(1.福建农林大学园艺学院,福建 福州350002;2.福建农林大学安溪茶学院,福建 泉州362400;3.福建省茶产业工程技术研究中心,福建福州350002;4.福建茶产业技术开发基地,福建福州350002;5.福安市农业局,福建福安355000;6.武夷星茶业有限公司,福建 武夷山354300)
紫化茶树是一种特色茶树资源,该群体种的芽叶呈紫色或红紫色,其紫化程度与芽叶中的花青素含量紧密相关[1-3].花青素的生物合成涉及到多种酶,糖基转移酶是其中一个关键酶.研究表明,糖基转移酶的活性在一定范围内随着花色素苷的合成而提高,抑制糖基转移酶活性对花青素苷的影响比抑制其他酶更明显[4].UDP-糖基转移酶(UDP-glycosyltransferases,UDPG)广泛存在于植物中,是糖苷键合成的关键酶,属于GT超基因家族,其作用是参与糖基化反应,即催化指定的活化糖基从特定供体转移到特定受体上[5],该反应参与多种化合物的生物合成,包括参与花青素碳骨架的修饰.在花青素的合成中,糖基转移酶决定糖基化的位置,多数花青素的糖基化是通过类黄酮糖基转移酶实现的.作为类黄酮代谢途径中的一个分支途径,花青素的合成途径可分为3个阶段,在第3个阶段中,类黄酮糖基转移酶将无色的二氢黄酮醇转化成有色的花青素,同时增强花青素的化学稳定性、水溶性[6].
启动子是一段能决定基因转录起始的核苷酸序列,其与转录因子之间的相互作用调节和控制了基因的特异性表达,基因转录起始点常常位于5′端UTR的核苷酸序列上游-20~-220 bp区域内[7-9].根据植物基因的表达方式,基因启动子通常分为3种类型,即组成型启动子、组织特异性启动子和诱导型启动子.近年来,通过克隆研究启动子,在减少环境胁迫、诱导基因高效表达等方面有了很大进展[10].深入研究启动子的结构、作用功能对于了解生物反应中信号传递途径和基因调控方式,加深对植物的生长调控机制、提高植物生长质量的探寻十分有帮助,如Pellegrineschi et al[11]用胁迫诱导型启动子rd29A构建载体进行DREB1A/CBF3的表达,大大降低了干旱胁迫对小麦转基因的调控作用.因此,启动子克隆的研究在植物改良基因工程中具有重要意义.目前对糖基转移酶全长cDNA克隆的研究较多,但对糖基转移酶启动子克隆的研究较少,张建军等[12]通过克隆分析拟南芥糖基转移酶基因UGT71C5启动子,发现该启动子是受光效应胁迫的诱导型启动子.目前,在茶树中尚未见对糖基转移酶启动子克隆的研究,因此,本试验选取紫化茶树武夷奇种C18叶片,采用染色体步移技术,获得了UDPG启动子基因序列,并对其生物信息学进行分析,有助于探寻糖基转移酶的表达及其对花青素合成的影响,为培育紫化茶树此类特殊种质资源提供依据,同时为UDPG基因功能的研究提供参考.
1 材料与方法
1.1 材料
供试紫化茶树武夷奇种C18(图1)由福建省武夷山市茶叶研究所资源圃提供.选取茶树第一叶位的叶片,用液氮迅速处理后,置冰箱(-80℃)中保存备用.
主要试剂有Biospin Plant Genomic DNA Extraction Kit(Biospin公司)、TaKaRa Genome Walking Kit(TaKaRa公司)、Gel Extraction Kit(OMEGA 公司)、pMD19-T Vector Cloning Kit(TaKaRa公司)、大肠杆菌JM109感受态细胞(TaKaRa公司).

图1 武夷奇种C18Fig.1 Wuyiqizhong C18
1.2 方法
1.2.1 基因组DNA的提取 按照Biospin Plant Genomic DNA Extraction Kit试剂盒说明书的方法提取基因组DNA.
1.2.2 引物设计 根据在GenBank上已登录的CsUDPG基因(登录号为KR902748),按照TaKaRa Genome Walking Kit试剂盒说明书要求的引物设计原则,使用DNAMAN软件,分别设计3条特异性引物SP1、SP2、SP3(表1).引物合成由北京六合华大基因科技有限公司完成.
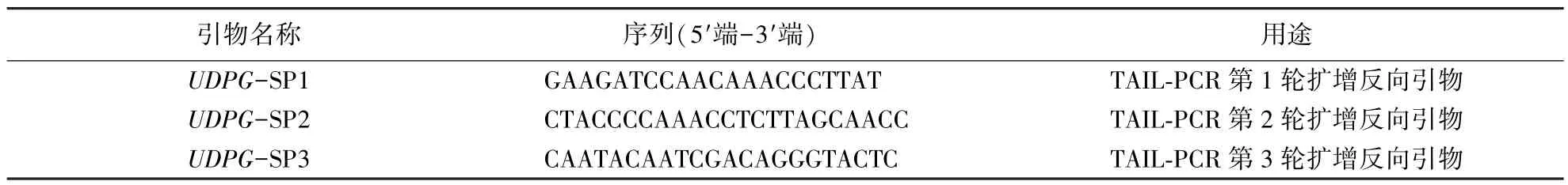
表1 引物序列Table 1 Primer sequences
1.2.3 茶树UDPG基因启动子的克隆 采用特异性引物SP1、SP2、SP3及Genome Walking Kit试剂盒中的兼并引物AP3进行3次热不对称交错PCR(TAIL-PCR)扩增反应[13-15].经1%琼脂糖凝胶电泳,获得特异性目的条带,进行切胶回收,连接至pMD19-T载体,转化至大肠杆菌JM109感受态细胞,于培养箱(37℃)中过夜培养,进行菌落PCR鉴定,获得的阳性克隆菌液送至北京六合华大基因科技有限公司测序.
1.2.4 茶树UDPG基因启动子的生物信息学分析 采用植物顺式作用调控元件数据库(Plant CARE)及植物DNA顺式作用调控元数据库(PLACE)[16]分析预测启动子序列顺式作用元件的种类、所在位置和生物学作用.通过BDGP在线软件预测可能分布的核心启动子区域及转录起始位点[17].
2 结果与分析
2.1 茶树基因组DNA的提取及检测
根据 Biospin Plant Genomic DNA Extraction Kit试剂盒说明书的方法获得紫化茶树武夷奇种C18的基因组DNA(图2).选取条带清晰完整且亮度较大的2号样品为试验样品,利用紫外分光光度计检测其含量为476.7 ng·μL-1,D260nm/D280nm为 1.88,D260nm/D230nm为1.86,均满足试验要求,可作为后期茶树UDPG基因启动子克隆的模板.
2.2 茶树UDPG基因启动子的克隆
以武夷奇种C18的2号DNA样品为模板,将特异性引物 SP1、SP2、SP3分别与兼并性 AP3进行 3轮TAIL-PCR扩增反应,获得近似1 000 bp大小的目的片段(图3),片段大小与预期结果相符.将该片段进行胶回收、克隆及测序.测序结果表明,克隆获得的片段实际大小为1 229 bp(图4),该基因的5′端上游序列与已知的CsUDPG基因序列在327 bp处重叠(图4中的灰色部分),则上游启动子序列大小为902 bp.采用BDGP在线软件进行转录起始位点的预测分析[18].结果表明,茶树UDPG基因的启动子存在2处核心启动子区域,分别位于-778~-728、-373~-323 bp处,分值分别为0.83、0.88,可能的转录起始位点分别为T、A.由于0.88>0.83,推测该基因真正的核心启动子区域很可能位于-373~-323 bp处,位于第-371 bp处的A(图4中的黄色标志处)则为转录起始位点.
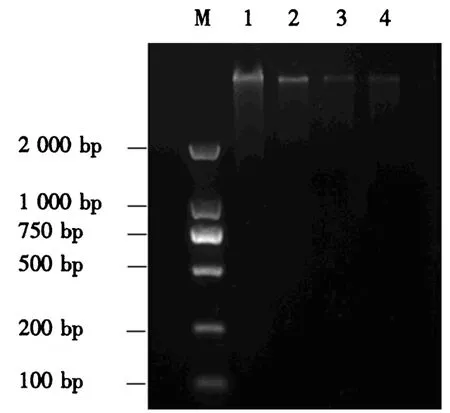
图2 武夷奇种C18 DNA的电泳结果Fig.2 DNA electrophoresis from Wuyiqizhong C18
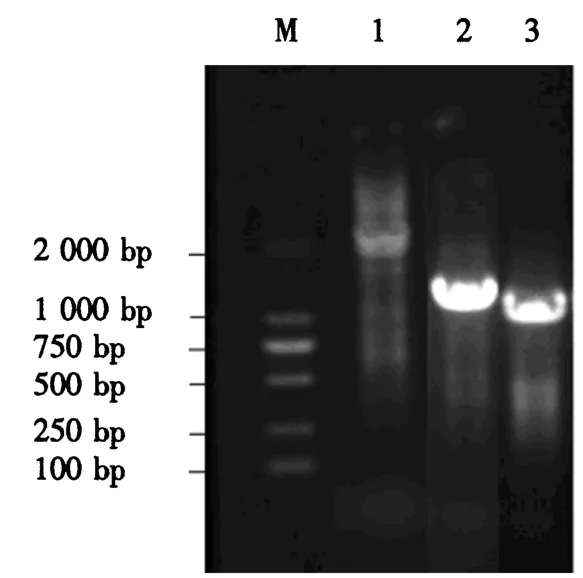
图3 茶树UDPG基因启动子PCR扩增结果Fig.3 PCR products of UDPG gene promoter
2.3 茶树UDPG基因启动子顺式作用元件的预测结果
采用植物顺式作用调控元件数据库和植物DNA顺式作用调控元件数据库[19]进行顺式作用元件预测分析.图5和表2显示,茶树UDPG基因启动子区域含有大量的核心启动子元件,如CAAT-box、TATA-box;除此之外还有多种顺式作用元件,如丰富的涉及光响应的BOX4、CATT-motif、GA-motif、GATA-motif、GT1-motif、TCT-motif,涉及高转录水平的5UTR Py-rich stretch,与分生组织表达相关的CAT-box,涉及胚乳表达的GCN4-motif、Skn-1-motif,涉及防御和应激反应的TC-rich repeats,涉及水杨酸响应的TCA-element,参与特异性表达的as-2-box,参与昼夜控制的circadian.以上分析表明,茶树UDPG基因启动子很可能与组织特异性表达、外界光照条件和茶树体内水杨酸合成有关,这些因素都可能影响调控UDPG基因的表达.
3 讨论
3.1 茶树UDPG基因启动子克隆方法的选择
本试验采用染色体步移技术中的热不对称交错PCR方法克隆了紫化茶树武夷奇种C18UDPG基因起始密码子上游902 bp的启动子区域序列.目前,随着启动子研究的发展,启动子克隆的方法越来越多,但其适用性以及优缺点都不同.热不对称交错PCR适用于5′端序列或全序列已知的基因启动子克隆,虽然需较多引物组合,反应条件要求比较细致精密,但其简单快速、高效灵敏、特异性高、不涉及连接反应,能够快速分离到目标序列.与热不对称交错PCR相比,反向PCR的环化反应难以控制,容易导致非特异性扩增,若限制性内切酶选取不当,容易导致试验失败;锅柄PCR的过程较复杂,难以控制;Y型接头扩增法成本较高,且限制性内切酶的筛选过程繁琐[13,16-18].因此,热不对称交错PCR对于本试验的适用性最好.

图4 茶树UDPG基因启动子的克隆结果Fig.4 Cloning product of UDPG gene promoter

图5 茶树UDPG基因启动子序列及关键元件Fig.5 Promoter sequences of UDPG gene and its key elements
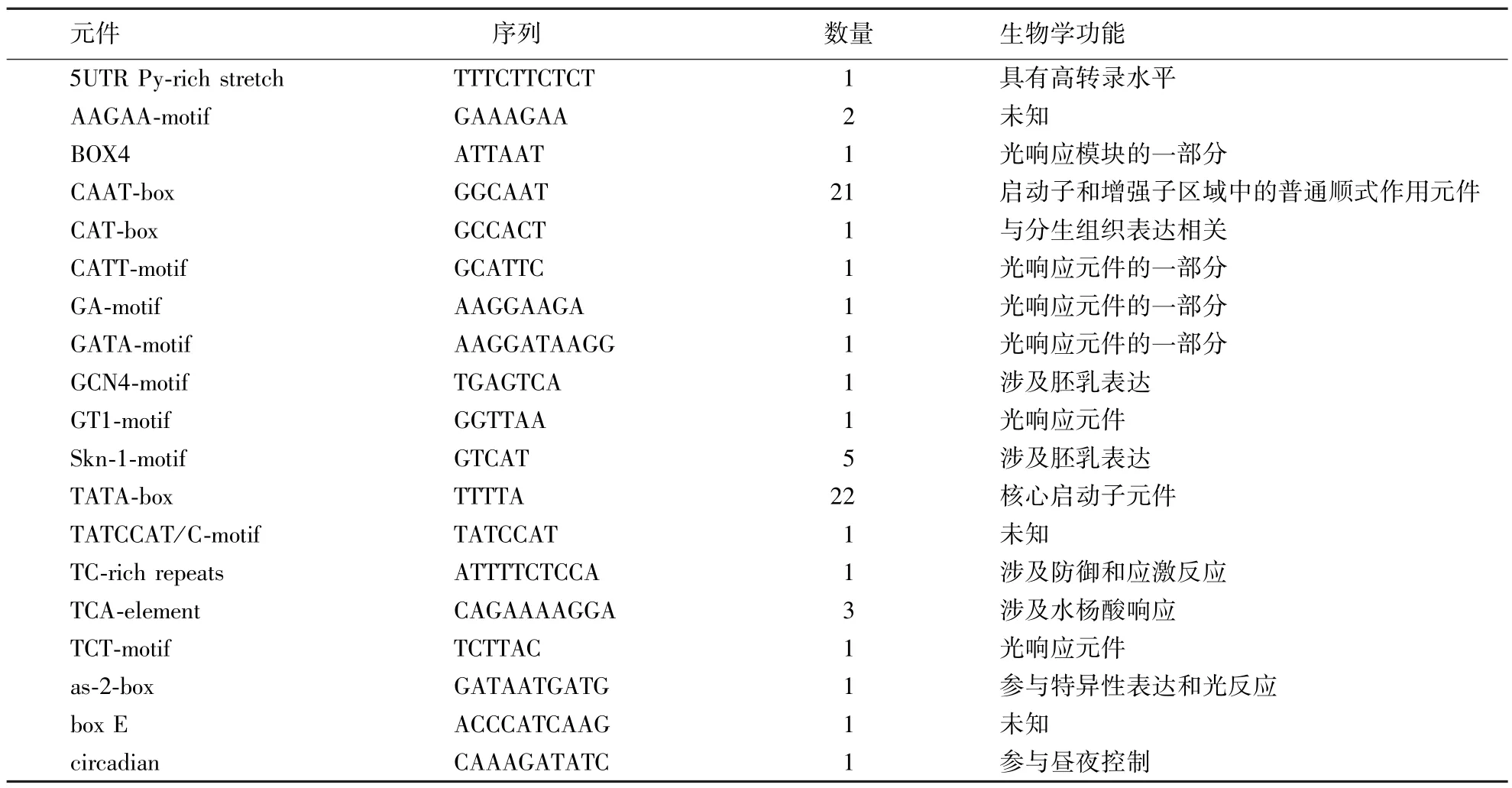
表2 启动子顺式作用元件Table 2 Cis-acting regulatory elements of promoter
3.2 茶树UDPG基因启动子的调控预测
糖基转移酶广泛存在于植物体内,其含量大多比动物体多,因为植物生长会产生多种次生代谢产物,而糖基转移酶直接参与修饰植物许多次生代谢产物的合成或降解,在细胞稳态方面起到了重要作用,因此对UDPG基因的研究具有重要意义[18].目前,相关研究证实了糖基转移酶在植物中的活性及其生物学功能[19-24],但其在茶树中的功能还需要进一步探索.本试验通过软件预测分析了茶树UDPG基因的启动子结构及功能元件,明确了各顺式作用元件的位置及特性.
启动子中存在着多种顺式作用元件,大致分为以下4种类型:核心启动子元件、上游启动子元件、远端上游元件、特殊启动子元件.其中,特殊启动子元件在植物逆境胁迫诱导基因的表达中起关键作用[25].本试验结果表明,茶树UDPG基因的启动子序列具有关键典型的核心启动子元件,有22个TATA-box和21个CAAT-box.CAAT-box对于转录起始的频率起到一定的影响作用,可增强启动子的强度;TATA-box存在于多种真核生物启动子上,具有介导基因转录的作用.研究显示,含有TATA-box的基因对转录调控更加敏感[26].此外,茶树UDPG基因的启动子还包含其他多个特殊启动子成分,如多个光响应元件(GT1-motif、GATA-motif)、水杨酸响应元件[27]、胚乳表达相关元件(GCN4-motif、Skn-1-motif)[28].其中,调控光响应的元件最多,约占1/3,其他顺式元件占比相近.张建军等[12]对拟南芥的糖基转移酶UGT71C5启动子进行了克隆并构建了表达载体,发现该启动子受光照诱导启动表达.可推测茶树UDPG基因启动子可能为诱导型启动子,参与了逆境胁迫下光信号的诱导.以全光照为对照,进一步探寻不同遮阴条件下茶树UDPG基因受光响应的表达调控机制,为优化UDPG基因的表达条件、选育紫化茶树优良种质资源提供依据.

