基于磁性纳米富集DNA及滚环扩增技术检测PBMC内HBV cccDNA临床价值分析*
王友强,郭永灿,兰由玉,魏 聪,刘 鹏
(1.西南医科大学中西医结合学院,四川泸州 646000;2.西南医科大学附属中医医院检验科,四川泸州 646000;3.西南医科大学附属医院风湿免疫科,四川泸州 646000;4.西南医科大学附属中医医院肝病科,四川泸州 646000)
乙型肝炎病毒(hepatitis B virus,HBV)感染呈全球流行性趋势,据统计全世界范围内有近20亿人曾经感染HBV,慢性HBV携带者超过2.5亿[1]。我国是HBV感染最高发国家,目前有超过9 000万慢性HBV携带者,乙型病毒性肝炎(简称乙肝)相关肝硬化、肝癌更是其死亡主要因素[2]。共价闭合环状DNA(cccDNA)通过HBV病毒复制进入宿主细胞核,HBV cccDNA水平较低,但却是HBV复制不可缺少的关键分子:它是HBV前基因组及RNA转录的原始模板[3],可影响HBV对宿主的感染状态,而清除细胞核HBV cccDNA是治愈HBV感染的标志。HBV主要在肝细胞内复制,但对肝细胞之外的其他细胞也具有泛嗜性,单个核细胞是可以被HBV感染的免疫活细胞,有研究显示在外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中能检测出HBV DNA及HBV cccDNA[4]。但是细胞内HBV cccDNA含量低,要获取高纯度HBV cccDNA难度较大,本研究通过磁性纳米富集技术及滚环扩增(rolling circle amplication,RCA)技术测定HBV cccDNA水平,以期构建HBV cccDNA高灵敏度检测方法,并探讨检测PBMC中HBV cccDNA临床意义。
1 资料与方法
1.1一般资料 选择西南医科大学附属医院2016年1月至2018年1月收治的HBV感染者98例为HBV组,其中男62例,女36例,年龄(39.51±7.22)岁,急性HBV感染8例,慢性HBV感染59例,肝硬化23例,肝衰竭8例。诊断标准:所有纳入病例均符合《病毒性肝炎防治方案》[5]。排除标准:(1)妊娠期妇女;(2)人类免疫缺陷病毒(HIV)感染者;(3)甲型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒感染者;(4)需要抗病毒治疗患者曾经使用阿德福韦酯片或恩替卡韦片治疗无效者。同时选择该院100例健康体检者为对照组。所有纳入研究者均知晓本研究目的、过程及意义,签署知情同意书。本研究得到医院伦理委员会支持。
1.2方法
1.2.1标本采集 血液标本:取患者空腹静脉血肝素抗凝、乙二胺四乙酸(EDTA)抗凝各5 mL,肝素抗凝血3 500 r/min离心5 min,取上层血清保存于-20 ℃冰箱,待测乙肝两对半、丙氨酸氨基转移酶(ALT)及天冬氨酸氨基转移酶(AST)。EDTA抗凝血用于提取PBMC。肝组织活检:患者行B超引导下肝穿刺取活检组织,经固定、脱水、包埋、切片等程序后以苏木素-伊红(HE)染色,由有经验的病理学医师独立完成病理分级。
1.2.2HBV感染标志物测定 实时荧光定量PCR检测血清HBV DNA(Applied Biosystems实时荧光定量PCR仪,Thermo公司,美国),用全自动化学发光仪测定血清HBsAg、HBeAg水平(雅培I-2000)。均采用配套成品试剂盒,严格按照试剂盒说明书进行操作。
1.2.3HBV cccDNA测定
1.2.3.1PBMC提取 采用淋巴细胞分离液梯度离心提取PBMC,完成后以0.9%生理盐水洗涤3次,留细胞沉淀,保存于-20 ℃冰箱待测。
1.2.3.2HBV cccDNA提取 首先构建针对HBV cccDNA的特异性探针磁性纳米微球:(1)20 mL氯化铁(FeCl3,1.0 mol/L)与5 mL氯化亚铁(FeCl2,2.0 mol/L)溶液混合均匀加入到250 mL(0.7 mol/L) 的氨水溶液中,离心分离后所得的黑褐色沉淀以超纯水洗至中性,干燥后得到磁性氯化铁(Fe3O4)纳米粒子;(2)以1∶1∶4比例均匀混合Triton X-100、正己醇和环己烷,加入前述方法制订Fe3O4纳米分子,及正硅酸乙酯、氨水(质量分数为28%~30%),持续搅拌24 h后用丙酮破坏乳化,并在一定的外磁场下收集颗粒,即为硅壳磁性纳米颗粒;(3)将链霉亲和素溶液(2.5 mg/mL)加入到5 mg前述方法制订的硅壳磁性纳米颗粒中,在4 ℃下恒温振荡培育24 h,PBS缓冲液洗涤3次,用2%的戊二醛溶液固定纳米颗粒表面的链霉亲和素,再将生物素标记的针对HBV cccDNA特异序列探针通过与修饰在硅壳磁纳米颗粒表面的亲和素偶联,即HBV cccDNA磁性纳米颗粒。以基因组提取试剂盒(Thermo,美国)提取总PBMC内总DNA,严格按照试剂盒说明书进行,分光光度仪260/280吸光度值在1.6~2.0为合格DNA标本,将得到的总DNA用PSAD酶(Plasmid-SafeTMATP-Dependent DNase)酶切消化以除去非cccDNA,-80 ℃冰箱保存备用。利用构建成功HBV cccDNA功能化纳米颗粒富集、分离HBV cccDNA,详细操作参照文献[6]。
1.2.3.3HBV cccDNA检测 RCA:以HBV高度保守区域分别设计8条与HBV cccDNA正链、负链互补的引物(上海生工),序列见表1。RCA反应体系:10×Phi29 DNA聚合酶Buffer 1 μL、引物(R1-R81) 4 μL、DNA 4 μL、ddH2O补足1 μL,总体积:10 μL,经95 ℃ 3 min、50 ℃ 15 s、30 ℃ 15 s、20 ℃ 10 min反应后,再向混合液加入Phi29 DNA聚合酶1 μL(10 U/μL)、10×Phi29 DNA聚合酶Buffer 1 μL、引物(R1-R81) 4 μL、BSA 1 μL(0.4 mg/mL)、4×dNTP混合物3 μL,总体积:20 μL,30 ℃水浴16 h,65 ℃水浴10 min,保留RCA产物。以RCA产物为模板,进行跨缺口引物介导的实时荧光定量PCR反应,引物Prime1:5′-GGG GCG CAC CTC TCT TTA-3′,Prime2:5′-AGG CAC AGC TTG GAG GC-3′,具体操作参照文献[7]。
1.2.3.4标准曲线 选择1×104、1×105、1×106、1×107copies/mL浓度梯度标准品作标准曲线,判断该方法敏感性。
1.3统计学处理 采用SPSS13.0软件进行统计学分析,首先对数据进行正态性分布检验。计数资料采用χ2检验。非正态分布计数资料以中位数描述,采用Wilcoxon符号秩和检验。HBV cccDNA与感染指标采用Spearman秩相关性分析。采用受试者工作特征曲线(ROC)分析HBV cccDNA对抗病毒治疗效果进行预测。以P<0.05为差异有统计学意义。
2 结 果
2.1方法学分析 采用1×104、1×105、1×106、1×107copies/mL浓度梯度标准品做标准曲线分析显示:扩增曲线平行性好、浓度梯度拐点明显、无交叉现象,曲线斜率稳定,敏感性较高。患者HBV cccDNA扩增曲线显示:阳性标本、阴性标本曲线清晰,均为典型扩增曲线,无非特异性扩增曲线,不同浓度阶段曲线分界清楚,见图1。
2.2HBV cccDNA阳性率 98例HBV感染患者中HBV cccDNA阳性61例(62.24%),对照组中HBV cccDNA阳性0例。HBV感染不同病情阶段HBV cccDNA阳性率比较差异有统计学意义(P=0.00),HBV感染伴肝衰竭、HBV感染伴肝硬化患者HBV cccDNA阳性率明显高于急性HBV、慢性HBV感染,其中HBV感染伴肝衰竭阳性率最高,达到100%(P<0.05);急性HBV、慢性HBV感染间HBV cccDNA阳性率比较差异无统计学意义(P>0.05),见表2。
*:碱基硫化
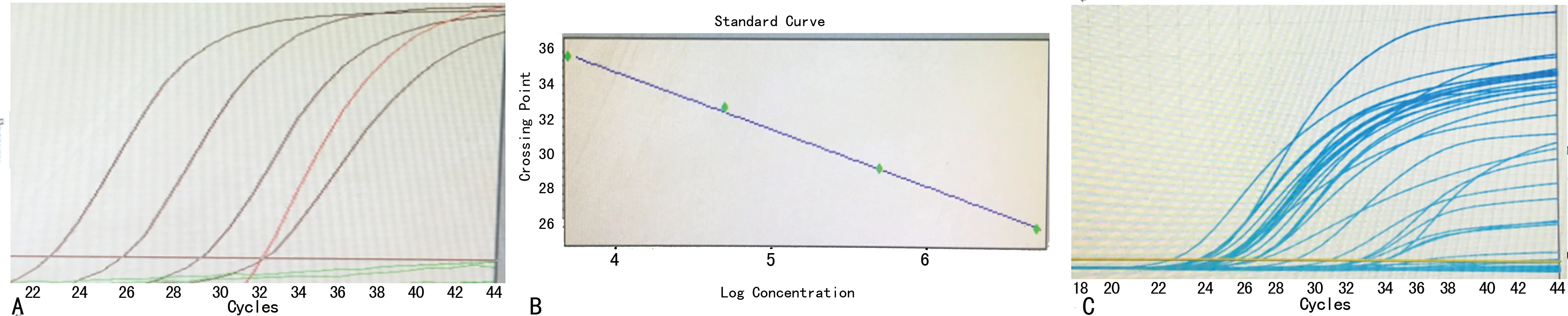
A:标准品扩增曲线;B:标准品斜率;C:标本扩增曲线
图1扩增曲线
2.3不同病理分期及HBV DNA水平患者HBV cccDNA水平比较 经病理活检进行组织炎症活动度分级、纤维化分期,34例患者分期小于G2/S2期,64例患者分期在G2/S2或以上,≥G2/S2期患者HBV cccDNA水平(中位数:5.8 lg copies/mL)明显高于小于G2/S2期患者(中位数:3.7 lg copies/mL),两组比较差异有统计学意义(Z=4.378,P=0.001)。将HBV患者按照HBV DNA水平进行分组,≥1×105copies/mL患者HBV cccDNA水平(中位数:6.2 lg copies/mL)明显高于小于1×105copies/mL患者(中位数:4.1 lg copies/mL),两组比较差异有统计学意义(Z=4.102,P=0.001),见图2。
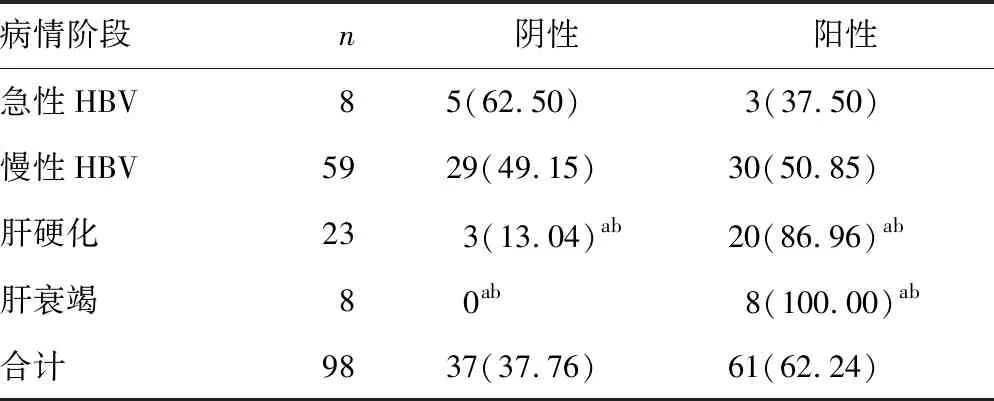
表2 不同HBV感染阶段HBV cccDNA阳性率比较[n(%)]
a:P<0.05,与急性HBV比较;b:P<0.05,与慢性HBV比较
2.4HBV cccDNA与感染指标相关性分析 HBV患者PBMC内HBV cccDNA水平与血清HBV DNA呈明显正相关性(r=0.437,P=0.000),见图3A。HBV cccDNA与血清感染性指标相关性分析显示,PBMC内HBV cccDNA水平与HBsAg呈明显正相关性(r=0.338,P=0.001),见图3B;98例患者中有35例患者HBeAg阳性,HBeAg阳性患者PBMC内HBV cccDNA水平与HBeAg水平呈明显正相关性(r=0.521,P=0.001),见图3C。
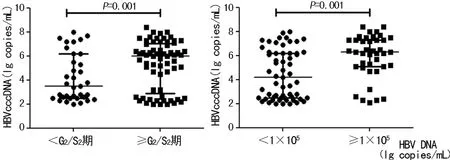
图2 不同病理分期及HBV DNA水平患者
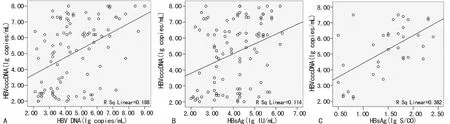
图3 PBMC内HBV cccDNA与感染指标相关性分析
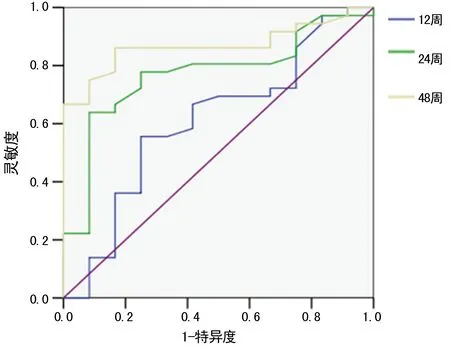
图4 PBMC内HBV cccDNA对抗病毒治疗效果ROC曲线
2.5PBMC内HBV cccDNA对抗病毒治疗效果ROC曲线分析 共有40例患者需要抗病毒治疗,以HBV患者抗病毒治疗后出现病毒应答为标准,分析HBV cccDNA对抗病毒治疗效果判断价值。在抗病毒治疗12周时PBMC内HBV cccDNA量对病毒应答无明显预测作用,ROC曲线下面积(AUC)为0.608(95%CI:0.415~0.800),P=0.268。在抗病毒治疗24、48周时PBMC内HBV cccDNA量可对病毒应答明显预测,AUC分别为0.771(95%CI:0.625~0.917),P=0.005,0.868(95%CI:0.767~0.969),P=0.000。ROC分析提示,在治疗48周时HBV cccDNA为3.2 lg copies/mL时可作为预测出现病毒应答效应的截断面,约登指数达到最大,见图4。
3 讨 论
HBV cccDNA无论在肝脏组织或其他感染细胞内均以较低水平存在,但是其可通过HBV前基因组及RNA转录来调控HBV病毒在宿主内复制。HBV cccDNA的清除预示着病毒在体内生命周期终结,有研究认为清除细胞核HBV cccDNA是治愈HBV感染的标志[3]。在HBV感染、病情监测及治疗相关指标中,单纯检测HBV DNA对临床分析具有局限性,而HBV cccDNA水平测定可弥补不足,二者综合分析会更真实反映宿主体内HBV复制及感染状态,能够为临床提供可靠的治疗依据[8]。PBMC是免疫活细胞,HBV患者出现免疫抵抗能力下降可能与病毒在PBMC内长期复制而导致的免疫功能紊乱有关[9]。HBV持续慢性感染PBMC可能参与母婴垂直传播、肝移植后HBV复发等[10]。PBMC内HBV cccDNA水平与宿主肝脏组织HBV感染、复制情况具有一致性[11],但HBV cccDNA在PBMC内水平较低,受限于检测方法的灵敏度与特异度,目前尚不能作临床常规检测。
国内外学者已建立多种HBV cccDNA检测方法,由于细胞内水平低难以获得高纯度cccDNA,以及与cccDNA具有同源序列的双链DNA(rcDNA)干扰,这些检测方法都难以获得理想的灵敏度[12]。磁性纳米富集技术利用磁性微粒表面功能化基团特异亲和功能,可特异性地实现互补目标单链核苷酸片段的高效快速富集分离,本课题组在前期已经完成该方法特异性纳米颗粒的制备,其性能得到验证[7]。RCA具有很强扩增能力,在单核苷酸多态性、细胞原位分析等微量核酸测定有广泛应用[13],与传统PCR比较,RCA只能在特异性聚合酶作用下扩增环状DNA模板,可有效避免rcDNA对cccDNA扩增的影响。本研究选择磁性纳米富集联合RCA技术来测定PBMC内HBV cccDNA,其扩增曲线清晰、典型,具有稳定的斜率、平行性。
本研究纳入98例HBV感染患者,HBV cccDNA阳性率随着病情进展其阳性率也随之增加,肝硬化、肝衰竭患者PBMC内HBV cccDNA阳性率明显升高(P<0.05)。而高HBV DNA载量患者PBMC内HBV cccDNA拷贝数明显高于低HBV DNA载量患者,HBV DNA也与HBV cccDNA呈明显正相关性(r=0.437,P=0.000),表明HBV DNA复制可能依赖HBV cccDNA,其水平可在一定程度上反映HBV cccDNA存在情况。肝脏组织病理分期是判断疾病进展的重要依据。≥G2/S2期患者PBMC内HBV cccDNA拷贝数明显高于小于G2/S2期以下患者(Z=4.378,P=0.001),提示HBV cccDNA在宿主体内持续存在可能导致疾病进展。HBV cccDNA是HBV DNA复制模板,HBV cccDNA本身不会引起肝组织损伤,但是其通过上调HBV DNA复制增加宿主体内病毒载量,以此激发免疫系统对HBV感染肝细胞进行攻击导致肝脏组织受损,而作为免疫活细胞的PBMC感染HBV可能会加重这种病理应答[14]。
HBsAg、HBeAg是HBV DNA转录mRNA翻译合成的HBV特异性病毒蛋白,其转录、调控及清除机制复杂,HBV cccDNA在此过程中如何发挥作用目前尚未完全阐明[15-16]。本研究结果显示,PBMC内HBV cccDNA与血清HBsAg呈明显正相关(r=0.338,P=0.001),提示PBMC内HBV cccDNA可能会影响HBV表达。有学者认为以血清HBsAg衡量肝组织内HBV cccDNA还需考虑HBeAg状态,本研究发现HBeAg阳性患者HBeAg与PBMC内HBV cccDNA存在明显正相关性(r=0.521,P=0.001)。HBeAg阳性是HBV复制活跃标志,HBV cccDNA在细胞内活动度增加可能会优先上调HBeAg水平[17]。但是HBeAg阴性并不能表示HBV cccDNA或HBV DNA处于非活动状态,因为部分患者存在HBV病毒前C区变异,HBeAg表达受限或不能表达。PBMC作为免疫活细胞,具有丰富的免疫信号传导通路,能够将细胞核内HBV cccDNA遗传信息进行有效输出,影响HBsAg、HBeAg等特异性蛋白表达。
HBsAg阴转被认为是治疗HBV感染的最理想状态,但在实际抗病毒治疗中出现HBsAg完全阴转的病例非常少见,这可能与少量HBV cccDNA能够稳定存在感染细胞内且不易受药物影响有一定关系。细胞内cccDNA是慢性HBV持续感染的最主要原因,并且与抗病毒治疗后复发相关,清除HBV cccDNA也被认为是治疗HBV的根本途径。本研究进一步分析PBMC内HBV cccDNA对HBV抗病毒治疗效果判断价值,结果显示在抗病毒治疗24、48周时PBMC内HBV cccDNA水平可对病毒应答进行判断,在48周时具有最佳判断效果,表明PBMC内HBV cccDNA可以用于评价抗病毒治疗效果,在治疗过程中可将其作为常规监测指标,进一步凸显PBMC内HBV cccDNA检测的临床意义。
综上所述,本研究证实HBV可感染PBMC,利用磁性纳米富集及RCA可检测PBMC内HBV cccDNA。PBMC内HBV cccDNA与HBV疾病进展有一定关系,也与血清HBV DNA、HBsAg、HBeAg水平相关,可作为抗病毒治疗效果判定指标,对HBV患者检测PBMC内HBV cccDNA具有重要临床意义。

