PPAR-α受体激动剂对肝脏缺血再灌注损伤的保护作用*
杨旭堃,申 芹
(四川大学华西第四医院重症监护室,成都 610041)
肝脏部分切除在临床上被广泛用于治疗肝脏外伤、肝脏肿瘤、肝脏内胆管结石等疾病。此外,肝移植还是目前治疗终末期肝脏疾病惟一的有效治疗方式。 肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HI/R)严重制约了肝移植及肝脏切除术的广泛开展[1]。其发病机制复杂,目前尚未完全阐明。既往研究显示,再灌注过程中引起的线粒体凋亡途径广泛激活是导致缺血再灌注损伤的重要因素[1]。过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPAR-α) 是由配体激活的在肝脏广泛表达的核转录因子,可调控脂肪肝等多种肝脏疾病的发病过程,但对缺血再灌注损伤的作用尚不清楚[2]。为此,本实验在成功构建大鼠HI/R模型的基础上,观察PPAR-α激动剂非诺贝特(fenofibrate,FEN)对HI/R的影响,并初步探讨其在HI/R中的可能机制。
1 材料与方法
1.1材料
1.1.1实验动物 40只健康雄性SPF级SD大鼠,体质量(220±30)g,购于四川大学华西医院实验动物中心。
1.1.2主要试剂 PPAR-α激活剂FEN购自北京京丰制药有限公司,PPAR-α抑制剂GW6471购自天津彬馨博澳有限公司;水合氯醛购自武汉谷歌科技有限公司;沉默信息调节因子1(silence information regulator 1,SIRT1)、叉头转录因子1(forkhead transcription factor1,FOXO1)、乙酰化FOXO1(Ace-FOXO1)、裂解型天冬氨酸蛋白水解酶(cleaved-caspase3,C-caspase3)和细胞质中细胞色素C(cytochrome C,CytC)、Bax均购自美国CST公司;β-actin购自美国Abgent公司;TUNEL 试剂盒购买于北京中生有限公司。
1.2方法
1.2.1动物分组及建模 根据OHMORI等[3]方法构建大鼠HI/R模型。按4 mg/kg的10%水合氯醛腹腔注射麻醉大鼠,取上腹部正中切口进入腹腔,充分暴露肝门部,利用无创血管夹钳夹闭门静脉和肝动脉分枝,诱发70%的热缺血,60 min后松开血管钳恢复肝脏血流即行再灌注,120 min肝脏再灌注完成后从门静脉取血2~3 mL,并迅速切取缺血的肝组织,置于-80 ℃低温冰箱保存,具体手术方式参照文献[4]。将40只SD大鼠均分为对照组、模型组、PPAR-α激动剂FEN组(FEN组)和PPAR-α抑制剂GW6471组(GW组),每组10只。FEN组术前1 h给予FEN腹腔注射(50 mg/kg),GW组术前1 h给予FEN (50 mg/kg)+GW6471(3.5 mg/kg)腹腔注射,剂量参考文献[5]。对照组和模型组则给予等量生理盐水腹腔注射。模型组、FEN组和GW组行HI/R损伤,对照组操作同上,但不夹闭门静脉和肝动脉分枝。
1.2.2标本检测 在再灌注后2 h从门静脉抽取静脉血,利用全自动生化分析仪检测血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)水平。收取各组肝脏标本,采用TUNEL法检测肝脏细胞凋亡,利用苏木精-尹红(HE) 染色观察各组肝脏组织病理形态。利用Western blot检测SIRT1、FOXO1、Ace-FOXO1、C-caspase3和细胞质中CytC表达水平,具体方法参考文献[6]。

2 结 果
2.1各组大鼠血清中ALT、AST和ALP水平比较 与对照组比较,模型组大鼠血清中ALT、AST和ALP水平明显升高(P<0.01);经FEN预处理,FEN组HI/R大鼠血清中ALT、AST 和ALP水平较模型组明显降低(P<0.05);而GW组与FEN组比较,HI/R大鼠血清中ALT、AST 和ALP水平明显增高(P<0.05),见图1。

1:对照组;2:模型组;3:FEN组;4:GW组;a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图1各组大鼠血清中ALT、AST和ALP水平比较
2.2各组大鼠肝脏病理形态结构比较 对照组肝小叶结构完整清晰,模型组肝细胞大范围出血坏死,汇管区大量炎症细胞浸润中央静脉,与对照组比较,病理损伤明显增加(P<0.05);FEN组肝细胞水肿变性,未见坏死,散在空泡样变,汇管区可见少量炎性细胞浸润,与模型组比较,FEN组病理损伤明显减轻(P<0.05) ;GW组可见肝细胞广泛肿胀、空泡样变、坏死,汇管区可见较多炎症细胞浸润,与FEN组比较,病理损伤明显增加(P<0.05),见图2。
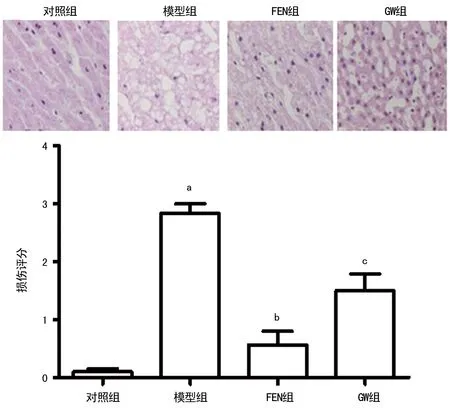
a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图2各组大鼠肝脏组织病理改变(HE,×200)
2.3各组大鼠肝脏TNUEL表达比较 与对照组比较,模型组TUNEL阳性表达率明显增高(P<0.05); FEN组与模型组相比,TUNEL阳性表达率明显降低(P<0.05);GW组与FEN组比较,TUNEL阳性表达率明显增高(P<0.05),见图3。

a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图3各组大鼠肝脏细胞凋亡情况(TUNEL,×100)
2.4各组大鼠肝脏C-caspase3表达水平比较 Western blot检测结果显示,与对照组比较,模型组C-caspase3表达水平明显增高(P<0.05); FEN组与模型组比较,C-caspase3表达水平明显降低(P<0.05);与FEN组比较,GW组C-caspase3表达水平明显增高(P<0.05),见图4。
2.5各组大鼠肝脏细胞质中CytC表达水平比较 Western blot检测结果显示:与对照组比较,模型组细胞质CytC表达水平明显增高(P<0.05); FEN组与模型组比较,细胞质CytC表达明显降低(P<0.05),与FEN组比较,GW组细胞质中CytC表达水平明显增高(P<0.05),见图5。

a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图4各组大鼠肝脏C-caspase3蛋白表达水平比较
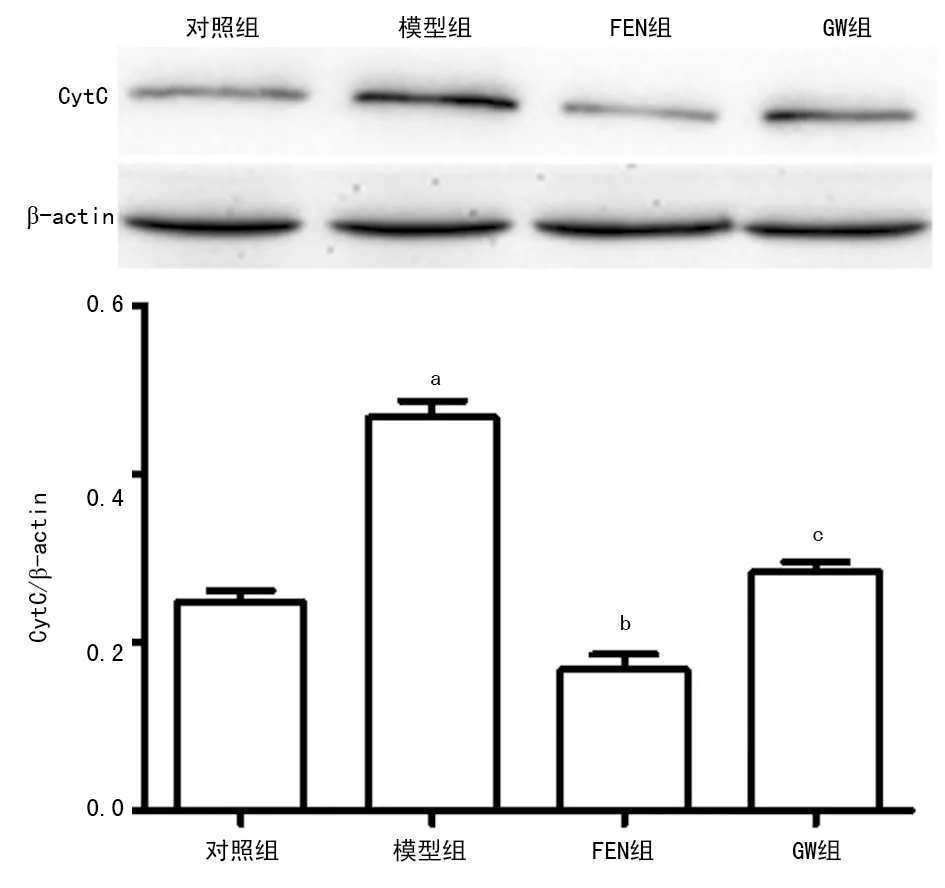
a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图5各组大鼠肝脏细胞质中CytC蛋白表达水平比较
2.6FEN对HI/R大鼠肝脏SIRT1/FOXO1信号通路的影响 Western blot检测结果显示,与对照组比较,模型组SIRT1蛋白表达水平明显降低(P<0.05),而Ace-FOXO1蛋白表达水平明显增高(P<0.05),FOXO1表达差异无统计学意义(P>0.05)。与模型组比较,FEN组SIRT1蛋白表达水平明显增高(P<0.05),而Ace-FOXO1蛋白表达水平明显降低(P<0.05),FOXO1表达差异无统计学意义(P>0.05)。与FEN组比较,GW组SIRT1蛋白表达水平明显降低 (P<0.05),而Ace-FOXO1蛋白表达水平明显增高(P<0.05),FOXO1表达差异无统计学意义(P>0.05)。见图6。
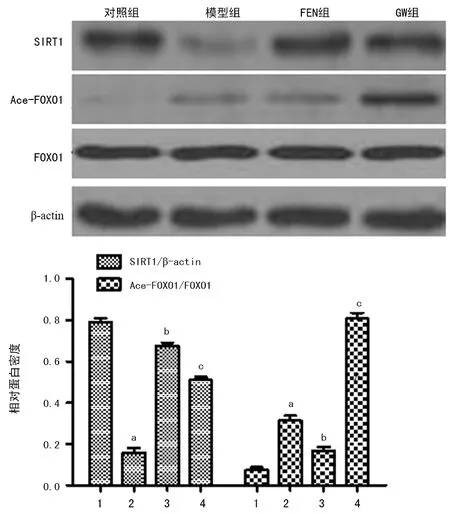
1:对照组;2:模型组;3:FEN组;4:GW组;a:P<0.01,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与FEN组比较
图6各组大鼠SIRT1及Ace-FOXO1等蛋白
表达水平比较
3 讨 论
缺血性肝损伤是临床上常见的肝脏疾病之一,其诱发的肝脏功能受损乃至肝脏功能衰竭发生率较高[1-2]。肝脏缺血发生后,及时恢复缺血区肝脏血流是减少肝脏受损最有效的治疗方案,但缺血肝组织恢复肝脏血流灌注后,伴随大量活性氧产生,继而导致肝脏细胞凋亡和坏死加重,这种临床现象称之为HI/R[1-2]。目前对HI/R的防治手段极其有限,因此,寻找有效治疗药物具有紧迫而重大的临床现实意义。
FEN是PPAR-α激动剂之一,在临床上广泛用于降血脂[3]。研究显示,PPAR-α激动剂FEN除具有降脂的活性外,还具有抗氧化、抗癌、抗炎及抗凋亡等多种生物学活性[3]。最近研究发现,PPAR-α激动剂对心、肠、肾等器官缺血损伤具有保护作用,但对HI/R的作用及机制尚不清楚[7]。此外,PPAR-α特异性阻断剂,如GW6471可反转PPAR-α激动剂对器官缺血损伤的保护作用[8]。因此本研究拟探讨PPAR-α激动剂非诺贝特对HI/R的保护作用及其相关作用机制。
在OHMORI等[3]构建的经典HI/R模型中,HI/R可导致大鼠肝功严重受损和肝脏病理改变。本研究结果显示HI/R可导致血清中急性肝损伤指标如ALT、AST和ALP表达水平增高及肝脏病理形态改变,与OHMORI等[3]的研究结果一致,提示本研究构建大鼠HI/R模型成功。而PPAR-α激动剂FEN预处理可明显减少ALT、AST和ALP表达水平,而肝脏病理损伤及PPAR-α特异性阻断剂GW6471可反转FEN的上述作用,提示PPAR-α激动剂对HI/R保护作用,其作用机制与激活PPAR-α相关。
细胞凋亡是受基因严密控制的程序化细胞死亡,是细胞死亡的一种重要形式,是可反映机体器官受损的一个重要指标[9]。既往研究显示,线粒体介导的肝脏细胞凋亡是HI/R的重要致病机制[1]。caspase9是线粒体凋亡途径中的启动子及重要关联蛋白[10]。当线粒体凋亡途径被缺血再灌注损伤激活时,位于线粒体中的CytC迁徙到细胞质,与线粒体凋亡诱导因子(AIF)等形成凋亡体。该凋亡体可与caspase9结合,在ATP的作用下,可促进caspase9转化为活化的caspase9,然后活化的caspase9可呈级联反应促进caspase3降解和C-caspase3表达增高,然后导致细胞凋亡[11]。因此C-caspase3、TUNEL及细胞质中CytC表达的高低可反映线粒体介导凋亡信号途径的强弱。结果显示,与GW组和模型组相比,FEN组C-caspase3、TUNEL及细胞质中CytC表达明显降低,提示PPAR-α激动剂FEN可通过抑制线粒体凋亡信号途径激活减轻HI/R。
SIRT1是一组蛋白脱乙酰化修饰酶,其活性主要依赖于烟酰胺腺嘌呤二核苷酸(NAD+),大量研究显示其具有调节细胞代谢、分化、凋亡和抗衰老及减轻HI/R的重要作用,其转录底物包括FOXO1,p53和Ku70等[12]。本课题组既往研究显示,其抗凋亡的信号途径为促进转录因子FOXO1去乙酰化,继而减少线粒体凋亡信号途径的激活和细胞凋亡[12]。本研究结果显示,与GW组和模型组相比,FEN组SIRT1表达增高,而Ace-FOXO1的表达降低。提示PPAR-α激动剂FEN可通过增加SIRT1的表达而减少FOXO1的乙酰化修饰,从而抑制线粒体凋亡途径的激活。
综上所述,PPAR-α激动剂FEN对HI/R具有保护作用,而SIRT1/FOXO1 信号通路抑制线粒体介导的凋亡信号途径在其肝脏保护作用中起重要作用,该研究为临床上应用PPAR-α激动剂治疗缺血性肝损伤患者提供了新的理论依据。

