结核分枝杆菌吡嗪酰胺异质性耐药研究
王 鸿,徐 鹏,陈 玲,曹志敏,袁 阳
(1.遵义医科大学附属医院 呼吸二科,贵州 遵义 563099;2.遵义医科大学 医学与生物学研究中心,贵州 遵义 563099)
结核病(Tuberculosis,TB)是结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)感染引起的慢性传染病。随着耐药结核病的出现,全球结核病疫情日益严峻。据2018年世界卫生组织(World health organization,WHO)估算,2017年全球约有1 000万新发结核病病例,耐多药结核病(Multidrug-resistant tuberculosis,MDR-TB)病例约46万[1]。
吡嗪酰胺(Pyrazinamide,PZA)是重要的抗结核治疗药物,临床上用于治疗敏感及耐多药结核病,与其它抗结核药物联用可显著缩短抗结核病化疗疗程。PZA需在酸性条件下,由结核分枝杆菌pncA基因编码的吡嗪酰胺酶(PZase),转化为吡嗪酸(Pyrazinoic acid,POA),才能发挥杀菌活性。pncA突变导致的PZase活性降低或丧失,是结核分枝杆菌产生PZA耐药的主要机制[2]。通过pncA基因测序,检测PZA耐药性的方法,其特异性及敏感性均超过90%[3-6]。虽然传统培养为基础的表型药物敏感试验(Drug sensitivity test,DST)是检测结核分枝杆菌耐药的金标准,但PZA表型药物敏感试验需要的酸性培养条件,本身会抑制细菌生长,另外影响pH变化的诸多因素(如接种量等),均可导致假阳性或假阴性结果[7-8]。因此,许多研究特别是PZA耐药率的调查都采用检测pncA突变的分子药物敏感试验[9-10]。
了解药物的耐药情况,对于临床制定科学合理的结核病治疗方案、增加治愈率、减少复发率尤为重要。近年来,异质性耐药现象,由于常被误诊为敏感导致治疗失败,逐渐被学界重视,该现象是敏感株与耐药株共存产生的部分菌株敏感部分菌株耐药的现象[11-12],因此,通过检测是否同时存在敏感和耐药基因型即可进行判断。由于多重感染造成的异质性耐药往往是当地结核病严重传播的表现,而由于耐药突变产生的异质性耐药则是治疗过程中产生的获得性耐药,显示细菌群体正由敏感菌株向耐药菌株转变的过程。本研究针对治疗结核病的重要药物PZA,通过pncA基因测序,研究临床菌株PZA耐药率、分析异质性耐药水平及其产生原因,为治疗方案的制定和调整提供参考依据。
1 材料与方法
1.1 研究对象 本研究对2011~2016年遵义医科大学附属医院收集的184株结核分枝杆菌临床分离株进行研究。
1.2 比例法药物敏感性试验 为了解结核分枝杆菌耐药性,根据《结核病实验室检验规程》[13],使用比例法对异烟肼(isoniazide,INH)、利福平(rifampicin,RFP)进行耐药性鉴定。若RFP和INH都敏感则判定为全敏感,RFP耐药INH敏感则判定为单耐RFP,RFP敏感INH耐药则判定为单耐INH,RFP和INH都耐药则判定为MDR。
1.3pncA基因测序及异质性耐药分析 应用CTAB法对培养菌株提取DNA[14]。使用pncA-F、pncA-R引物扩增pncA基因(pncA-F:5’-GCTGGTCATGTTCGCGATCG-3,pncA-R:5’-GCTTGCGGCGAGCGCTCCA-3’) ,产物大小为681bp。PCR反应条件:94℃ 5min;94℃ 30s,60℃ 30s,70℃ 30s,32个循环;72℃ 10min。PCR产物送上海英潍捷基公司测序。测序结果以H37Rv序列作为参比序列,使用Lasergene软件进行对比分析,鉴定突变位点。所有pncA基因突变(除了同义突变)菌株都判断为PZA耐药,如果存在野生和突变序列共存,则判定为PZA异质性耐药。
1.4 结核分枝杆菌9位点VNTR基因型分型 为寻找异质性耐药原因,鉴定异质性耐药菌株是否存在混合感染和潜在的交叉污染,采用TB Typing Kit VNTR-9(9位点分别为QUB-11b、QUB-18、QUB-26、MIRU26、MIRU31、MIRU40、Mtub21、Mtub04、VNTR233)试剂盒(康为世纪公司),按试剂盒使用说明书进行VNTR基因分型。
2 结果
2.1 吡嗪酰胺耐药与异质性耐药的比例 通过对184株临床结核分枝杆菌(全敏感106株,单耐RFP 1株,单耐INH 3株,MDR 74株)pncA基因测序,共发现49株PZA耐药(见表1),PZA耐药占比为26.6%(49/184),其中6株为全敏感菌株,41株为MDR菌株,分别占全敏感和MDR菌株的5.7%(6/106)和55.4%(41/74),MDR菌株的PZA耐药占比显著高于全敏感菌株(P<0.01),MDR菌株同时PZA耐药的风险较敏感菌株高出近21倍(Odds ratio,OR=20.71),95% 置信区间(Confidence interval,CI)为7.67~63.81。通过分析测序图谱,共发现10株存在突变和野生序列共存的现象(见图1),判定为异质性耐药。在49株PZA耐药菌株中,总体异质性耐药占比为20.4%(10/49),其中全敏感和MDR菌株的PZA异质性耐药比分别为66.7%(4/6)和14.6%(6/41)(见表1),全敏感菌株的异质性耐药比显著高于MDR菌株(P<0.01),全敏感菌株是PZA异质性耐药的危险因素(OR=11.67),95%CI为1.24~114.21。
表1吡嗪酰胺耐药与异质性耐药构成比

耐药程度总例数PZA耐药(n)PZA耐药比(%)异质性耐药(n)异质性耐药比(%)∗全敏感10665.7466.7单耐RFP11100.000.0单耐INH3133.300.0MDR744155.4614.6合计1844926.61020.4
*:异质性耐药比例(%)为在PZA耐药菌株中,异质性耐药的比例,即PZA异质性耐药数/总耐药数×100%。
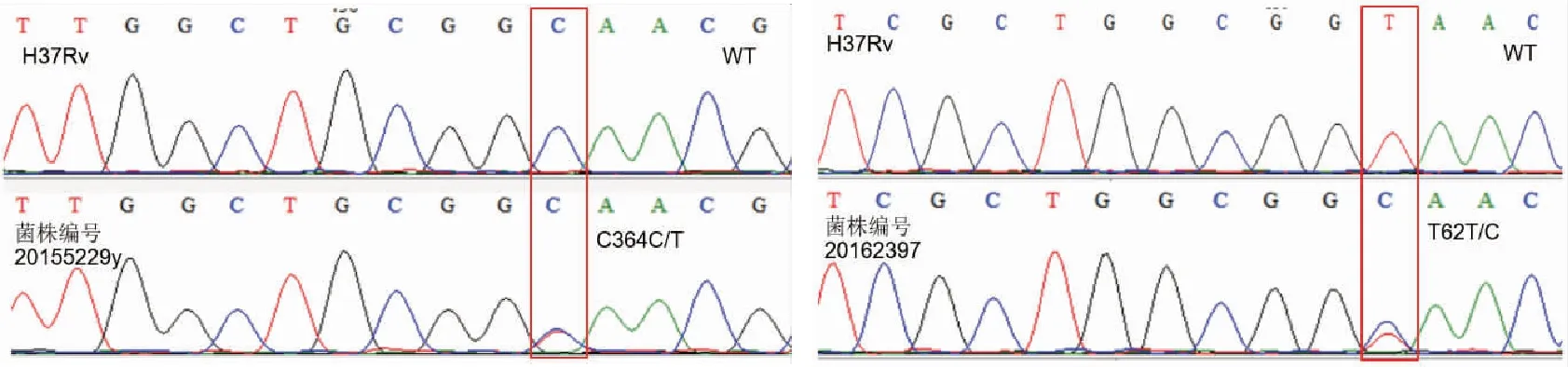
图1 异质性耐药菌株pncA基因测序结果
2.2 吡嗪酰胺异质性耐药的pncA突变类型 在10株异质性耐药菌株中,有2株样本同时存在2个pncA基因突变,其余8个样本均只含有1个突变,其中2株突变位点相同,因此,共有11种pncA基因突变类型,其中一个为终止突变,其余都为氨基酸改变的非同义突变(见表2)。为了进一步评估这些突变与PZA耐药的关系,通过查阅文献,发现绝大多数突变(63.6%,7/11)都已有报道与PZA耐药相关。
表210例吡嗪酰胺异质性耐药菌株pncA基因突变结果

菌株编号表型DSTa核苷酸突变类型氨基酸突变类型与本结果相关的文献b201510664y全敏感A226A/CT76T/P[15,16]T416T/CV139V/A[15]20162397y全敏感T62T/CcV21V/A[17]20154449y全敏感A170A/GH57H/R[18]20162937y全敏感C205C/GcP69P/A[19,20,21]20140617MDRC425C/TT142T/M[22,23]2011057MDRG109G/AcE37E/Kc本研究T134T/GV45V/G[24]201510579yMDRA212A/GH71H/R[25]20155229yMDRC364C/TcQ122Q/stopc本研究20162407yMDRG304G/AA102A/T[26]20155078MDRT62T/CcV21V/A[17]
a:DST(drug sensitivity test,药物敏感试验);b:本研究结果相一致的参考文献;c:本研究新发现的核苷酸和/或氨基酸突变。
2.3 结核分枝杆菌9位点VNTR分型 为分析PZA异质性耐药菌株是否存在多重感染或实验室交叉污染,本研究对异质性耐药菌型进一步进行9位点VNTR分型。结果显示,所有菌株均为单一基因型,因此排除了多重感染和实验室交叉污染的可能。
3 讨论
PZA可以杀死休眠或半休眠的结核分枝杆菌,是缩短结核病疗程、提高治愈率、降低复发率的重要药物。为研究临床PZA耐药水平及异质性耐药情况,本研究对临床收集的184株结核分枝杆菌进行pncA基因测序。结果显示,49株存在pncA突变,突变占比为26.6%(49/184),其中多数突变株为MDR菌株(41/49,83.7%);通过分析测序图谱,共发现10株存在异质性耐药现象,占突变总数的20.4%(10/49)。进一步9位点VNTR检测,结果显示所有异质性耐药菌株都为单一VNTR基因型,排除了实验室交叉污染,且不存在多重感染的可能,因此,这些PZA异质性耐药现象显示了治疗过程中,病人体内的细菌群体,由敏感菌株向耐药菌株过渡的过程。
由于PZA的表型药敏必须在酸性条件(pH值5.5~6.0)下进行,导致该方法的准确性和重复性较低,以检测pncA耐药突变为基础的分子药敏试验,由于敏感性和特异性都超过90%,是大范围筛查PZA耐药的有力工具[7]。由于PZA的耐药突变,散布于整个561 bp的pncA基因,因此本研究使用pncA基因测序的方法研究PZA耐药水平及异质性耐药情况。测序共发现11种pncA突变类型,其中7种已在PZA耐药菌株中多次报道,剩余4种新突变中,有2种在相同密码子的突变也已报道与该药物耐药相关,另有一种可能对酶活性产生重要影响的终止突变(Q122Q/stop)(见表2),显示本研究检测的绝大多数pncA突变都与PZA耐药性相关。
根据耐药菌产生原因,结核分枝杆菌耐药可分为两类:一类为原发性耐药,是指由于感染耐药结核分枝杆菌导致的耐药;另一类为获得性耐药,是指在结核病治疗过程中由于药物压力筛选出耐药菌株导致的耐药。因此,敏感菌株和耐药菌株共存的异质性耐药现象,其产生原因主要有两种,一种是由于多重感染,即患者同时感染敏感菌株和耐药菌株;另一种是在药物压力下新筛选出的获得性耐药菌株,耐药细菌群体不断扩增,正在由敏感菌株向耐药菌株转变的中间状态[27]。目前检测异质性耐药的方法主要有DNA直接测序法、分子线性探针法、全基因组测序等。直接测序可以鉴定特定位点突变,但只能测定单个基因型,且敏感性低[27-28];分子线性探针法对常见耐药基因的检测具有较高敏感性、特异性,但其受探针数目的限制,检测覆盖的区域较短,可能出现假阴性[29];全基因组测序可检测所有基因突变位点,敏感性高,但是其成本高,数据分析复杂,不适用于临床检测[27,29]。研究异质性耐药产生原因,对于控制异质性耐药尤为重要,对于混合感染引起的异质性耐药,应加强疾病预防和控制,切断传染源,减少传播,提高人体免疫力;对于治疗过程产生的异质性耐药,则应在贯彻DOTs策略的同时,设计合理有效的治疗方案,减少获得性耐药的产生[30]。本次对184株临床样本研究发现,PZA耐药占比为26.6%(49/184),其中异质性耐药占比为20.4%(10/49)。为探明异质性耐药产生原因,对所有样本进行了9位点VNTR基因分型,显示所有样本都为单一VNTR基因型,因此排除多重感染或实验室污染的可能。由此可见,本研究检测的所有PZA异质性耐药现象均为在治疗过程中产生的获得性耐药,提示应该优化治疗方案,提高患者的依从性。
认识本地区不同耐药类型菌株中PZA异质性耐药风险,对于指导临床用药有着重要意义。本研究进一步分析发现,在49株PZA耐药样本中,全敏感菌株(RFP和INH敏感)的异质性耐药占比为66.7%(4/6),而MDR样本中为14.6%(6/41),显示与MDR菌株相比,敏感菌株更易产生PZA异质性耐药(P<0.01)。与其它研究结果类似,本研究显示,在MDR菌株中PZA的耐药占比较高,达55.4%,因此对于MDR患者的治疗方案,应谨慎使用PZA;而对于全敏感菌株,PZA的耐药占比较低,仅为5.7%,但其中异质性耐药占比却较高,达66.7%,表明在初始治疗阶段绝大多数的敏感结核病患者可以使用含有PZA的治疗方案,但在治疗过程中发生PZA异质性耐药的风险较高,应当定期监控该药物的耐药情况,及时根据耐药性的变化调整治疗方案。

