淫羊藿次苷Ⅱ抑制慢性脑低灌注大鼠海马PDE 4、PDE 5蛋白表达及TGF-β1/Smad2信号通路
邓 艳,尹彩霞,高健美,龚其海
(1.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;2.遵义医科大学 药学院,贵州 遵义 563099)
血管性痴呆(vascular dementia,VD)是指由缺血性、出血性、急慢性缺氧性脑血管病等因素导致脑组织损害引起的以认知功能减退为特征的一组临床综合征,是仅次于阿尔茨海默病的第二大痴呆类型,约占所有痴呆的17%~20%[1]。目前,临床上治疗VD的方法主要有:①预防性治疗原发性脑血管病;②治疗脑功能障碍;③改善脑组织代谢[2]。但这些药物只能控制部分症状,疗效有限,原因可能与其作用靶点单一,无法对脑缺血后复杂的病理生理反应提供全面、有效的保护有关。因此,探索VD的发病机制,寻求有效的治疗方法迫在眉睫。
目前,关于VD的危险因素及确切的发病机制尚不清楚。有研究报道,慢性脑低灌注(chronic cerebral hypopermsin,CCH)是认知功能减退和血管性痴呆发生的关键原因[3]。CCH可导致营养物质供应减少、血脑屏障破坏、氧化应激反应、炎性反应等,进而引起神经元功能损伤、轴突破坏、突触丢失等一系列病理变化,最终使患者出现不同程度的记忆功能障碍[4]。因此,研发防治CCH的药物意义重大。
淫羊藿是我国传统中草药,属小檗科淫羊藿属(EpimediumL)植物,具有“补肾阳,强筋骨,祛风湿,益气力,强志”等功效[5]。淫羊藿次苷II(Icariside II,ICS II)是淫羊藿的黄酮类活性成分之一[6],具有多重生物学和药理学活性,包括抗炎、抗氧化、抗衰老、抗勃起性功能障碍和抗癌等[7]。本课题组前期研究发现,ICS II可明显减轻APP/PS1转基因AD模式小鼠、β-淀粉样蛋白25-35或链脲佐菌素诱导的大鼠学习记忆减退,其机制均与ICS II降低磷酸二酯酶5(Phosphodiesterase,PDE 5)含量有关[8-10]。此外,ICS II还可改善双侧颈总动脉永久结扎(bilateral common carotid artery occlusion,BCCAO)诱导的CCH大鼠学习记忆减退[11],但其机制尚不清楚。因此,本研究采用BCCAO建立CCH模型,探究ICS II改善CCH大鼠学习记忆减退的机制,为研发治疗VD的药物提供药理学基础。
1 材料与方法
1.1 仪器与材料 Multiskan Go 酶标仪(美国Thermo公司);蛋白变性仪、逆转录仪、台式离心机(德国Eppendorf公司);DDY-10型三恒电泳仪、半干转印槽、全自动电泳凝胶成像分析系统(美国Bio-Rad公司); ICS II(批号:MH150601S02,经HPLC检测其纯度≥98%)购于中国南京泽朗生物科技有限公司;转化生长因子β1(transforming growth factor-beta1,TGF-β1)一抗(批号:ab92486)(美国Abcam);Smad2一抗(批号:#5339)、Phospho-Smad2(p-Smad2)一抗(批号:#18338)(美国Cell Signaling Technology);β-肌动蛋白(β-actin)一抗(中国碧云天);PDE 4、PDE 5试剂盒(上海江莱生物科技有限公司);BCA蛋白浓度含量测定试剂盒、彩色预染蛋白质Marker、山羊抗兔免疫球蛋白G(辣根过氧化物酶标记)、山羊抗小鼠免疫球蛋白G(辣根过氧化物酶标记)、5×上样缓冲液、ECL发光剂(江苏碧云天生物技术研究所)。
1.2 实验动物与分组 3月龄,SPF级,健康雄性Sprague-Dawley(SD)大鼠36只(购于第三军医大学实验动物中心(重庆),许可证号:SCXK2012-0011,体重为250±20 g),通过简单随机抽样法分为:假手术组(sham)、假手术+ICS II高剂量组(sham + ICS II 16 mg/kg)、模型组(BCCAO)、ICS II低剂量组(BCCAO + ICS II 4 mg/kg)、ICS II中剂量组(BCCAO + ICS II 8 mg/kg)、ICS II高剂量组(BCCAO + ICS II 16 mg/kg),每组样本含量为6只。
1.3 慢性脑低灌注模型建立 大鼠称重,2%戊巴比妥钠溶液(麻醉剂量为50 mg/kg)经腹腔注射麻醉,剔除颈部毛发,仰卧位固定于鼠板上,用碘伏对颈部进行消毒处理,然后正中切开颈前皮肤,用玻璃分针分离出双侧颈总动脉,然后分别用5-0医用非吸收线结扎,最后缝合伤口,并涂抹红霉素软膏(防止伤口发炎),慢性脑低灌注模型制备完成。假手术组大鼠除不结扎双侧颈总动脉外,其余操作与模型动物相同。造模10 d后给药,ICS II低、中、高剂量组每日分别灌胃ICS II 4、8、16 mg/kg,假手术组和模型组灌胃等体积蒸馏水,连续给药28 d。第29天,将各组大鼠麻醉处死,断头取脑,分离双侧海马组织,保存于-80 ℃冰箱备用。
1.4 酶联免疫吸附试验 取各组大鼠海马组织,加入500 μL预冷0.01 mmol/μL PBS(pH 7.2~7.4)溶液,用研磨棒捣碎脑组织,冰上静置30 min,956×g、4℃、离心20 min,取上清液,分装后-80 ℃冰箱保存备用;采用BCA法测定蛋白浓度;然后,按照酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒说明书具体步骤操作,分别检测PDE4、PDE5的含量。
1.5 Western blot实验 取各组大鼠海马组织,加入RIPA裂解液,用研磨棒捣碎,冰上静置30 min后,956×g、4℃、离心15 min,取上清液,分装后-80 ℃冰箱保存备用;采用BCA法测定蛋白浓度;每个样本以30 μg的上样量进行电泳,待蛋白完全分离,将其转移到PVDF膜上,用TBST缓冲液洗膜3次,每次10 min,然后用5%脱脂牛奶封闭2 h,再洗3次后分别用TGF-β1(1∶1 000),Smad2(1∶1 000),p-Smad2(1∶1 000),β-actin(1∶5 000)一抗孵育过夜,次日取出,TBST缓冲液洗膜3次,然后用山羊抗兔IgG(HRP标记)、山羊抗小鼠IgG(HRP标记)的二抗(1∶5 000)室温下孵育1 h,洗膜3次,最后用ECL化学发光试剂显影,并使用Quantity One-4.6.7进行量化。
2 结果
2.1 ICS II对BCCAO诱导的CCH大鼠海马中PDE 4、PDE 5蛋白含量的影响 通过ELISA法测定海马PDE 4和PDE 5蛋白含量的研究结果表明,与假手术组相比,模型组大鼠海马中PDE 4和PDE 5蛋白表达显著增加。然而,连续灌胃ICS II 8 mg/kg和16 mg/kg 28 d显著抑制了BCCAO诱导的大鼠海马中PDE 4和PDE 5蛋白表达的增加,但是ICS II 4 mg/kg无差异[F(5,29)= 164.5,P<0.001;F(5,30)= 21.1,P<0.001](P<0.01;P<0.01;P<0.05;P<0.01,见图1)。
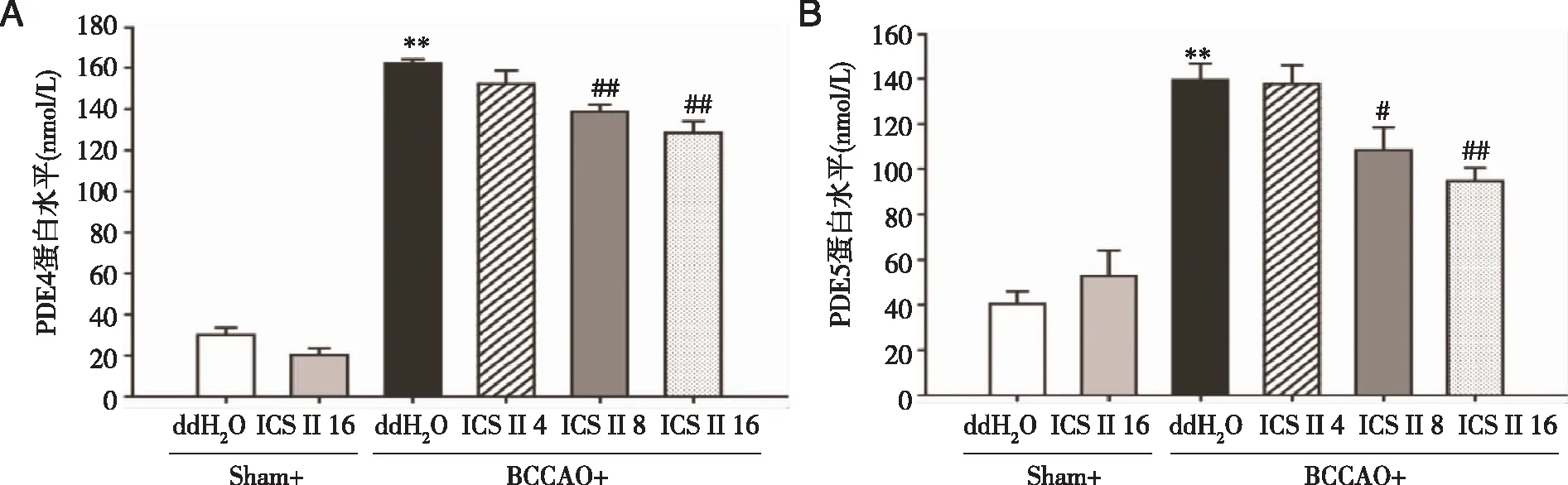
A:海马PDE 4蛋白表达的定量分析;B:海马PDE 5蛋白水平的定量分析;n=5~6;**:与Sham组相比,P<0.01;#:与BCCAO组相比,P<0.05;##:与BCCAO组相比,P<0.01。图1 ICS II抑制BCCAO诱导的CCH大鼠海马PDE 4和PDE 5蛋白水平
2.2 ICS II对BCCAO诱导的CCH大鼠海马中的TGF-β1蛋白的影响 通过Western blot测定海马TGF-β1蛋白表达的研究结果显示,与Sham组比较,BCCAO组大鼠海马中TGF-β1蛋白表达显著增加(P<0.01);连续灌胃ICS II 8 mg/kg和16 mg/kg 28 d显著降低BCCAO诱导的CCH大鼠海马中TGF-β1蛋白表达(P<0.05;P<0.01),但是ICS II 4 mg/kg无差异[F(5,12)=13.4,P=0.001](P>0.05)(见图2)。
2.3 ICS II对BCCAO诱导的CCH大鼠海马中Smad2磷酸化的影响 通过Western blot测定海马Smad2、p-Smad2蛋白表达,结果显示,与Sham组比较,BCCAO组大鼠海马中Smad2蛋白磷酸化水平显著升高(P<0.01);连续灌胃ICS II 8 mg/kg和16 mg/kg 28 d显著降低了BCCAO诱导的CCH大鼠海马中Smad2蛋白磷酸化水平(P<0.01;P<0.01),但是ICS II 4 mg/kg无差异[F(5,12)= 9.1,P= 0.001](P>0.05)(见图3)。

A:海马TGF-β1蛋白电泳条带;B:海马TGF-β1蛋白的定量分析;n=3;**:与Sham组相比,P<0.01;#:与BCCAO组相比,P<0.05;##:与BCCAO组相比,P<0.01。 图2 ICS II抑制BCCAO诱导的CCH大鼠海马TGF-β1蛋白表达

A:海马Smad2、p-Smad2蛋白电泳条带;B:海马p-Smad2蛋白的定量分析;(n=3);**:与Sham组相比,P<0.01;##:与BCCAO组相比,P<0.01。 图3 ICS II抑制BCCAO诱导的CCH大鼠海马Smad2蛋白磷酸化
3 讨论
CCH在VD的进行性认知功能障碍中起关键作用。BCCAO大鼠慢性期的神经病理改变与人类阿尔茨海默病和老龄化时CCH相似[12],因此,被广泛用于研究CCH对认知功能损害以及神经变性疾病的影响。本课题组前期采用BCCAO诱导CCH模型来研究ICS II对大鼠认知功能的保护作用,结果发现BCCAO可以诱导大鼠的空间学习和记忆障碍以及神经元损伤,而ICS II可剂量依赖性地改善BCCAO导致的大鼠学习记忆功能减退[11]。但是,其作用机制尚不明确,因此,本研究进一步探索了ICS II改善CCH大鼠学习记忆减退的作用机制。
PDE 4和PDE 5分别是环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)特异性水解酶[13]。靶向抑制PDE 4和PDE 5以增强认知功能已涉及阿尔茨海默病的治疗[14]。有趣的是,我们前期研究发现ICS II是一种新型PDE 5抑制剂,可有效减轻H2O2诱导的PC12细胞死亡并改善AD大鼠模型的认知功能障碍[15-17]。本研究结果表明BCCAO大鼠海马中PDE 4和PDE 5的蛋白表达都显著增加,表明PDE 4和PDE 5都可能参与VD的发病机制,而ICS II 8、16 mg/kg可明显抑制BCCAO诱导的PDE 4和PDE 5水平的增加。但是,ICS II 4 mg/kg没有差异,可能是因为此剂量还未达到有效剂量。值得注意的是,ICS II对PDE 5的抑制作用高于对PDE 4的抑制作用,与前期研究结果一致[16]。
研究发现TGF-β1/Smad信号通路也参与VD的发病机制[18]。TGF-β1是一种多效细胞因子,主要在星形胶质细胞、小胶质细胞和海马神经元中表达,以调节中枢神经系统中的星形胶质细胞分化、小胶质细胞激活和神经元存活[19-20],其信号转导依赖于受体后的信使分子Smad来完成。来自TGF-β的信号与细胞膜表面Ⅰ型、Ⅱ型受体结合后使R-Smad(Smad2、Smad 3)磷酸化而活化,Smad2和Smad3与胞质中的Co-Smad结合形成异聚体转位进入细胞核,调节靶基因的表达[21]。有研究报道,VD患者脑脊液中TGF-β的含量呈显著升高趋势[22]。本研究结果发现,CCH大鼠海马中TGF-β1蛋白表达增加而且Smad2磷酸化水平升高。ICS II 8、16 mg/kg明显降低TGF-β1蛋白表达以及Smad2磷酸化水平。但是,ICS II 4 mg/kg没有差异,可能是因为此剂量还未达到有效剂量。
综上所述,在本实验条件下,ICS II改善BCCAO诱导的CCH大鼠认知功能障碍可能与其降低PDE 4和PDE 5蛋白表达,阻断TGF-β1/Smad2信号传导有关。为ICS II作为PDE 5的抑制剂治疗CCH所致痴呆(如VD)提供了药理学依据。

