血浆GLP-2评估严重脓毒症及脓毒性休克患者肠道功能的临床研究
方媛媛,鲁厚清
(安徽省铜陵市人民医院重症医学科 244000)
脓毒症(sepsis)是指明确或可疑的感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),诱发多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),是感染、休克、创伤等疾病的严重并发症之一,是危重症患者死亡的主要原因。随着人口的老龄化、抗菌药物耐药性增加、肿瘤发病率上升及侵入性医疗手段的增加,脓毒症的发病率在不断上升,每年全球新增数百万脓毒症患者,其中超过1/4的患者死亡[1]。脓毒症常并发肠功能衰竭,肠道黏膜屏障遭受破坏,通透性增加,肠道微生物及毒素移位,诱发加重SIRS,肠功能衰竭与脓毒症互为因果,陷入恶性循环[2]。胰高血糖素样肽-2 (glucagon-like peptide-2,GLP-2)是一种肠道特异性生长因子,可通过多方面因素促进损伤肠上皮的恢复,在肠道修复中发挥重要的生理作用。那么,并发肠道损伤的脓毒症患者,是否存在GLP-2的表达下降,GLP-2水平与脓毒症胃肠道功能损伤程度是否有关,与脓毒症的预后又是否有关?笔者做了下列研究,探讨血浆GLP-2水平评估严重脓毒症和脓毒性休克患者肠道功能及预后的价值。
1 资料与方法
1.1一般资料 选取2015年12月至2017年10月入住铜陵市人民医院ICU的60例患者作为脓毒症组,根据中国严重脓毒症/脓毒性休克治疗指南(2014)的诊断标准,确诊为严重脓毒症及脓毒性休克。同时选取铜陵市人民医院体检中心健康体检人员29例作为对照组。排除标准:(1)入住ICU时间小于3 d;(2)急性或慢性肾功能不全病史;(3)慢性肠道疾病及肠道肿瘤史。
1.2分组方法 (1)评估脓毒症患者的急性胃肠损伤(AGI)分级,根据AGI分级将脓毒症患者分为AGI Ⅰ、AGI Ⅱ、AGI Ⅲ组及AGI Ⅳ组;(2)根据患者入院14 d最终预后将脓毒症患者分为生存组与死亡组。
1.3观察指标 记录ICU患者的一般临床资料,包括性别、年龄、诊断及基础疾病,评估AGI分级,并随访入住后14 d的生存情况,患者入院后均按照脓毒症治疗规范进行积极治疗,在入院12 h取2 mL静脉血用酶联免疫吸附法测定GLP-2。记录体检人员的临床资料,包括性别、年龄及基础疾病,抽取2 mL空腹静脉血用于测定GLP-2,并登记患者的肌酐情况以排除有肾脏疾病者。
1.4检测方法 在酶标包被板每孔中先加入样品稀释液40 μL,再加入待测样品10 μL,将包被板充分混匀后置37 ℃温箱孵育30 min。用洗涤液将反应板充分洗涤5次,每次30 s,每孔加满洗涤液,甩干并置于吸水纸上轻拍,将孔内液体拍干。每孔加入酶标试剂50 μL,充分混匀后置37 ℃温箱孵育30 min。再次洗板后每孔先加显色剂A 50 μL,再加显色剂B 50 μL,充分混匀后置37 ℃避光反应15 min。每孔加入50 μL终止液混匀,15 min内用酶标仪在450 nm处测吸光度(A)值。根据标准样品绘制的标准曲线计算样品的实际浓度。

2 结 果
2.1两组年龄、性别、GLP-2水平比较 脓毒症组与对照组相比,性别及年龄之间的差异无统计学意义(P>0.05),脓毒症组的GLP-2水平与对照组相比明显下降,差异有统计学意义(P<0.05),见表1。
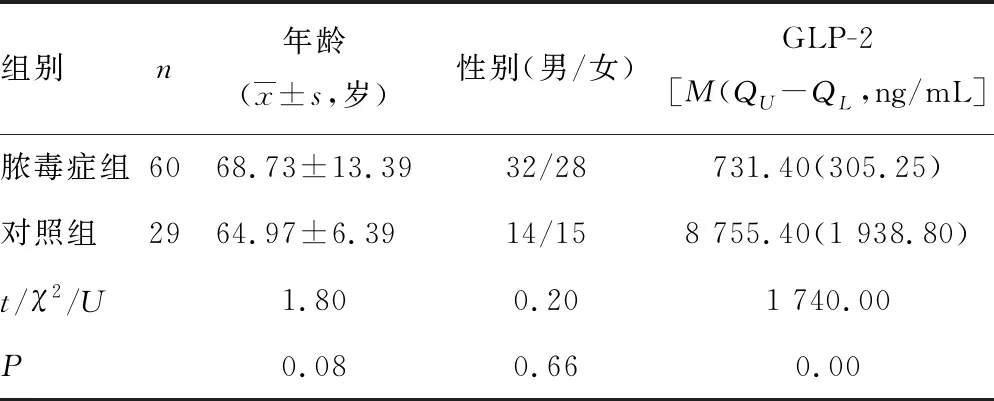
表1 脓毒症组与对照组的比较
2.2不同AGI分级脓毒症患者年龄、性别、GLP-2水平比较 不同AGI分级之间性别、年龄的差异无统计学意义(P>0.05),GLP-2水平的差异有统计学意义(P<0.05),见表2;AGIⅠ、AGI Ⅱ组比较,GLP-2水平差异无统计学意义(P>0.05),AGIⅢ、AGIⅣ组比较,GLP-2水平差异无统计学意义(P>0.05),GLP-2水平在其他组之间的差异均有统计学意义(P<0.05),见表3。
2.3AGI分级与GLP-2水平的相关性 Spearman等级相关分析显示,AGI分级与GLP-2水平(r=-0.87,P=0.00)存在负相关关系。

表2 依据AGI分级的分组比较
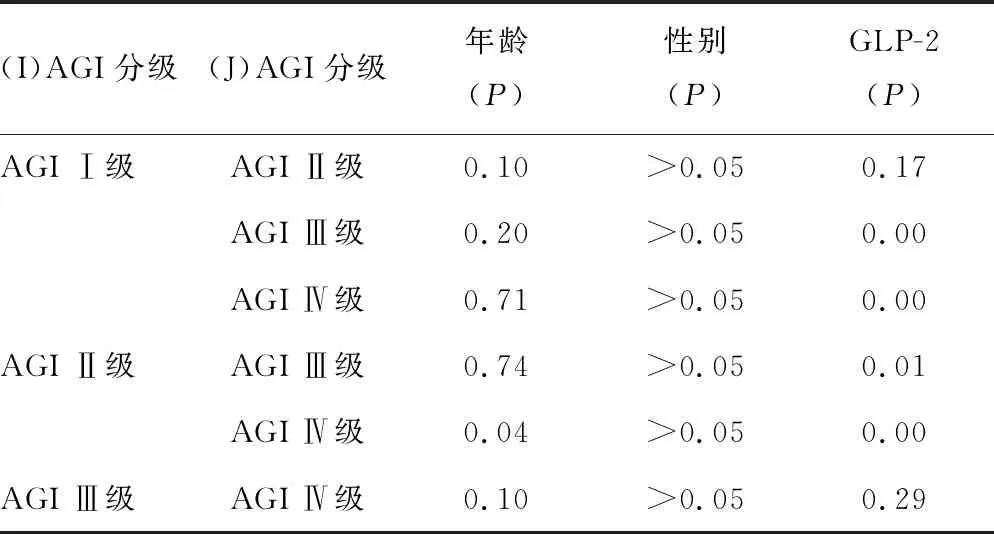
表3 AGI分级的两两比较
2.4生存组与死亡组患者年龄、性别、GLP-2水平比较 生存组与死亡组相比,性别及年龄之间的差异无统计学意义,两组之间的GLP-2水平差异无统计学意义(P>0.05),见表4。

表4 生存组与死亡组的比较
3 讨 论
脓毒症是由于病原体入侵机体导致全身炎性反应、内皮功能障碍、凝血级联反应失调及免疫功能障碍,是重症监护病房患者死亡的主要原因[3]。在2016年以前,脓毒症定义为明确或可疑的感染引起的SIRS,脓毒症可发展为严重脓毒症和脓毒性休克。严重脓毒症是指脓毒症伴由其导致的器官功能障碍和(或)组织灌注不足,脓毒性休克是指脓毒症伴其所致的低血压,虽经液体治疗后仍无法逆转[1]。2016 年 2 月《脓毒症与感染性休克定义国际共识》(即脓毒症3.0)[4]正式发表,其变化是将脓毒症定义为“因宿主对感染的反应失调而导致的危及生命的器官功能障碍” ,以感染后序贯器官衰竭评分(SOFA)增加大于或等于2分作为脓毒症的临床判断标准;弃用了 “严重脓毒症” 的概念。而感染性休克的临床诊断标准被规定为脓毒症患者经充分容量复苏后仍存在持续性低血压,需缩血管药物维持平均动脉压(MAP)≥65 mm Hg(1 mm Hg=0.133 kPa)且血清乳酸水平大于2 mmol/L[5]。但是,脓毒症3.0尚存在很多争议,有学者[6]认为目前摒除 SIRS 的时机过早, qSOFA 敏感性不佳,而 SOFA 评分需要校正。我国仍未颁布新的指南,因此本研究沿用了脓毒症2.0的诊断标准。
由于炎性反应、血流重新分布、缺血/再灌注损伤、禁食及肠外营养等因素,导致脓毒症患者的肠道极易损伤,而肠道是庞大的菌群库,为机体的潜在致病源,正常肠黏膜屏障的职责是阻止肠道内有害物质进入体循环,脓毒症时损伤的肠道无法阻止细菌以及毒素的移位[7-8],肠道损伤诱发加重SIRS,进一步发展为MODS,因此肠道常被称为脓毒症、MODS的扳机。
肠道既是脓毒症的扳机,又是脓毒症最易受损的靶器官,本研究的严重脓毒症及脓毒性休克患者均发生AGI,发病率达到了100%,AGI是指危重患者由于急性疾病引起的胃肠道功能障碍。根据严重程度,可分为4级:Ⅰ级,存在发展至胃肠道功能障碍和衰竭的风险;Ⅱ级,胃肠道功能障碍;Ⅲ级,胃肠道功能衰竭;Ⅳ级,胃肠道功能衰竭伴有远隔器官功能障碍。AGI的症状包括呕吐与反流、胃潴留、腹泻、消化道出血、麻痹性肠梗阻、肠扩张和肠鸣音异常[9]。
GLP-2是一种具有肠道保护作用的肠源性多肽,GLP-2作用于受体细胞产生5-羟色胺、血管活性肠肽和一氧化氮等具有血管活性的神经递质,增加肠黏膜的血流,促进损伤肠上皮修复[10]。GLP-2 通过IGF-1、PI3K/AKT通路刺激肠黏膜隐窝细胞的增殖,抑制肠上皮凋亡,增加细胞间的紧密连接,改善免疫系统功能,提高肠道的屏障功能,减少细菌移位[11-12],促进肠道功能酶和载体恢复以增加营养物质的吸收[13],通过多方面促进损伤肠上皮的恢复。
GLP-2由远端回肠和结肠的L细胞分泌,受摄食、神经及内分泌多种因素影响[10],因此,在研究中,为了避免摄食对于GLP-2的影响,同时不影响早期肠内营养的实施,选取入院后12 h作为GLP-2的采血时间点。
GLP-2长效类似物(teduglutide)用于治疗短肠综合征已进入临床4期实验阶段[14],炎症性肠病以及化疗相关性腹泻的治疗正在临床试验阶段,对于放射性肠炎、肠外营养导致的肠萎缩以及化疗、压力相关性的肠功能障碍等多种疾病[15-18],GLP-2的研究同样在如火如荼地开展。
但GLP-2与脓毒症的相关研究却鲜有报道,本研究发现,脓毒症患者的血浆GLP-2水平较对照组显著下降,提示GLP-2的减少可能参与脓毒症肠道损伤的发生发展。张宗兵等[19-20]通过应用内毒素腹腔注射制作脓毒症大鼠模型,外源性给予GLP-2后,与未处理组相比较,肠道黏膜组织电镜检查显示肠黏膜紧密连接蛋白表达明显增加、线粒体和细胞间紧密连接的损伤减轻、肠道细胞损伤程度明显减轻,提示GLP-2对脓毒症大鼠肠黏膜机械屏障具有一定的保护作用。那么是否能通过外源性给予GLP-2改善脓毒症患者的肠道功能,这为脓毒症肠道保护研究提供了新的方向。
本研究发现脓毒症患者血浆GLP-2水平与对照组相比有明显下降,进一步将脓毒症患者依据AGI分级进行亚组分析,结果表明4组之间GLP-2水平的差异有统计学意义。尽管GLP-2水平在AGIⅠ组与AGIⅡ组,AGIⅢ组与AGIⅣ组的差异无统计学意义,但从4组的中位数可以看出,脓毒症患者的AGI分级越高,GLP-2水平越低,而且相关分析提示二者呈负相关关系。也许进一步增加样本量,能够发现它们之间的统计学差异。本研究初步表明GLP-2水平能够在一定程度上评估脓毒症患者肠道损伤程度。接下来,笔者将脓毒症患者分为生存组与死亡组来进行分析,二者之间的GLP-2水平差异无统计学意义,这样的结论可能与本研究的样本量过小有关,GLP-2与脓毒症患者预后的关系有待进一步大样本的研究。
总之,血浆GLP-2水平有望成为评估脓毒症患者肠道功能的指标,但目前尚未发现对患者预后的评估价值,能否通过外源性给予 GLP-2来保护脓毒症肠道尚需进一步研究。

